
Revista de Ciencias Ambientales (Trop J Environ Sci). (Enero-Junio, 2018). EISSN: 2215-3896. Vol 52(1): 1-26.
DOI: http://dx.doi.org/10.15359/rca.52-1.9
URL: www.revistas.una.ac.cr/ambientales
EMAIL: revista.ambientales@una.cr
NOTA TÉCNICA
¿Pueden los micetozoos ser usados como indicadores de salud del suelo en el contexto agrícola de Costa Rica?
TECHNICAL NOTE
Can mycetozoans be used as health indicators of soil in the agricultural context of Costa Rica?
Reiner Sibaja-Matarrita
Estudiante. Escuela de Ingeniería de Biosistemas. Universidad de Costa Rica, San Pedro de Montes de Oca, Costa Rica, reiner.sibaja@ucr.ac.cr
Luis Barboza-Chinchilla
Investigador y profesor. Centro de Investigación en Matemática Pura y Aplicada. Universidad de Costa Rica, San Pedro de Montes de Oca, Costa Rica, luisalberto.barboza@ucr.ac.cr
Carlos Rojas
Investigador y profesor. Instituto de Investigaciones en Ingeniería y Escuela de Ingeniería de Biosistemas. Universidad de Costa Rica, San Pedro de Montes de Oca, Costa Rica, carlos.rojasalvarado@ucr.ac.cr
[Recibido: 05 de junio 2017. Aceptado: 02 de octubre 2017. Corregido: 2 de noviembre 2017. Publicado: 01 de enero 2018]
Resumen
El estudio de las poblaciones de micetozoos en agroecosistemas con diversas características y grados de disturbio por actividades antropogénicas es un tema con escasa investigación en el nivel mundial. Con el objeto de estudiar esta interacción, nosotros documentamos la incidencia de dos grupos de micetozoos (mixogástridos y dictiostélidos) en dos sistemas agrícolas de caña de azúcar y piña en Costa Rica. Para cada sistema de estudio cuantificamos una serie de variables edáficas, químicas y paisajísticas. Tras el análisis, encontramos que, para ambos grupos, tres variables explicaron el 99 % de la variabilidad de incidencia de estos. Para los dictiostélidos las variables fueron porcentaje de arcilla, pH y Biomasa microbiana. En el caso de los mixogástridos, estas variables fueron el Manganeso, respiración microbiana y pH. Los resultados anteriores señalan un potencial medio de uso de micetozoos como indicadores ambientales, en tanto el efecto de los sistemas de cultivo sobre la actividad de los microorganismos fue cuantificable. Sin embargo, consideramos que se requiere todavía definir el papel de las diferentes variables medidas sobre la dinámica de ambos grupos de microorganismos para poder establecer una conclusión con potencial aplicación, apoyada por datos empíricos.
Palabras clave: biosistemas, caña de azúcar, dictiostélidos, mixomicetes, mixogástridos
Abstract
The study of the populations of micetozoos in agroecosistemas with diverse characteristics and degrees of disturbance by anthropogenic activities is a subject with scarce investigation at world-wide level. In order to study this interaction, we documented the incidence of two groups of micetozoos (mixogastrids and dictyostelids) in two agricultural systems of sugar cane and pineapple in Costa Rica. For each study system we quantify a series of edaphic, chemical and landscape variables. After the analysis, we found that, for both groups, three variables explained 99% of the variability of incidence of these. For the dictyostelids, the variables were percentage of clay, pH and microbial biomass. In the case of mixogastrids, these variables were Manganese, microbial respiration and pH. The previous results indicate a potential medium for the use of micetozoos as environmental indicators, while the effect of the culture systems on the activity of the microorganisms was quantifiable. However, we believe that it is still necessary to define the role of the different variables measured on the dynamics of both groups of microorganisms in order to establish a conclusion with potential application, supported by empirical data.
Keywords: biosystems, dictyostelids, myxomycetes, myxogastrids, sugar cane
1. Introducción
En el nivel mundial se han estudiado muchos grupos de microorganismos en el suelo. Sin embargo los micetozoos no han sido fuertemente documentados (Stephenson, Fiore-Donno, & Schnittler, 2011, Hoppe & Schnittler, 2015). El impacto del uso de suelo sobre este grupo de microorganismos, uno de los más numerosos en sistemas edáficos (Feest & Stephenson, 2014) todavía es un aspecto poco estudiado. El suelo es un ambiente complejo y sus condiciones bioquímicas modifican los patrones de actividad biológica (Eldor, 2015). Es así que el estudio microbiológico de suelos, en particular con grupos de organismos poco documentados, no solo incrementa la base de conocimiento integrado sobre ecología microbiana, sino que ofrece el potencial de desarrollo de aplicaciones con esta información (Mueller & Sachs, 2015). Lo anterior puede permitir el diseño de alternativas más adecuadas para el manejo del suelo y con ello, potencialmente mejorar la eficiencia de cultivos.
En este sentido es importante entender cómo las comunidades microbianas funcionan dentro del paisaje heterogéneo del suelo (Kaleita, Schott, Hargreaves, & Hofmockel, 2017). Por lo tanto, entender procesos clave en las interacciones microbianas asociados a las plantas como sustentabilidad de la agricultura, restauración del ecosistema, biomasa entre otros, es importante (Dubey, Tripathi, & Abhilash, 2015). En el contexto moderno, lo anterior representa una línea base de sostenibilidad ambiental integrada, ya que tiene el potencial de conectar disciplinariamente y de forma contextual, el trabajo aislado de diferentes profesionales. Este enfoque multidisciplinario es idóneo en la actualidad.
En el presente estudio, hemos decidido evaluar micetozoos en el contexto anteriormente explicado. Este grupo de amebas de suelo (Amebozoa, ver Stephenson et al. 2011 y Romeralo, Escalante & Baldaulf, 2012) está compuesto de dos subgrupos filogenéticamente estables conocidos como mixogástridos y dictiostélidos (Cavalier-Smith et al., 2015) y representa el grupo más diverso de amebas clásicas. Los micetozoos se caracterizan por poseer cuerpos fructíferos microscópicos y estados vegetativos activos en todos los ecosistemas terrestres en el planeta (Fiore-Donno et al., 2010). El mayor esfuerzo de investigación se ha llevado a cabo con el primer grupo a pesar de que en zonas tropicales los dictiostélidos, al menos de forma general, son muy comunes. Es interesante que el potencial de aplicación de estos dos grupos como indicadores de cambio estructural en sistemas biológicos es todavía desconocido (Swanson, Vadell, & Cavender, 1999). Lo anterior responde parcialmente al escaso interés aplicado en la mayoría de los estudios con estos dos grupos de microorganismos en suelo (Rojas & Kryvomaz, 2017).
El ciclo de vida de estos organismos, abarca dos etapas tróficas muy diferentes, una que consiste en amebas uninucleadas con o sin flagelos, y otra que consiste en una estructura multinucleada conocida como el plasmodio, la etapa más visible. Durante la esporulación que se da tras la etapa plasmodial, se producen muchas esporas pequeñas que dan origen a células ameboflageladas. Lo anterior les confiere un poder de movilidad diferente al de las otras amebas y les permite sobrevivir en condiciones secas, hiperhúmedas y altamente variables (Clark & Ef., 2015). Al ser depredadores de bacterias, los micetozoos controlan su abundancia y modulan la capacidad fisiológica o el vigor de la población bacteriana (Esteban, Finlay, & Warren, 2014). Algunos estudios han mostrado que los mixogástridos son fáciles de detectar e identificar, por lo que pueden servir como indicadores útiles para evaluar la perturbación del suelo (Feest & Stephenson, 2014).
La relación entre las especies y un biosistema dependen del entorno físico, la dinámica de transferencia de energía y los mecanismos de control de esta última (Pimentel, 2007). Así, para poder comprender si los cambios en un sistema tienen un efecto en el nivel biológico, es necesario diseñar experimentos que permitan incrementar la cantidad de información disponible sobre estas relaciones. Por lo anterior, se diseñó la presente investigación con el objetivo de documentar, utilizando una estrategia multifactorial, las posibles diferencias en la incidencia de los dos grupos de mixogástridos entre 1) dos sistemas agrícolas y 2) entre cada sistema y el entorno boscoso circundante.
Nuestra idea detrás de este trabajo ha sido generar información base para definir el potencial que tienen los mixogástridos como indicadores ambientales relacionados con en el uso y manejo de la tierra. Lo anterior no solo es relevante para definir posibles estrategias de manejo alternativo del suelo en los cultivos estudiados, sino para determinar líneas base de información que puedan ser utilizadas en un contexto de seguimiento temporal por efecto de fenómenos como cambio climático (Kryvomaz y Stephenson, 2017).
2. Metodología
2.1 Zonas de estudio
El estudio presente lo realizamos por completo en Costa Rica durante el periodo 2016-2017. Para ello, nosotros seleccionamos dos zonas del país con disponibilidad de cultivos de caña de azúcar y piña producidos en suelos clasificados como inceptisoles con predominancia de textura arcillosa y dentro de la zona climática de bosque tropical lluvioso. En el caso del primer cultivo, seleccionamos un sitio cercano a la comunidad de Atirro en el cantón de Jiménez de Cartago y en el caso del segundo, seleccionamos un sitio cercano a la comunidad de Zapote en el cantón de Sarapiquí de Heredia (Figura 1).
El sitio en el cantón de Jiménez presentó topografía plana en el área de cultivo y una ligera pendiente en el bosque (Figura 1A). El suelo de la zona presentó ligeros problemas de drenaje y se aplican agroquímicos de manera moderada con el objetivo de mejorar el rendimiento. Registramos además la mecanización moderada. El espaciamiento entre plantas fue de 1 m aproximadamente, con pequeños canales de drenaje intercalados.
El sitio en el cantón de Sarapiquí, presentó la misma topografía en las zonas de cultivo y de bosque que el sitio anterior (Figura 1B). Sin embargo, los canales de drenaje fueron de aproximadamente un metro de profundidad. El sistema era altamente mecanizado con uso intensivo de agroquímicos, debido a la necesidad de controlar plagas y mejorar condiciones de la piña.
En ambos casos la selección de las parcelas muestreadas estuvo determinada por la presencia de bosque aledaño a la plantación. Las parcelas muestreadas tenían un área aproximada de una hectárea, con una distancia de 100 m entre el borde y la zona de bosque. El muestreo en el cultivo de caña de azúcar se realizó entre periodos productivos, por lo que había maleza en el suelo y restos de una primera cosecha. Mientras que en piña se realizó durante el crecimiento del cultivo, por lo que no había malezas, solo plantas de piña.
En cada sitio seleccionamos 50 puntos de muestreo al azar. La mitad de los puntos los ubicamos dentro de la zona del cultivo y el resto los seleccionamos dentro del bosque para un total de 200 muestras de suelo recolectadas en el estudio completo. Así, los cuatro sistemas de estudio fueron: 1) cultivo de caña de azúcar (abreviado de acá en adelante como CCA), 2) bosque cercano a caña de azúcar (BCA), 3) cultivo de piña (CP) y bosque cercano a cultivo de piña (BP). Cada punto de muestreo fue georreferenciado. En ellos se recolectaron 350 g de suelo para su posterior análisis.
2.2 Variables de respuesta
Las muestras de suelo fueron procesadas para determinar una serie de propiedades químicas, físicoestructurales y biológicas. Trabajamos en el Laboratorio de Suelos y Foliares del Centro de Investigaciones Agronómicas (CIA) de la Universidad de Costa Rica, en donde se determinaron las concentraciones de P, K, Ca, Mg, Na, Fe, Cu, Zn, Mn, B, S con la metodología de Díaz-Romeu y Hunter (1982). En el Laboratorio de Microbiología Agrícola, del mismo centro de investigación, trabajamos la cuantificación de biomasa microbiana con la metodología de Vance, Brookes, & Jenkiinson, (1987). Además, trabajamos en el Laboratorio de la Unidad de Recursos Forestales del Instituto de Investigaciones en Ingeniería, donde realizamos la cuantificación asociada con la respiración del suelo siguiendo la metodología de Jenkinson & Powlson (1976), el pH con el método de Henríquez, Bertsch, & Salas (1995), el grado de retención de agua y la textura del suelo con la metodología de Whiting, Wilson, & Card (2002).
La incidencia de micetozoos se midió por medio del protocolo estándar de aislamiento de micetozoos (Spiegel et al., 2005) con la modificación de usar platos de petri divididos con una bacteria diferente en cada compartimento. Para lo anterior se usaron Escherichia coli y Bacillus subtilis. El inóculo original de suelo se hizo a partir de una dilución 1:10 (suelo-agua) y de añadir hojas de bosque doblemente autoclavadas, como cebo de crecimiento para mixogástridos. Para este estudio se registraron únicamente los plasmodios de mixogástridos y los esporóforos de dictiostélidos.
Además de lo anterior, para cada sistema de estudio obtuvimos imágenes Landsat 8 del 3 de abril y el 16 de junio del 2016. Estas imágenes fueron procesadas en ArcMap 10.2 para obtener los valores del Índice Normalizado de Diferencia de Vegetación (NDVI). Con las mismas imágenes realizamos una caracterización rápida del uso de la tierra en un área correspondiente a 2.6 kilómetros cuadrados alrededor de los sitios de muestreo. De esta forma logramos determinar los porcentajes de: 1) bosque, 2) ríos o cuerpos de agua, 3) zonas agrícolas y 4) edificios en las zonas de estudio. Esta información adicional la utilizamos para evaluar el efecto de variables de paisaje sobre los resultados registrados de los dos grupos de micetozoos.
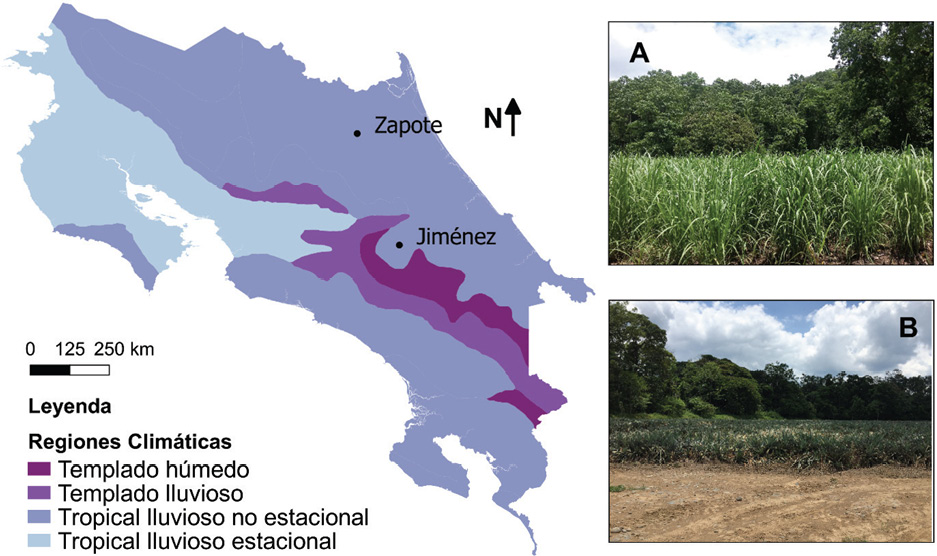
Figura 1. Localización de los dos sitios de estudio en el contexto del presente trabajo. A. Cultivo de caña de azúcar en el cantón de Jiménez, B. Cultivo de piña en el cantón de Sarapiquí
2.3 Análisis estadísticos
Los datos en principio los hemos analizado utilizando estadística descriptiva y pruebas de hipótesis con un valor de rechazo de la hipótesis nula de 0.05 y utilizando el número de registros de ambos grupos de micetozoos, por separado, como variable de respuesta. Para evaluar el peso de las diferentes variables sobre la distribución de los datos utilizamos regresiones múltiples y de Lasso (Tibshirani, 1996, Hastie, Tibshirani, & Friedman, 2009). En ambos casos, el número de variables usadas fue diferente por efecto de dimensionamiento, en los dos se realizó selección de variables, para lo cual, en la regresión múltiple se utilizó el criterio de selección de Akaike y en el caso de la regresión de Lasso esta por sí sola hace selección de variables. Posteriormente hemos agrupado las variables seleccionadas de ambos análisis en un nuevo conjunto de datos que analizamos con la técnica de componentes principales (PCA). Todo el análisis lo llevamos a cabo con el programa RStudio Versión 1.0.136.
3. Resultados
En suelos de los cuatro sistemas de estudio analizados se detectó la presencia de ambos grupos de micetozoos. Con excepción de CP, todos los otros sistemas estudiados mostraron valores más altos de incidencia de dictiostélidos que de mixogástridos. El suelo de CP presentó los valores de incidencia más bajos de los cuatro sistemas estudiados (Figura 2). CP fue el sistema de estudio con los valores más bajos de pH, respiración microbiana, concentración de calcio y manganeso, así como los valores más altos de arena, potasio, hierro y fósforo (Cuadro 1).
Cuadro 1. Valores promedios con desviación estándar de las variables físicas, químicas y biológicas analizadas en el suelo de cultivo de caña de azúcar (CCA), bosque cercano a caña de azúcar (BCA), cultivo de piña (CP) y bosque cercano a cultivo de piña (BP)
|
Variables |
CCA |
BCA |
CP |
BP |
|
Porcentaje de arena |
36.28 (6.53) |
39.14 (6.67) |
42.89 (6.15) |
45.27 (6.33) |
|
Porcentaje de limo |
15.29 (3.31) |
14.00 (3.18) |
17.00 (3.56) |
19.00 (2.82) |
|
Porcentaje de arcilla |
48.43 (6.09) |
46.86 (6.34) |
39.68 (5.85) |
36.20 (5.83) |
|
RA1 (mL agua/g suelo) |
1.20 (0.11) |
1.28 (0.16) |
1.34 (0.15) |
1.33 (0.10) |
|
pH |
5.33 (0.20) |
4.98 (0.20) |
4.84 (0.10) |
5.81 (0.10) |
|
BM1 (mg C/kg suelo) |
49.4 (17.0) |
122.6 (44.0) |
56.0 (29.0) |
35.2 (16.0) |
|
RM1 CO2-C (mg/g día) |
0.20 (0.10) |
0.36 (0.16) |
0.14 (0.04) |
0.26 (0.11) |
|
Calcio (cmol(+)/L) |
17.59 |
13.33 |
7.49 |
11.47 |
|
Manganeso (cmol(+)/L) |
4.70 |
3.17 |
2.53 |
3.59 |
|
Potasio (cmol(+)/L) |
0.29 |
0.29 |
0.77 |
0.54 |
|
Fósforo (mg/L) |
4.00 |
8.00 |
CellOverride-1
17.00 |
|
|
Zinc (mg/L) |
1.90 |
4.40 |
1.80 |
2.10 |
|
Cobre (mg/L) |
10.00 |
14.00 |
9.00 |
9.00 |
|
Hierro (mg/L) |
105.00 |
163.00 |
240.00 |
182.00 |
|
Magnesio (mg/L) |
49.00 |
56.00 |
64.00 |
10.00 |
|
NDVI 3 abril |
0.22 (0.05) |
0.51 (0.03) |
0.29 (0.04) |
0.48 (0.09) |
|
NDVI 16 jun |
0.26 (0.06) |
0.42 (0.02) |
0.36 (0.04) |
0.53 (0.09) |
|
Porcentaje de bosque |
44.62 |
44.62 |
16.21 |
16.21 |
|
Porcentaje de río |
2.05 |
2.05 |
0.00 |
0.00 |
|
Porcentaje de zona agrícola |
52.90 |
52.90 |
82.96 |
82.96 |
|
Porcentaje de edificios |
0.43 |
0.43 |
0.82 |
0.82 |
|
Incidencia de mixogástridos |
24 % |
10 % |
18 % |
6 % |
|
Incidencia de dictiostélidos |
84 % |
38 % |
10 % |
60 % |
|
Incidencia de micetozoos |
54 % |
43 % |
14 % |
33 % |
1 RA= retención de agua, BM= biomasa microbiana, RM= respiración microbiana
La cuantificación de biomasa microbiana evidenció valores diferentes para cada sistema, lo cual esperábamos ya que esta variable es sensible a pequeños cambios en el suelo. Sin embargo, el valor más alto para esta última, estuvo asociado con el sistema BCA, el cual mostró valores de incidencia de micetozoos en niveles intermedios. En el caso de la respiración microbiana, los valores más altos asociados fueron con BCA, lo cual indica mayor actividad microbiana en estos sistemas. Este parámetro fue más bajo en CP que en CCA.
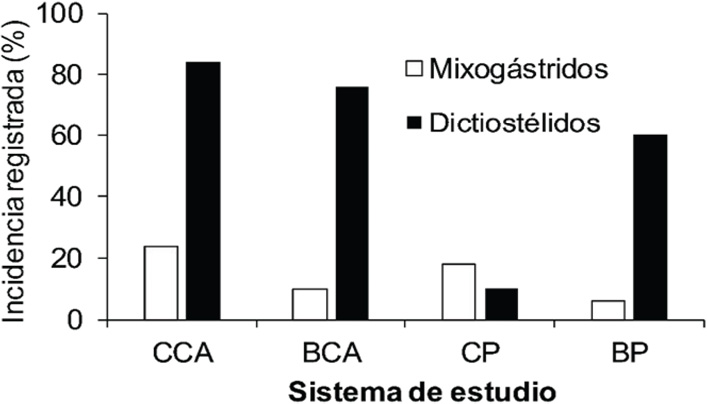
Figura 2. Incidencia porcentual de mixogástridos y dictiostélidos en los cuatro sistemas de estudio analizados (CCA: Cultivo de caña, BCA: Bosque cercano a caña, CP: Cultivo de piña, BP: Bosque de piña)
Las variables seleccionadas de ambas regresiones, se agruparon para realizar los componentes principales (Cuadro 2), donde el análisis de PCA da como resultado que en los mixogástridos los niveles de manganeso, respiración microbiana y pH fueron los tres componentes más importantes. Estas tres variables explicaron un 99 % de la variación de presencia de mixogástridos. De forma similar, para el caso de los dictiostélidos, las tres variables más importantes fueron el porcentaje de arcillas, el pH y la biomasa microbiana, al explicar alrededor de un 99 % de la variación de presencia de dictiostélidos.
Cuadro 2. Resultados de los componentes principales para los mixogástridos y dictiostélidos
|
Componentes principales |
Mixogástridos |
Dictiostélidos |
|||
|
% Varianza |
Variable |
% Varianza |
Variable |
||
|
1 |
51.81 |
Mn |
55.57 |
% Arcilla |
|
|
2 |
35.36 |
Respiración Microbiana |
34.49 |
pH |
|
|
3 |
12.83 |
pH |
9.93 |
Biomasa Microbiana |
|
Los resultados de los componentes principales para ambos grupos se muestran para los dos primeros componentes (Figuras 3 y 4), donde en el caso de los mixogástridos la única variable que se relacionó con ambos cultivos fue el manganeso. Esto nos está mostrando una sensibilidad hacia este nutriente en específico. Lo cual se puede deber al uso de agroquímicos o plaguicidas para controlar los parámetros que afectan al cultivo.
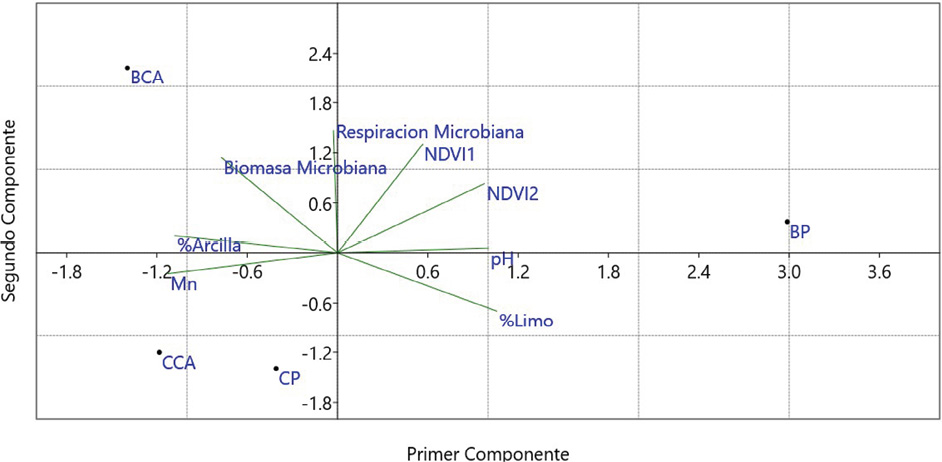
Figura 3. Visualización del análisis PCA para los dos componentes principales asociados con mixogástridos en este estudio.
En el caso de los dictiostélidos no se observó que ningún parámetro estudiado estuviera relacionado con ambos cultivos. Lo que si se encontró fue que variables químicas como potasio y fósforo tienen una relación con el cultivo de piña, confirmando el resultado de la regresión de Lasso donde el modelo seleccionado consideraba ambas variables. Esto ratifica una sensibilidad en particular de los dictiostélidos a estos nutrientes, tomando en cuenta que de momento se desconoce cuáles son las cantidades exactas que afectan a este grupo en particular.
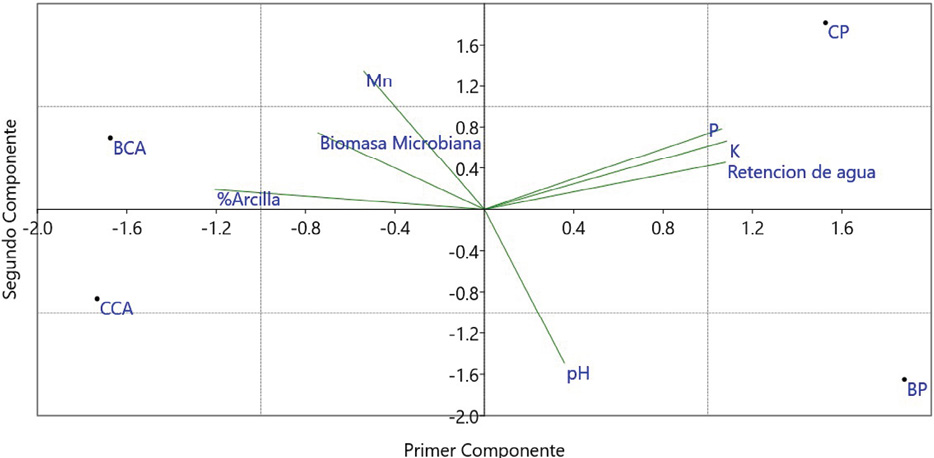
Figura 4. Visualización del análisis PCA para los dos componentes principales asociados con mixogástridos en este estudio
En el caso de las variables paisajísticas, el Índice de Vegetación de Diferencia Normalizada (NDVI) (Figura 5), se presentó en los valores de rango para ambas zonas de estudio, sin contar con diferencias entre las imágenes de diferentes fechas

Figura 5. Resultados del NDVI para cada zona estudiada el 3 de abril, donde la imagen de la derecha presenta cultivo de caña de azúcar y la imagen de la izquierda cultivo de piña
El porcentaje de uso de suelo para cada zona (Cuadro 3) se calculó considerando que los sectores agropecuarios representan las zonas de ganadería y cultivos. En el caso del porcentaje de ríos se consideró cualquier cuerpo de agua como ríos, riachuelos o lagos. Mientras en el porcentaje de edificios se tomó en cuenta cualquier infraestructura hecha por el hombre sin importar sus funciones. En ambos casos predominaron los sectores agropecuarios.
Cuadro 3. Resultados del porcentaje de uso de suelo para cada zona estudiada
|
Zona |
% Bosque |
% Río |
% Agropecuario |
% Edificios |
|
Jiménez |
44.62 |
2.05 |
52.90 |
0.43 |
|
Sarapiquí |
16.21 |
0.00 |
82.96 |
0.83 |
4. Discusión
En la presente investigación pudimos registrar información interesante sobre la relación entre micetozoos y los sistemas de suelo estudiados. Por ejemplo, el suelo de todos los sistemas de estudio mostró un pH bajo. Sin embargo, los valores registrados se encontraron dentro del rango en el que los micetozoos sobreviven (Keller & Everhart, 2010). Según (Crowley & Alvey, 2002), la relación del pH con la estructura de la comunidad microbiana del suelo es resultado de la tolerancia de los microorganismos a un valor específico externo, ya que las células deben mantener el pH de su citoplasma casi neutro.
Se realizó un ANDEVA con una prueba de Tukey con un α=0.05 para observar diferencias significativas en el pH. En donde se encontró que todos los ambientes son diferentes a excepción del cultivo de piña con bosque aledaño a caña. Esto se puede deber a que el orden de suelos de ambas zonas pertenece a los inceptisoles, los cuales tienen como característica pH bajos, lo que explica los valores en ambas zonas. En el caso del cultivo de piña, probablemente no se cuenta con valores más altos, ya que no se ha realizado un encalado adecuado, caso contrario con el cultivo de caña donde los valores fueron más elevados.
Con respecto a los resultados de respiración microbiana, es interesante tomar en cuenta que se ha documentado que una alta adición de nitrógeno por vía antropogénica aumenta este parámetro (Zhou et al., 2014). Lo anterior no es sorprendente debido al efecto de otros factores, pero dentro del contexto de cambio climático y seguimiento a través del tiempo, los valores que reportamos en este estudio representan un importante insumo de análisis. De forma similar, como se ha visto en otros trabajos, pequeñas variaciones en la temperatura del suelo pueden ser determinantes en modificar la estructura de los microorganismos presentes en un sitio (Wang et al., 2014). Por tanto, a pesar de que es intuitivo pensar que la respiración microbiana es mayor en bosques que en sistemas de cultivo, como ha sido registrado en este trabajo, es importante observar que el valor más bajo asociado con CP quizás sugiere que este sistema es menos resiliente que CCA.
De esta forma, el bosque representaría un biosistema de refugio más que un biosistema de actividad estable. Si bien es cierto que la anterior observación tiene un alto grado de especulación, al mismo tiempo plantea una hipótesis de trabajo para estudios a futuro que no puede ser respondida todavía. En experimentos paralelos todavía no publicados, el tercer autor de este trabajo encontró que cuando se estudiaron 12 doce biosistemas con características paisajísticas diferentes en todo el territorio de Costa Rica, los que mostraron los valores más altos de incidencia fueron precisamente los parches de bosque asociados a monocultivos.
Los resultados de los análisis de PCA son importante en el contexto de salud de suelo, ya que como ha sido establecido por otros autores (Cardoso et al., 2013) con una estrategia multiescala y multivariada como la utilizada en el presente estudio, se puede determinar el efecto de un biosistema edáfico sobre un grupo de organismos. Lo anterior se basa en el principio de que una alta diversidad de formas biológicas tiende a ser un excelente indicador de salud del suelo, especialmente en el contexto agrícola moderno (Bunning & Jimenez, 2003), y debería de promoverse su estudio, como lo refleja la presente investigación.
En todo caso, debido a que el nivel de manganeso en el suelo fue la variable estudiada que mejor explicó la variabilidad de los datos para un grupo en específico, la pesquisa ha generado como resultado colateral la necesidad de enfocarse en esta variable en futuros estudios. Pareciera, por lo que hemos observado en el presente trabajo, que el manganeso tiene el potencial de aportar una clave más para comprender la relación dinámica entre mixogástridos y el suelo.
En el caso de los dictiostélidos se encontraron resultados interesantes donde el potasio y fósforo muestran un efecto sobre este grupo en específico. Los resultados de la regresión de Lasso seleccionaron estas variables como las que explicaban mejor el modelo estadístico y además al graficar el primer componente contra el segundo, se observó que dichas variables están relacionadas directamente con la plantación de piña. Algún efecto por las labores agrícolas como pesticidas o agroquímicos tiene una influencia directa en los dictiostélidos.
5. Conclusiones
Los micetozoos pueden funcionar como indicadores ambientales debido a su sensibilidad a variables como pH, respiración microbiana o ciertos nutrientes (Mn, P, K) en el suelo, pero se debe estudiar su correcta implementación. Con los datos obtenidos en este trabajo se generó información básica y limitada, pero determinante, para estudiar el potencial de micetozoos como indicadores ambientales en sistemas edáficos.
A partir de esta investigación, podemos decir que el potencial existe, pero requerimos más estudio en otros niveles, en particular, para determinar la relación en el nivel de especies con los sistemas de suelo y el rol del manganeso como limitante de la actividad biológica en el grupo. De forma similar, una ampliación del presente trabajo, para conocer la dinámica de los micetozoos en otros tipos de suelo y cultivos también ayudaría a comprender su real aplicabilidad en el contexto en el que se proponen y sus posibles aplicaciones en el área de conservación de suelos.
Particularmente los mixogástridos son el grupo que presentan una sensibilidad al manganeso relacionado con las dos zonas de cultivo. Pero los dictiostélidos son más receptivos a variables químicas. Igualmente, los dictiostélidos predominan en todos los ambientes menos en el cultivo de piña. Lo cual es un indicador que el efecto del hombre en particular para este cultivo, está teniendo una influencia en la incidencia de este grupo.
En el caso de las variables paisajísticas como el NDVI, se mostró un crecimiento saludable de ambos cultivos, pero al momento del estudio, considerando todos los parámetros, no mostró un peso específico en la incidencia de los micetozoos. Las dos zonas de estudio en su mayoría son sectores agrícolas, pero el hecho de que los alrededores del muestreo presenten este escenario, no mostró tampoco una relación directa con la incidencia de los micetozoos.
Es importante recordar que este estudio es un primer paso para el inicio de la investigación de los micetozoos en ámbito agrícola, por lo que el fomentar el estudio de estos es importante para tener un panorama más amplio sobre este grupo. Esta limitante no permite dar una respuesta completa al título, ya que no se estudió todos los escenarios posibles, pero a pesar de ser un primer paso, se encontraron indicios de un posible uso como indicadores.
6. Agradecimientos
Parte de esta investigación fue realizada en el contexto del proyecto 731-B5-058 de la Universidad de Costa Rica. Agradecemos a Pedro Rojas, Randall Valverde y Steven Umaña por su ayuda en el desarrollo de la misma. Además, expresamos nuestro agradecimiento al Laboratorio de Microbiología Agrícola del Centro de Investigaciones Agronómicas (CIA) por su ayuda con pruebas de laboratorio y aportes al trabajo. Finalmente, agradecemos a la revista y a las personas revisoras anónimas por sus comentarios que ayudaron a mejorar la versión final del artículo.
7. Referencias
Bunning, S., & Jimenez, J. (2003). Indicators and Assessment of Soil Biodiversity/Soil Ecosystem Functioning for Farmers and Governments. In OECD Expert Meeting on indicators of Soil Erosion and Soil Biodiversity. Rome.
Cardoso, E. J. B. N., Vasconcellos, R. L. F., Bini, D., Miyauchi, M. Y. H., Santos, C. A. dos, Alves, P. R. L., … Nogueira, M. A. (2013). Soil health: looking for suitable indicators. What should be considered to assess the effects of use and management on soil health? Scientia Agricola, 70(4), 274-289. Doi: 10.1590/S0103-90162013000400009
Cavalier-Smith, T., Fiore-Donno, A. M., Chao, E., Kudryavtsev, A., Berney, C., Snell, E. A., & Lewis, R. (2015). Multigene phylogeny resolves deep branching of Amoebozoa. Molecular Phylogenetics and Evolution, 83, 293-304. Doi: 10.1016/j.ympev.2014.08.011
Clark, J., & Ef, H. (2015). Myxomycete plasmodial biology: a review, 6(October), 643-657. Doi: 10.5943/mycosphere/6/6/1
Crowley, D. E., y Alvey, S. A. (2002). Regulation of microbial processes by soil pH. In: Z. Rengel, (Ed.). Handbook of Plant Growth: pH as the Master Variable. EE. UU.: Marcel Dekker.
Díaz-Romeu, R. y Hunter, A. (1982). Metodología de muestreo de suelos, análisis químico de suelos y tejido vegetal y de investigaciones en invernadero. Turrialba: CATIE.
Dubey, R. K., Tripathi, V., & Abhilash, P. C. (2015). Book Review: Principles of Plant-Microbe Interactions: Microbes for Sustainable Agriculture. Frontiers in Plant Science, 6(November), 1-448. Doi: 10.3389/fpls.2015.00986
Eldor, P. (2015). Soil Microbiology, Ecology, and Biochemistry. In Soil Microbiology, Ecology and Biochemistry (pp. 1-14). Elsevier. Doi: 10.1016/B978-0-12-415955-6.00001-3
Esteban, G. F., Finlay, B. J., & Warren, A. (2014). Free-Living Protozoa. Thorp and Covich’s Freshwater Invertebrates: Ecology and General Biology: Fourth Edition, 1, 113-132. Doi: 10.1016/B978-0-12-385026-3.00007-3
Feest, A., & Stephenson, S. (2014). The response of myxogastrids to soil amendments, 5 (November), 821-829. Doi: 10.5943/mycosphere/5/6/12
Fiore-Donno, A. M., Nikolaev, S. I., Nelson, M., Pawlowski, J., Cavalier-Smith, T., & Baldauf, S. L. (2010). Deep Phylogeny and Evolution of Slime Moulds (Mycetozoa). Protist, 161(1), 55-70. Doi: 10.1016/j.protis.2009.05.002
Hastie, T., Tibshirani, R., & Friedman, J. (2009). The Elements of Statistical Learning: Data Mining, Inference, and Prediction. Elements, 1, 337-387. Doi: 10.1007/b94608
Henríquez, C., Bertsch, F., & Salas, R. (1995). Fertilidad de suelos: manual de laboratorio. San José: Asociación Costarricense de la Ciencia del Suelo.
Hoppe, T., & Schnittler, M. (2015). Characterization of myxomycetes in two different soils by TRFLP- analysis of partial 18S rRNA gene sequences, 6(April), 216-227. Doi: 10.5943/mycosphere/6/2/11
Jenkinson, D. S., & Powlson, D. S. (1976). The effects of biocidal treatments on metabolism in soil—V. Soil Biology and Biochemistry, 8(3), 209-213. Doi: 10.1016/0038-0717(76)90005-5
Kaleita, A. L., Schott, L. R., Hargreaves, S. K., & Hofmockel, K. S. (2017). Differences in soil biological activity by terrain types at the sub-field scale in central Iowa US. PLoS ONE, 12(7), 1-13. Doi: 10.1371/journal.pone.0180596
Keller, H. W., & Everhart, S. E. (2010). Importance of Myxomycetes in Biological Research and Teaching. Papers in Plant Pathology of the University of Nebraska-Lincoln, 3(1), 13-27. Recuperado de http://ever77.myweb.uga.edu/Publications/Everhart_2010_ImportanceofMyxomycetes.pdf
Kryvomaz, T., & Stephenson, S. (2017). Preliminary evalution of the possible impact of climate change on myxomycetes. Papers in Plant Pathology of the University of Nebraska-Lincoln, 104(1), 5-30. Doi: 10.1127/nova_hedwigia/2016/0379
Mueller, U. G., & Sachs, J. L. (2015). Engineering Microbiomes to Improve Plant and Animal Health. Trends in Microbiology, 23(10), 606-617. Doi: 10.1016/j.tim.2015.07.009
Pimentel, M. (2007). Manipulating Ecosystems for Agriculture. In Food, Energy, and Society, Third Edition (pp. 37-44). CRC Press. Doi: 10.1201/9781420046687.ch5
Rojas, C., & Kryvomaz, T. (2017). Myxomycetes in the 21st Century. In C. Rojas & S. Stephenson (Eds.), Myxomycetes: Biology, Systematics, Biogeography and Ecology. Academic Press.
Romeralo, M., Escalante, R., & Baldauf, S. L. (2012). Evolution and Diversity of Dictyostelid Social Amoebae. Protist, 163(3), 327-343. Doi: 10.1016/j.protis.2011.09.004
Spiegel, F., Haskins, E. F., Cavender, J. C., Landolt, J. C., Lindley-settlemyre, L. A., Edwards, S. M., … Shadwick, J. D. (2005). A beginner’s guide to isolating and culturing eumycetozoans. Retrieved from papers://560067a4-156f-4d6d-b6cc-2f64c208798b/Paper/p167
Stephenson, S. L., Fiore-Donno, A. M., & Schnittler, M. (2011). Myxomycetes in soil. Soil Biology and Biochemistry, 43(11), 2237-2242. Doi: 10.1016/j.soilbio.2011.07.007
Swanson, A. R., Vadell, E. M., & Cavender, J. C. (1999). Global distribution of forest soil dictyostelids. Journal of Biogeography, 26(1), 133-148. Doi: 10.1046/j.1365-2699.1999.00250.x
Tibshirani, R. (1996). Regression Shrinkage and Selection via the Lasso. Journal of the Royal Statistical Society B, 58(1), 267-288. Recuperado de https://statweb.stanford.edu/~tibs/lasso/lasso.pdf
Vance, E. D., Brookes, P. C., & Jenkiinson, D. S. (1987). An Extraction Method for Measuring Soil Microbial Biomass C. Soil Biology and Biochemistry, 19(6), 703-707. Doi: 10.1016/0038-0717(87)90052-6
Wang, X., Liu, L., Piao, S., Janssens, I. A., Tang, J., Liu, W., … Xu, S. (2014). Soil respiration under climate warming: differential response of heterotrophic and autotrophic respiration. Global Change Biology, 20(10), 3229-3237. Doi: 10.1111/gcb.12620
Whiting, D., Wilson, C., & Card, A. (2002). Estimating Soil Texture Sandy, Loamy, or Clayey? Colorado Master Gardener. Program Colorado Gardener Certificate Training CMG Fact Sheet #S14, (December 2003), 1-7.
Zhou, L., Zhou, X., Zhang, B., Lu, M., Luo, Y., Liu, L., & Li, B. (2014). Different responses of soil respiration and its components to nitrogen addition among biomes: a meta-analysis. Global Change Biology, 20(7), 2332-2343. Doi: 10.1111/gcb.12490
 |
 |
 |
 |
Los artículos publicados se distribuye bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC BY 4.0) basada en una obra en http://www.revistas.una.ac.cr/ambientales., lo que implica la posibilidad de que los lectores puedan de forma gratuita descargar, almacenar, copiar y distribuir la versión final aprobada y publicada del artículo, siempre y cuando se mencione la fuente y autoría de la obra. |
|