
Revista de Ciencias Ambientales (Trop J Environ Sci). (Julio-Diciembre, 2018). EISSN: 2215-3896. Vol 52(2): 111-122.
DOI: http://dx.doi.org/10.15359/rca.52-2.6
URL: www.revistas.una.ac.cr/ambientales
EMAIL: revista.ambientales@una.cr
Selección de hábitat del lobito de río (Lontra longicaudis) (Carnívora: Mustelidae) en la Reserva Natural Iberá, Argentina
Habitat Selection of Neotropical Otter (Lontra longicaudis) (Carnívora: Mustelidae) in the Iberá Natural Reserve, Argentina
Xochilt Pocasangre-Orellanaa y Romeo Manuel Spínola Paralladab
[Recibido: 21 de febrero 2018, Aceptado: 02 de abril 2018, Corregido: 27 de abril 2018, Publicado: 01 de julio 2018]
Resumen
Se evaluó la selección de hábitat del lobito de río (Lontra longicaudis) en la Reserva Natural Iberá, provincia de Corrientes, Argentina, desde julio a noviembre del 2014. Se muestrearon 99 segmentos de 300 m de longitud, establecidos en la laguna Iberá, en la laguna Paraná y en el arroyo Carambola. Cada segmento fue visitado para crear historias de detección/no detección de lobito de río. Se midieron atributos ambientales como tipo de ambiente, cobertura vegetal y la influencia de yacaré (Caiman latirostris y C. yacare). Estos atributos fueron utilizados para crear modelos de ocupación. El lobito de río eligió la laguna Iberá sobre los otros ambientes analizados. Ningún tipo de cobertura vegetal fue seleccionado sobre otro y la influencia de yacaré no pareció condicionar el uso del espacio del lobito de río en los sitios de muestreo.
Palabras clave: Conservación; ecología; humedal; modelos de ocupación; vida silvestre.
Abstract
Habitat selection of the neotropical otter (Lontra longicaudis) was evaluated in the Iberá Natural Reserve, province of Corrientes, Argentina, from July to November 2014. We sampled 99 segments of 300 m in length, which were located in the Iberá lagoon, the Paraná lagoon, and the Carambola stream. Each segment was visited to create detection / non-detection histories of the neotropical otter. Environmental attributes were measured, such as environment type, vegetation cover, and influence of alligator (Caiman latirostris and C. yacare). These attributes were used to create occupation models. The neotropical otter selected the Iberá lagoon over the other environments analyzed. No type of vegetation cover was selected over another, and the influence of alligator did not seem to condition the use of the space of neotropical otter in the sites sampled.
Keywords: Conservation; ecology; occupancy models; wetland; wildlife
1. Introducción
La nutria neotropical o lobito de río (L. longicaudis) es una especie de mustélido que se distribuye desde México hasta Argentina (Mayagoitia-González et al., 2013). Específicamente en Argentina se reporta para las provincias de Misiones, Corrientes, Chaco, Formosa, Salta, Jujuy, Tucumán, Santa Fe, Entre Ríos y el nordeste de Buenos Aires, además registros históricos en río Primero en Córdoba (Chebez, 1999). Su amplia distribución geográfica le permite ocupar diversos ambientes acuáticos como ríos, esteros, lagunas, arroyos, riachuelos (Chebez, 1999; Macías-Sánchez y Aranda, 1999). Adicionalmente, se ha reportado en ambiente de agua salada en la Laguna Conceição, frontera oriental de la isla Santa Catarina, en el sur de Brasil (Carvalho-Junior, Macedo-Soares y Birolo, 2010). Algunas investigaciones han asociado la presencia de esta especie con vegetación densa, condición que brinda protección en los sitios para refugio y reproducción (Carrillo-Rubio y Lafón, 2004; Mayagoitia-González et al., 2013), además puede facilitar el escape ante depredadores (Mayor-Victoria y Botero-Botero, 2010). Su dieta está constituida principalmente por peces y crustáceos, sin embargo, puede variar estacionalmente y según la disponibilidad de presas (Macías-Sánchez y Aranda, 1999; Spínola-Parrallada y Vaughan-Dickhaut, 1995). Actualmente, existen estudios que caracterizan algunos aspectos ecológicos de esta especie, principalmente su dieta y distribución (Macías-Sánchez y Aranda, 1999; Parera, 1993, 1996; Spínola-Parallada y Vaughan-Dickhaut, 1995), sin embargo, aún se desconocen muchos aspectos ecológicos, incluidos factores que influyen en la selección de su hábitat o en la ocupación de sitios determinados.
En el caso de la provincia de Corrientes en el norte de Argentina, se ha reportado la presencia de lobito de río en algunos cuerpos de agua del sistema de humedales de Iberá. Históricamente en esta región, el lobito de río, el yacaré overo (C. latirostris) y el yacaré negro (C. yacare) fueron especies amenazadas, principalmente por la cacería ilegal de su piel para la industria peletera (Canziani, Rossi, Loiselle y Ferrati, 2003). La presión de cacería intensiva del yacaré overo inició entre 1920/30 y cuando llegó a su casi exterminio se concentraron las capturas hacia yacaré negro (Chebez, 1999). Por otro lado, la comercialización de la piel de lobito de río se registra desde el decenio 1941/50, actividad que causó vulnerabilidad en sus poblaciones y, consecuentemente, provocó una extinción local en algunos sitios donde fue intensamente cazada (Chebez, 1999; Parera, 1993). Debido a esta presión sobre las especies y el ecosistema, se iniciaron procesos de conservación a partir de la década de 1980, donde se dieron declaratorias de algunas localidades para ser incluidas dentro de la Reserva Natural de Iberá (Ley Provincial N.o 3771/83). A partir de la prohibición de la cacería dentro de la Reserva, se registró un aumento de la población del lobito de río (Parera, 1993), del mismo modo aumentó la población de yacaré en los canales y arroyos de la Reserva y humedales aledaños (Micucci y Waller, 2005).
Los estudios sobre selección de hábitat son útiles para conocer los aspectos que intervienen en la supervivencia de las especies (Hall, Krausman y Morrison, 1997), sobre todo de aquellas que se encuentran en alguna categoría de riesgo o amenaza, como es el caso de lobito de río, ya que permitiría identificar sitios de ocupación dentro de un área específica. Desde esta línea de investigación, se han realizado esfuerzos por conocer los patrones de selección de hábitat de esta especie (Carrillo-Rubio y Lafón, 2004; Mayagoitia-González et al., 2013; Mayor-Victoria y Botero-Botero, 2010; Santiago Plata, 2013). Específicamente en el sistema de humedales y lagunas de Iberá se han llevado a cabo estudios en la laguna Iberá (Gori, Carpaneto y Ottino, 2003; Parera, 1993, 1996), en lagunas Galarza y Luna (Gil Carbó, 2003), estos han estimado densidades y algunas variables que afectan la detectabilidad de la especie de acuerdo con las características del hábitat; sin embargo, no se cuenta con estudios que utilicen los modelos de ocupación como herramienta para definir las variables que influyen en el uso del espacio en áreas específicas. Por tanto, la acumulación de conocimiento sobre los requerimientos de hábitat que necesita una población amenazada servirá para un mejor manejo de la vida silvestre en áreas de conservación.
Ciertas investigaciones han definido la selección de hábitat como un proceso que involucra una serie de comportamientos innatos y aprendidos que realiza un organismo a diferentes escalas del ambiente (Hutto, 1985). Por ejemplo, a escala biogeográfica ocurre una selección de acuerdo con mecanismos genéticos de una especie. Sin embargo, a escala fina predomina el comportamiento aprendido de los individuos o de un grupo social para seleccionar sitios específicos dentro de su rango de acción (Hall et al., 1997). Según lo anterior, en los estudios a escala fina, los individuos de una población toman decisiones sobre el uso del espacio tomando en cuenta la disponibilidad de recursos y riesgos de competencia o depredación. Por lo tanto, la comprensión de este proceso es importante para discernir si el hábitat está brindando las condiciones para la persistencia, tanto individual como colectiva, de una población (Krausman, 1999).
La evaluación de la selección de hábitat a escala fina a través de modelos de ocupación brindaría información que puede ser utilizada por los entes manejadores de vida silvestre para entender la dinámica de esta especie, con el fin de fomentar el uso adecuado de las áreas que están destinadas para su conservación dentro de la Reserva Natural Iberá. Por tanto, el objetivo de esta investigación fue conocer aspectos del uso del espacio del lobito de río y analizar la selección de su hábitat, de acuerdo con variables ambientales y el efecto de depredación o competencia del yacaré, en la zona central de la Reserva Natural Iberá.
2. Metodología
El sistema de humedales de Iberá está situado en la provincia de Corrientes, al noreste de Argentina, tiene una superficie de aproximadamente 12 000 km2. Este sistema constituye uno de los humedales más importantes de Argentina. Posee un clima subtropical húmedo sin estación seca, las precipitaciones son irregulares, desde 1 200 a 1 800 mm/año, con temperatura media anual entre los 27 °C de máxima y 14 °C de mínima (Achinelli, Perucca y Ligier, 2011). El humedal de Iberá se originó por el desplazamiento progresivo del curso del río Paraná, que se desconectó de la llanura de inundación del río. Esta modificación del antiguo curso fluvial del río Paraná contribuyó a la heterogeneidad del hábitat (Neiff, 1981).
En dicho sistema se forman grandes extensiones anegables que no ofrecen delimitación visual, denominados localmente “esteros” y representan el 75 % del total de la superficie (Casciotta, Almirón y Bechara, 2005; Neiff, 1981). Los esteros tienen un suelo orgánico (histosol) integrado principalmente por tejidos vegetales en distinto grado de desintegración. Este aporte de materia orgánica al suelo conlleva a la formación de islas flotantes o “embalsados”, que en etapas más evolucionadas sustentan vegetación sobre suelos turbosos de más de 3 m de espesor (Neiff, 1981). También, se forman planicies con cuerpos de agua semipermanentes conocidos como “bañados”, en los que predominan las plantas anfibias y palustres. Las lagunas constituyen menos del 5 % de la superficie de Iberá, generalmente no superan los 3 m de profundidad. Estas lagunas se encuentran rodeadas total o parcialmente por esteros. Dentro de los ambientes lóticos se destaca el río Corriente y el arroyo Carambola, los cuales presentan los mayores caudales y profundidades del sistema (Casciotta et al., 2005).
Los sitios de muestreo fueron: a) Laguna Iberá, se encuentra ubicada a 28°30’0’’ S y 57°10’0’’ W, posee una superficie de 52.1 km2 (Achinelli et al, 2011; Gori et al., 2003). Esta laguna se encuentra en la sección oriental, donde se presenta la mayor depresión del macrosistema de Iberá. Por su extensión, se considera una laguna grande de forma redondeada. En este tipo de lagunas la vegetación sumergida forma parches de extensión inferior al 5 % de su superficie (Neiff y Neiff, 2013). Se encuentra dividida en dos grandes sectores, el de mayor tamaño, ubicado al norte, rodeado casi completamente por embalsados, y el sector sur con playas arenosas y una extensión mucho menor de embalsados (Casciotta et al., 2005); b) Laguna Paraná, se encuentra situada en las coordenadas 28°18'0'' S y 57°25'60'' W, posee una extensión aproximada de 22 km2. Esta laguna se encuentra en el límite occidental del humedal Iberá, que es mucho más suave y difuso con presencia de extensos bañados. Este tipo de laguna tiene forma elongada, ocupa antiguas vías de escurrimiento que le permiten mayor tasa de renovación de agua y la vegetación sumergida puede ocupar 60 % o más del espejo de agua (Neiff y Neiff, 2013); c) Arroyo Carambola, se encuentra situado en las coordenadas 28°10'0'' S y 57°25'60'' W. Su cuenca posee una superficie de 4 936.72 km2 (Serra, 2004). Es uno de los ambientes lóticos más destacados del área (Casciotta et al., 2005).
La selección de hábitat del lobito de río se llevó a cabo de julio a noviembre de 2014 en los tres cuerpos de agua dentro de la Reserva Natural Iberá. Se establecieron segmentos de 300 m de longitud separados por 700 m entre sí, sobre la línea de costa recorriendo el perímetro de cada laguna y del arroyo, con ayuda de un GPS. En la laguna Iberá se ubicaron 54 segmentos, en la laguna Paraná 25 segmentos y en el arroyo Carambola 20 segmentos. Se consideraron segmentos de longitud corta con el fin de obtener más réplicas espaciales y aumentar el número de sitios de muestreo por área de estudio (Jeffress, Paukert, Sandercock y Gipson, 2011). Los recorridos se realizaron en lancha, a una velocidad entre 6 a 8 km/h, separados de la costa a una distancia de 5-10 m. Cada cuerpo de agua se visitó en 5 ocasiones, se observó permanentemente a ojo desnudo o utilizando binoculares para detectar la presencia de los individuos de lobito de río y realizar las anotaciones de presencia (detección) o ausencia (no detección) en cada segmento muestreado.
Dos de los atributos medidos en la costa de cada cuerpo de agua fueron: tipo de ambiente y cobertura vegetal. Estas variables se muestrearon únicamente en la primera ocasión, con el fin de caracterizar cada segmento. Según características de cada cuerpo de agua, los ambientes se clasificaron como: a) Laguna Iberá (ambiente léntico de laguna redondeada), b) Laguna Paraná (ambiente léntico de laguna elongada), y c) arroyo Carambola (ambiente lótico). La variable cobertura vegetal se midió en cada uno de los segmentos de 300 m, se marcaron puntos cada 25 m, con ayuda del GPS, se totalizaron 12 puntos por segmento. A cada punto se le otorgó un tipo de vegetación, según la clasificación para costas de cuerpos de agua de humedal (Jiménez, 2005). Se determinaron las siguientes categorías: a) acuática sumergida, b) acuática flotante, c) palustre, d) terrestre y e) monte. Con el fin de que cada segmento tuviera un solo tipo de vegetación, se eligió la categoría que se observó con mayor frecuencia. Otro de los atributos considerados en este estudio fue la influencia de yacaré, para tal efecto se hicieron anotaciones de la presencia (1) o ausencia (0) de esta especie en cada segmento muestreado, de manera simultánea a los recorridos realizados para la detección de lobito de río. Debido a las dificultades para la identificación de las especies de yacaré en algunos sitios donde se encontraban sumergidos en el agua, no se hizo diferenciación entre las dos especies y para efectos del análisis se consideró solamente como la variable influencia de yacaré.
Para el análisis de la selección de hábitat se realizaron modelos de ocupación con el programa R. Estos modelos predicen mejores estimaciones sobre la probabilidad de ocupación de una especie en sitios específicos, ya que incorporan la probabilidad de detección (Jeffress et al., 2011; Santiago Plata, 2013). Para la selección de modelos se utilizó el criterio de información de Akaike (CIA), donde los valores menores indican el modelo más verosímil.
3. Resultados
Se registraron 35 avistamientos de lobito de río en 26 segmentos de la Laguna Iberá, correspondiente al 48.1 % de los segmentos muestreados. En la laguna Paraná fueron 6 avistamientos en 4 segmentos, correspondiente al 16 % de las unidades de muestreo. En el arroyo fueron 4 avistamientos en 4 segmentos de este tipo de ambiente, correspondiente al 20 % de los segmentos muestreados. La mayoría de encuentros fueron de individuos solitarios, solamente en la laguna Paraná se detectaron parejas de lobito de río.
A partir de los resultados se generaron 12 modelos, incluido el modelo nulo donde la probabilidad de selección (psi) y la probabilidad de detección (p) fueron constantes (psi (.), p (.)). El resto de modelos incluyeron las variables de hábitat (tipo de ambiente, cobertura vegetal e influencia de yacaré). De acuerdo con el criterio de información de Akaike (CIA) el mejor modelo explicó que el lobito de río no seleccionó las unidades de muestreo según las variables consideradas, pero si mostró que la probabilidad de detección fue levemente mayor en la laguna Iberá con respecto a los otros dos tipos de ambiente (Cuadro 1, Figura 1). En cambio, el segundo mejor modelo que se ubicó a 2.75 unidades de CIA mostró que el lobito de río seleccionó a la laguna Iberá sobre los otros dos tipos de ambiente (Cuadro 1, Figura 2). El modelo que incluyó la variable cobertura vegetal se encontró a 5.88 unidades de valor de CIA por debajo del mejor modelo, lo que demuestra que no hubo selección de un tipo de cobertura sobre otro. El modelo que incluyó la variable influencia de yacaré se ubicó a 4.63 unidades de valor de CIA por debajo del mejor modelo. Por tanto, estas dos variables no jugaron un rol tan significativo en la presencia de lobito de río comparado con la variable de tipo de ambiente (Cuadro 1).
Cuadro 1. Modelos de ocupación para examinar la selección de hábitat de lobito de río (Lontra longicaudis) en la Reserva Natural Iberá, Provincia de Corrientes, Argentina, julio-noviembre, 2014
|
Modelo |
CIA |
ΔCIA |
Peso CIA |
k |
|
psi(.),p(amb) |
269.49 |
0.00 |
0.61068 |
4 |
|
psi(amb),p(.) |
272.24 |
2.75 |
0.15467 |
4 |
|
psi(amb),p(amb) |
273.49 |
4.00 |
0.08274 |
6 |
|
psi(yac+amb), p(.) |
274.12 |
4.63 |
0.06022 |
5 |
|
psi(cob+amb),p(.) |
275.37 |
5.88 |
0.03233 |
8 |
|
psi(cob),p(amb) |
276.34 |
6.85 |
0.01985 |
8 |
|
psi(.),p(.) |
277.04 |
7.55 |
0.01398 |
2 |
|
psi(yac+cob+amb) |
277.28 |
7.79 |
0.01241 |
9 |
|
psi(yac),p(.) |
277.52 |
8.03 |
0.01104 |
3 |
|
psi(yac+cob),p(.) |
282.61 |
13.12 |
0.00086 |
7 |
|
psi(.),p(cob) |
282.97 |
13.48 |
0.00072 |
6 |
|
psi(cob),p(.) |
283.68 |
14.19 |
0.00051 |
6 |
CIA: Criterio de Información de Akaike; ΔCIA: diferencia en el CIA, k: número de parámetros, psi: tasa de ocupación (probabilidad de selección), p: probabilidad de detección, amb: ambiente, cob: cobertura vegetal, yac: yacaré.
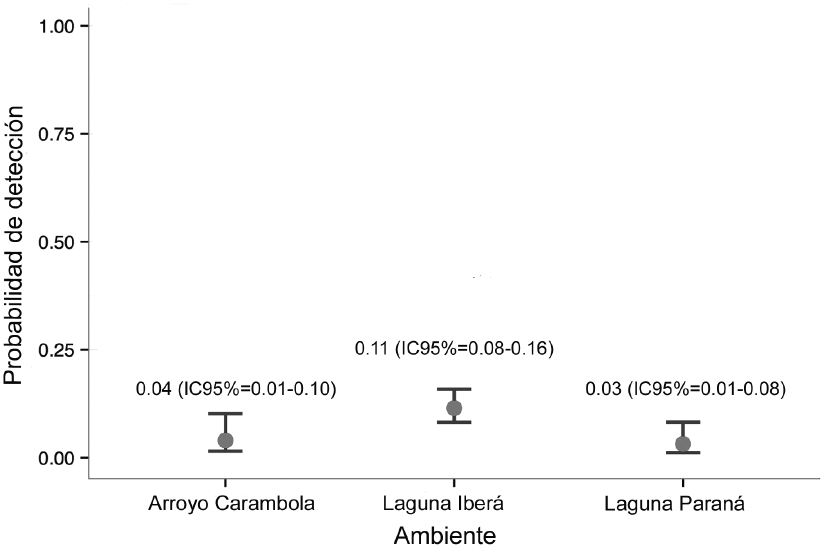
Figura 1. Probabilidad de detección de lobito de río (Lontra longicaudis) en los ambientes de arroyo Carambola, laguna Iberá y laguna Paraná, Reserva Natural Iberá, Provincia de Corrientes, Argentina, julio-noviembre, 2014.
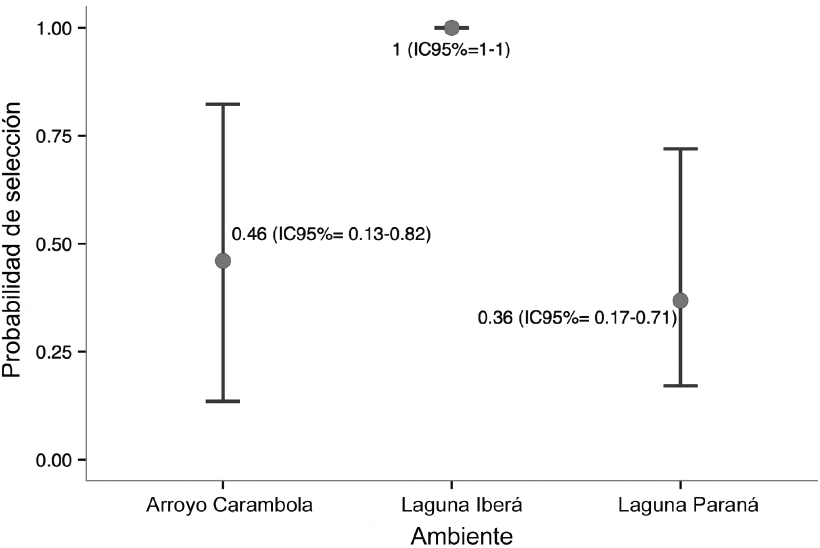
Figura 2. Probabilidad de selección de lobito de río (Lontra longicaudis) en los ambientes de arroyo Carambola, laguna Iberá y laguna Paraná, Reserva Natural Iberá, Provincia de Corrientes, Argentina, julio-noviembre, 2014.
4. Discusión
La detección de lobito de río se hizo difícil debido a su comportamiento elusivo; sin embargo, al comparar cada sitio de muestreo, se tuvo mayor número de avistamientos en la laguna Iberá comparado con los encuentros en la laguna Paraná y arroyo Carambola. En contraste, Gil Carbó (2003) reportó baja detectabilidad de L. longicaudis para las lagunas Galarza y Luna, ambas pertenecientes al macrosistema Iberá y categorizadas como lagunas grandes y de forma redondeada, similar a la laguna Iberá (Neiff, 1981). Por tanto, es posible que la laguna Iberá sea un ambiente que provea cierto tipo de condiciones que favorecen la presencia de la especie. Como lo menciona Parera (1993, 1996), cuando reporta altas densidades de lobito de río en esta laguna, posiblemente por mayores esfuerzos de conservación en esta área para la prohibición de la caza de lobito de río a principios de los años ochenta, comparado con los campos que rodean la laguna Paraná y arroyo Carambola, los cuales se encuentran en tierras privadas que anteriormente se utilizaban para actividades productivas, pero que actualmente están destinadas para conservación y forman parte de la Reserva Natural Iberá.
La probabilidad de selección del lobito de río por la laguna Iberá sobre los otros cuerpos de agua considerados en este estudio, posiblemente, se debe a que este tipo de ambiente podría favorecer la disponibilidad de alimento. Como lo mencionan algunos estudios, L. longicaudis varía su dieta de acuerdo con la disponibilidad de sus presas y su presencia responde a la abundancia de alimento en un sitio (Carrillo-Rubio y Lafón, 2004; Macías-Sánchez y Aranda, 1999; Pardini, 1998). Según Casciotta et al. (2005), en la laguna Iberá se reportó una mayor riqueza de fauna íctica con 87 especies de peces en comparación a 66 especies para el arroyo Carambola-laguna Paraná. En cuanto a productividad de peces se refiere, la laguna Iberá presenta 194 kg/ha (Canziani et al., 2003); sin embargo, no se poseen datos precisos para comparar con la productividad de la laguna Paraná y el arroyo Carambola (J. Casciotta, comunicación personal). Además, la cobertura de los esteros, bañados y malezales (i.e. pastizales anegados) circundantes a los cuerpos de agua visitados, podrían estar brindando refugios importantes para la fauna íctica (Casciotta et al., 2005) y disponibilidad de presas con menor capacidad de escape (Pardini, 1998).
Los peces representan una de las categorías más importantes en la dieta de lobito de río, seguido de los crustáceos y moluscos; mientras que los anfibios, reptiles, aves y mamíferos son consumidos en menor cantidad (Gori et al., 2003; Pardini, 1998; Parera, 1993; Spínola-Parallada y Vaughan-Dickhaut, 1995). Por tanto, es probable que los peces sean el grupo taxonómico que ofrezca mayor aporte nutritivo a su dieta, ya que se ha reportado que estos mustélidos deben consumir entre 0.8 y 1.8 kg de peces por día, para compensar el déficit de energía que pierden en la búsqueda de su alimento (Kruuk, 2006). La dependencia de estos mustélidos con la disponibilidad de alimento fue demostrada en ambientes marinos de las islas de Shetland y en ríos del norte de Escocia, ya que este factor regula directamente aspectos como natalidad, mortalidad, condición corporal de los individuos y su abundancia (Kruuk, Carss, Conroy y Gaywood, 1998).
Los tipos de cobertura vegetal propuestos en este estudio no parecieron influir en la selección de hábitat de lobito río, ya que no hubo preferencias de una vegetación sobre la otra. Similar a lo reportado por Durbin (1998), en un estudio con radiotelemetría de la especie Lutra lutra, donde demostró que no tuvo preferencias por alguna vegetación en particular. Sin embargo, se ha reportado a L. longicaudis en lagunas con porcentaje alto de cobertura herbácea, un requerimiento considerado importante para sus madrigueras (Mayagoitia-González et al., 2013). Por tanto, se considera que las costas de los cuerpos de agua de la Reserva Natural Iberá, las cuales presentan pastos, hierbas, plantas leñosas y pequeños árboles, son sitios que pueden ofrecer refugios igualmente favorables para el lobito de río (Gori et al., 2003; Parera, 1993).
Algunas investigaciones han sugerido la asociación entre L. longicaudis con vegetación leñosa y herbácea en los bancos a la orilla de los ríos, basadas en observaciones de excretas (Mayagoitia-González et al., 2013; Mayor-Victoria y Botero-Botero, 2010). Este tipo de cobertura vegetal fue reportada para la laguna Iberá por Gori et al. (2003), quienes demuestran que existe mayor cantidad de rastros (huellas y excretas) en sitios donde había árboles y arbustos, lo cual indica que podrían existir refugios para la protección de la especie, y menor cantidad de indicios en los pastos densos en relación con la ausencia de refugios. Sin embargo, esta condición podría estar favorecida para los sitios donde se facilita encontrar rastros. En cambio, en el presente estudio se tuvieron algunos avistamientos de lobito de río en sitios de pastos densos en el terraplén de una antigua arrocera (acceso para el arroyo Carambola), y en los malezales del camino hacia la Colonia Carlos Pellegrini, poblado cercano a la laguna Iberá. Esto posiblemente se deba a que estos sitios podrían ser utilizados como refugios o corredores de paso que comuniquen las zonas de alimentación con sus madrigueras.
Se considera que la influencia de yacaré no está restringiendo el uso del espacio de lobito de río en los sitios analizados, posiblemente porque las especies de yacaré se distribuyen de manera diferente dentro del humedal. Por ejemplo, se ha reportado a C. latirostris en sitios de poca profundidad y fuertemente vegetados en comparación de C. yacare que se encuentra en sitios de aguas profundas (Bolkovic y Ramadori, 2006). Sin embargo, con la información recolectada no queda claro el rol de esta variable con la selección de hábitat del mustélido. En comparación con un estudio realizado por Hussain (2013), a través de radiotelemetría, se encontró que la especie de nutria lisa (Lutrogale perspicillata) superpone el hábitat y la dieta con las especies de cocodrilos (Crocodylus palustris y Gavialis gangeticus). Para el caso de L. longicaudis se desconocen estudios publicados con el uso de radiotelemetría, situación que dificulta la comprensión de las relaciones interespecíficas con sus posibles depredadores como caimanes y otros grandes carnívoros (Kruuk, 2006); o caso contrario, depredación de crías de yacaré que quedan expuestos a potenciales carnívoros como el lobito de río (Bolkovic y Ramadori, 2006).
Se ha reportado que el lobito de río consume peces de las familias Cichlidae, Synbranchidae, Loricariidae y Erythrinidae, los cuales se caracterizan por ser de talla media y de lento movimiento (Gori et al., 2003; Parera, 1993). Por otro lado, Santos et al (1996) reportaron que los peces representan una categoría importante en la dieta de C. crocodilus yacare, principalmente de las familias Loricariidae y Erythrinidae. Por lo tanto, es posible que el lobito de río y las dos especies de yacaré compartan este tipo de recurso alimenticio sin interferir en el uso de los espacios que ocupan, ya que podría ocurrir que el movimiento de los animales sea producto de procesos aleatorios y donde las restricciones de alimentación por competencia solamente podrían influir en condiciones extremas (Hutto, 1985).
5. Conclusión
El lobito de río seleccionó la laguna Iberá sobre los otros dos ambientes analizados, por lo tanto, se considera que esta área muestra condiciones que propician el establecimiento de la población de esta especie, y su historia de conservación prolongada provee recursos necesarios para la supervivencia del lobito de río. Además, el uso del espacio de lobito de río varía entre ambientes y podría estar influenciada por la disponibilidad de recursos alimenticios. Por otro lado, no queda clara la interacción de competencia o depredación por parte del yacaré. Por lo tanto, es recomendable realizar estudios de radiotelemetría de la nutria neotropical, con el fin de profundizar en las variables a escala fina que influyen en la persistencia tanto individual como colectiva de su población. A partir de la comprensión de los aspectos ecológicos de las especies que interactúan en un área natural, se podrán establecer estrategias de manejo y conservación, las cuales incluyan políticas para priorizar y proteger hábitats que promuevan el restablecimiento de especies amenazadas.
6. Agradecimientos
Agradecemos al Servicio Alemán de Intercambio Académico (DAAD), por el apoyo financiero para llevar a cabo este estudio. A la organización Conservation Land Trust, por el apoyo logístico en campo. A la organización Idea Wild, por la donación del equipo para el trabajo de campo. A la Dirección de Parques y Reservas de Corrientes y a sus guardaparques por su acompañamiento en los recorridos en campo. A Francisco Samuel Álvarez Calderón, por su acompañamiento y apoyo en este proceso. Finalmente, agradecemos a la Revista y a las personas revisoras anónimas por sus oportunas sugerencias.
7. Referencias
Achinelli, M. L., Perucca, R. A. & Ligier, H. D. (2011). Evaluación multicriterio para la zonificación del servicio ecosistémico en el macrosistema Iberá: Amortiguación hídrica. Valoración de servicios ecosistémicos. Conceptos, herramientas y aplicaciones para el ordenamiento territorial. INTA. Buenos Aires, 485-509.
Bolkovic, M. L. & Ramadori, D. (2006). Manejo de fauna silvestre en la Argentina. Programas de uso sustentable, 15(3), 150-161.
Canziani, G., Rossi, C., Loiselle, S., & Ferrati, R. (2003). Los esteros del Iberá, informe del proyecto “El manejo sustentable de humedales en el Mercosur”. Fundación Vida Silvestre Argentina, Buenos Aires, Argentina.
Carrillo-Rubio, E., & Lafón, A. (2004). Neotropical river otter micro-habitat preference in West-Central Chihuahua, Mexico. IUCN Otter Specialist Group Bulletin, 21(1), 10-15.
Carvalho-Junior, O., Macedo-Soares, L. C. P., & Birolo, A. B. (2010). Variabilidad de los hábitos alimentarios anuales e interanuales de una nutria neotropical (Lontra longicaudis) población en la laguna Conceição, sur de Brasil. UICN Otter Specialist Group Bulletin, 27(1), 1-57.
Casciotta, J. R., Almirón, A., & Bechara, J. A. (2005). Peces del Iberá: Hábitat y diversidad. La Plata, Argentina: Grafikar.
Chebez, J. C. (1999). Los que se van: Especies argentinas en peligro. Buenos Aires, Argentina: Albatros SACI.
Durbin, L. S. (1998). Habitat selection by five otters Lutra lutra in rivers of northern Scotland. Journal of zoology, 245(1), 85-92. doi: 10.1111/ j.1469-7998.1998.tb00075.x
Gil Carbó, G. (2003). Densidades de lobito de río (Lontra longicaudis) en las lagunas Galarza y Luna. En B. B. Álvarez (Ed.), Fauna del Iberá. Mastofauna (pp. 343-347). Corrientes, Argentina: EUDENE.
Gori, M., Carpaneto, G. M., & Ottino, P. (2003). Spatial distribution and diet of the Neotropical otter Lontra longicaudis in the Ibera Lake (northern Argentina). Acta Theriologica, 48(4), 495-504. doi: 10.1007/BF03192495
Hall, L. S., Krausman, P. R. & Morrison, M. L. (1997). The Habitat concept and a Plea for Standard Terminology. Wildlife Society Bulletin, 25(1), 173-182.
Hussain, S. A. (2013). Activity pattern, behavioural activity and interspecific interaction of smooth-coated otter (Lutrogale perspicillata) in National Chambal Sanctuary, India. IUCN Otter Specialist Group Bulletin, 30(1), 5-17.
Hutto, R. L. (1985). Habitat Selection by Nonbreeding, Migratory Land Birds. En M. L. Cody (Ed.), Habitat Selection in birds (pp. 455-476). Orlando, EE.UU.: Academic Press.
Jeffress, M. R., Paukert, C. P., Sandercock, B. K., & Gipson, P. S. (2011). Factors affecting detectability of river otters during sign surveys. Journal of Wildlife Management, 75(1), 144-150. doi: 10.1002/jwmg.12
Jiménez, I. (2005). Development of predictive models to explain the distribution of the West Indian manatee Trichechus manatus in tropical watercourses. Biological Conservation, 125, 491-503. doi: 10.1016/j.biocom.2005.04.012
Krausman, P. R. (1999). Some basic principles of habitat use. Grazing behavior of livestock and wildlife, 70, 85-90.
Kruuk, H. (2006). Otters: ecology, behaviour and conservation. Oxford, England: Oxford University Press. doi: 10.1093/acprof:oso/9780198565871.001.0001
Kruuk, H., Carss, D. N., Conroy, J. W. H. & Gaywood, M. J. (1998). Uso del hábitat y conservación de nutrias (Lutra lutra) en Gran Bretaña: Una revisión. En N. Dunstone y M. Gorman (Eds.), Comportamiento y ecología de los mamíferos ribereños (Simposios de la Sociedad Zoológica de Londres, págs. 119-134). Cambridge: Cambridge University Press. doi: 10.1017/CB09780511721830.009
Macías-Sánchez, S., & Aranda, M. (1999). Análisis de la alimentación de la nutria Lontra longicaudis (Mammalia: Carnívora) en un sector del río Los Pescados, Veracruz, México. Acta Zoológica Mexicana, 76, 49-57.
Mayagoitia-González, P. E., Fierro-Cabo, A., Valdez, R., Andersen, M., Cowley, D. & Steiner, R. (2013). Uso de hábitat y perspectivas de Lontra longicaudis en un área protegida de Tamaulipas, México. Therya, 4(2), 243-256. doi: 10.12933/therya-13-130.
Mayor-Victoria, R., & Botero-Botero, A. (2010). Uso del hábitat por la nutria neotropical Lontra longicaudis (Carnívora: Mustelidae) en la zona baja del río Roble, Alto Cauca,Colombia. Boletín Científico. Centro de Museos. Museo de Historia Natural, 14(1), 121-130.
Micucci, P. A., & Waller, T. (2005). Tendencias en las poblaciones de caimanes (Caiman yacare y C. latirostris) en la provincia de Corrientes, Argentina. Evaluación y manejo. Reunión Regional de América Latina y el Caribe del Grupo de Especialistas en Cocodrilos, 29.
Neiff, J. J. (1981). Panorama ecológico de los cuerpos de agua del nordeste argentino. Symposia, VI Jornadas Argentinas de Zoología, Argentina.
Neiff, J. J. & Neiff, M. (2013). Evaluación de los impactos del cambio climático sobre el ecosistema natural y la biodiversidad. Medio Ambiente y Desarrollo, 152, 1-58.
Pardini, R. (1998). Feeding ecology of the neotropical river otter Lontra longicaudis in an Atlantic Forest stream, south‐eastern Brazil. Journal of Zoology, 245(4), 385-391. doi: 10.1111/ j.1469-7998.1998.tb00113.x
Parera, A. (1993). The neotropical river otter Lutra longicaudis in Iberá lagoon, Argentina. IUCN Otter Specialist Group Bulletin, 8, 13-16.
Parera, A. (1996). Estimación de la población de nutria de río Lutra longicaudis en la laguna Iberá utilizando la metodología Direct Sightings. UICN Otter Specialist Group Bulletin, 13(2), 77-83
Santiago Plata, V. M. (2013). Ocupación y distribución potencial de la nutria neotropical (Lontra longicaudis) asociada a variables ambientales en la cuenca del río San Juan, Costa Rica (Tesis de maestría). Centro Agronómico Tropical de Investigación y Enseñanza, Turrialba, Costa Rica.
Santos, S. A., Nogueira, M. S., Pinheirq, M. S., Campos, Z., Magnusson, W. E., & Mourao, G. M. (1996). Diets of Caiman crocodilus yacare from different habitats in the Brazilian Pantanal. Herpetological Journal, 6, 111-117.
Serra, P. (2004). Informe del proyecto Manejo y conservación de la biodiversidad de los esteros del Iberá. Plan General de Manejo de la Reserva Iberá. Programa del Fondo para Medio Ambiente Global del Programa de las Naciones Unidas para el Desarrollo, Fundación ECOS. Argentina. Recuperado de http://www.ecopuerto.com/bicentenario/informes/ManejoyConservEsterosIbera
Spínola-Parrallada, M., & Vaughan-Dickhaut, C. (1995). Dieta de la nutria neotropical (Lutra longicaudis) en la Estación Biológica La Selva, Costa Rica. Vida Silvestre Neotropical, 4(2), 125-132.
a Bióloga especialista en conservación y manejo de vida silvestre, investigadora en la Fundación Naturaleza, El Salvador; xochpoca@gmail.com
b Doctor en ecología de vida silvestre, profesor del Instituto Internacional en Conservación y Manejo de Vida Silvestre, Universidad Nacional (UNA), Costa Rica; mspinola10@gmail.com
 |
 |
 |
 |
Los artículos publicados se distribuye bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC BY 4.0) basada en una obra en http://www.revistas.una.ac.cr/ambientales., lo que implica la posibilidad de que los lectores puedan de forma gratuita descargar, almacenar, copiar y distribuir la versión final aprobada y publicada del artículo, siempre y cuando se mencione la fuente y autoría de la obra. |
|