
Revista de Ciencias Ambientales (Trop J Environ Sci). (Julio-Diciembre, 2018). EISSN: 2215-3896. Vol 52(2): 184-207.
DOI: http://dx.doi.org/10.15359/rca.52-2.11
URL: www.revistas.una.ac.cr/ambientales
EMAIL: revista.ambientales@una.cr
Estructura de las comunidades de aves de cuatro áreas verdes de la ciudad de Asunción, Paraguay
Structure of Bird Communities of Four Green Areas of the City of Asunción, Paraguay
Alan Martin-Etchegaraya, Alberto Esquivel M.b , Andrea Weiler G.c
Recibido: 6 de febrero, 2018. Aceptado: 7 de mayo, 2018. Corregido: 21 de mayo, 2018. Publicado: 1 de julio, 2018.
Resumen
Muchos estudios han demostrado un impacto negativo de la urbanización en la biodiversidad, produciendo una homogenización de las comunidades, incluso extirpando especies nativas y expandiendo otras más adaptadas a la urbanización, entre ellas algunas exóticas. Asunción se encuentra en un alto crecimiento urbanístico, por lo que resulta importante conocer el estado de las comunidades de aves que albergan sus áreas verdes. La presente investigación ha evaluado la riqueza, diversidad y estructura de la comunidad de aves que ocurren en áreas verdes urbanas de la ciudad. Hemos muestreado la avifauna de 4 áreas verdes (5.8-282 hectáreas), a fin de comparar la estructura de estas comunidades y testear la hipótesis de tamaño de islas en el entorno urbano. Ubicamos 4 estaciones de conteo en zonas de arboledas y bordes de bosque en cada área. Cada estación fue visitada 6 veces durante el estudio, realizándose puntos de conteo de 10 min, con un radio de 30 m, en el cual se registraron las aves oídas u observadas. Un total de 95 especies fue registrado en las áreas verdes durante el estudio, incluyendo 2 introducidas (Columba livia y Passer domesticus). Las curvas de acumulación de especies demostraron que los esfuerzos de muestreos fueron apropiados para las áreas, con excepción de la de mayor tamaño. Las áreas de mayor tamaño presentaron más riqueza de especies (rango = 30-61 especies), crecientes índices de diversidad (rango = 2.62-3.48) y un número incrementado de especies con abundancia relativa baja. Los fragmentos más pequeños presentaron mayor dominancia de especies generalistas. La riqueza y diversidad tuvieron una correlación positiva significativa con el tamaño de las áreas. La abundancia obtuvo una correlación negativa con el área del parque, aunque no significativa. Los resultados demuestran que el mantenimiento de áreas verdes urbanas grandes permitirá albergar una mayor riqueza de aves, con una diversidad de especies con abundancia relativamente baja y con baja dominancia de especies generalistas.
Palabras clave: Asunción, avifauna, ecología urbana, espacios verdes, urbanización.
Abstract
Many studies have shown a negative impact of urbanization on biodiversity, producing a homogenization of the communities, even extirpating native species and expanding species more adapted to urbanization, including some exotic ones. Asunción has high rates of urban growth, so it is important to know the status of bird communities that house their green areas. The present study has evaluated the richness, diversity, and structure of the bird community that occurs in urban green areas of the city. We have sampled the avifauna of four green areas (5.8-282 hectares) to compare the structure of these communities and to test the hypothesis of island size in the urban environment. We located four counting stations in areas of groves and forest edges in each area. Each station was visited six times during the study, with 10-minute counting points, with a radius of 30 m, in which the birds heard or observed were recorded. A total of 95 species were recorded in the green areas during the study, including two introduced species (Columba livia and Passer domesticus). The species accumulation curves showed that the sampling efforts were appropriate for the areas, except for the larger one. The larger areas had greater species richness (range = 30-61 species), higher diversity index (range = 2.62-3.48), and a greater number of species with low relative abundance. The smaller fragments presented greater dominance of generalist species. The richness and diversity had a significant positive correlation with the size of the areas. The abundance obtained a negative correlation with the area of the park, although not significant. The results show that the maintenance of large urban green areas will allow a greater wealth of birds, with a diversity of species with relatively low abundance, and with a low dominance of generalist species.
Keywords: Asunción; bird assemblage; green spaces; urbanization; urban ecology.
1. Introducción
El desarrollo de la urbanización está ocurriendo drásticamente, llega incluso a pasar de 10 % a más de 50 % de la población en países desarrollados, en el último siglo (Grimm et al., 2008). Los cambios que sufren las condiciones ambientales en las zonas urbanas afectan a la biodiversidad local al reducir generalmente tanto la riqueza de especies como la equitatividad en la mayoría de las comunidades bióticas (Grimm et al., 2008). En muchas situaciones, la vegetación existente en las ciudades no tiene ninguna relación con la nativa debido a que las plantas nativas suelen ser reemplazadas por ornamentales exóticas (Alberti et al., 2003; Savard et al., 2000). La pérdida de hábitat es la amenaza más inmediata en ambientes urbanizados para las aves nativas. Sin embargo, resulta difícil evaluar el efecto directo de este factor en la composición de la avifauna, ya que otros, como la fragmentación o la degradación del hábitat, la alteración del flujo de los recursos (disponibilidad de alimentos, sitios para anidar), la polución (iluminación, ruidos, químicos), y las interacciones entre especies (competencia, predación, incluso parasitismo de cría, y enfermedades vectoriales) pueden afectar la estructura de la comunidad (Shanahan et al., 2014). Incluso se ha demostrado que la productividad primaria puede ser un factor influyente en la riqueza y la abundancia de especies en las comunidades de aves en ambientes urbanos (Haedo et al., 2017).
Las comunidades de aves constituyen uno de los grupos que presentan mayor sensibilidad a las modificaciones del medio, especialmente a la fragmentación de la vegetación y a la elevada densidad de la población humana (Stagoll et al., 2010). Sin embargo, varios estudios que han investigado el cambio de riqueza de especies de aves desde áreas totalmente rurales a gradientes urbanos, han encontrado una mayor riqueza en niveles intermedios de urbanización (Blair, 1996; Leveau & Leveau, 2005; Tratalos, 2007; Shanahan et al., 2014). Como se ha indicado, diversos factores ambientales como la disponibilidad de hábitat, la presencia de competidores y enemigos naturales, pueden determinar una respuesta diferenciada de las especies de aves a la urbanización. Algunas de ellas llegan a tener sus más altas densidades en áreas altamente urbanizadas, al ser estas referidas como “explotadoras” urbanas, “dependientes” urbanas o “pobladoras” urbanas, i.e. la Paloma Turca (Columba livia) y el Gorrión (Passer domesticus); un segundo grupo de especies que pueden prosperar en áreas urbanas, pero a menudo dependen de poblaciones no urbanas, son conocidas como “usuarios” o “tolerantes” urbanos, que incluye omnívoras y granívoras, de hábitos de forrajeo terrestre, o que anidan en árboles o arbustos; un tercer grupo, con sus números más elevados en áreas no urbanas y solo presentes en ambientes urbanizados de baja intensidad, han sido llamados “evitadores” urbanos, especies que incluyen una dieta insectívora, hábitos de anidación en suelo y solitarios, y comportamiento migratorio (Leveau y Zuria, 2017).
Aunque muchas especies de aves se distribuyen y adaptan a lo largo de hábitats urbanos, se ha demostrado que en altos niveles de urbanización, la riqueza avifáunica disminuye (Blair, 1996; Filippi et al., 2008; Ramírez, 2010; Faggi & Perepelizin, 2006), al ser el tamaño de las ciudades uno de los factores más influyentes en las comunidades de aves (Chace & Walsh, 2006; MacGregor-Fors et al., 2011). Se ha observado que la composición de las comunidades de aves son más similares a las de las zonas rurales en ciudades de tamaños intermedios, y que la abundancia de especies nativas va disminuyendo con el aumento en el tamaño de la urbanización, aunque la abundancia total sigue aumentando (Garaffa et al., 2009). Esto último se debe principalmente a una mayor abundancia de especies que tienden a ser favorecidas como exóticas invasoras, especies con características biológicas oportunistas, omnívoras, sociables y sedentarias, y las que nidifican en cavidades, construcciones humanas, plantas ornamentales y demás elementos comunes en las zonas urbanas (Croci et al., 2008; Faggi & Perepelizin, 2009; Kark et al., 2007; Leaveau, 2013). Aunque en la mayoría de los estudios, las especies insectívoras suelen encontrarse menos favorecidas por la urbanización, Evans et al. (2011) no encontraron evidencias que estas tengan menor densidad en áreas urbanas que en rurales.
Deaborn & Kark (2010) cuestionan duramente a quienes sostienen que la conservación de especies debe centrarse exclusivamente en paisajes más naturales y silvestres, y argumentan que las áreas urbanas ofrecen un espacio importante para la biología de la conservación, pero que se debe mejorar la selección y la articulación de las metas. Entre los sitios ideales para concentrar las tareas de conservación en ecosistemas urbanos, se encuentran las áreas verdes urbanas, definidas generalmente, como espacios arborizados y cubiertos de vegetación que proveen servicios relacionados con el esparcimiento, la protección ecológica y la educación ambiental de los ciudadanos. Debido a las elevadas tasas de urbanización, las áreas verdes adquieren cada vez mayor valor como espacios de interacción entre las personas y la naturaleza (Maas et al., 2009).
Varios autores han demostrado que la variable cobertura vegetal es el principal factor determinante en la composición y la estructura de avifauna. En el caso de áreas verdes, la diversidad y la cobertura de la vegetación suelen estar positivamente correlacionadas con la riqueza y la diversidad de aves, por tanto, áreas amplias con una mayor variedad de tipo de vegetación arbórea y arbustiva, exhiben mayor riqueza de especies (Friesen et al., 1995; Estades, 1995; Nolazco, 2012). Los parques suelen ser las áreas verdes urbanas con mayor riqueza de especies, al observarse esto tanto para aves, plantas vasculares, mamíferos e insectos (Nielsen et al., 2014). Sin embargo, la riqueza de plantas vasculares y leñosas exóticas en los parques urbanos llegan incluso a representar más del 50 % en algunas urbanizaciones, mientras que las aves no alcanzan el 15 % (Nielsen et al., 2014). Una revisión sobre los factores intra-urbanos que actúan sobre la variación de la biodiversidad, ha demostrado que el tamaño de las áreas verdes urbanas y la conectividad son las variables más influyentes positivamente en la riqueza de especies, seguidos por la estructura de la vegetación (Beninde et al., 2015).
La ciudad de Asunción atraviesa un acelerado proceso de urbanización (Vázquez, 2012). Del Castillo (2014) provee una lista de las aves de la ciudad, con un total de 355 especies, que representan el 49 % de la avifauna del país. Dada la alta riqueza de aves presentes en la ciudad y el rápido crecimiento urbanístico crean una gran oportunidad para evaluar la diversidad de aves que mantienen las áreas verdes actuales, y comprender patrones en las comunidades biológicas en zonas urbanas, para sugerir propuestas para el mantenimiento de la biodiversidad y los servicios ecosistémicos en los procesos de urbanización de una ciudad. El presente estudio se ha desarrollado para responder a las siguientes preguntas de investigación: ¿contienen comunidades de aves similares las áreas verdes urbanas de una ciudad?; el tamaño y el contexto de las áreas verdes dentro de una ciudad ¿podrían influir en la estructura de la avifauna que albergan?
2. Metodología
El estudio se llevó a cabo en la ciudad de Asunción, la cual posee una densidad poblacional mayor a 4 406 habitantes por km2 (515 587 habitantes en 117 km2 de superficie), según el último censo (Dirección General de Estadística, Encuestas y Censos [DGEEC], 2013). La ciudad se encuentra situada sobre la orilla izquierda del Río Paraguay, en zonas de la ecorregión Litoral Central; esta posee una superficie de 26 310 km2, que abarca porciones de los departamentos de Central, Cordillera y San Pedro, y se caracteriza por poseer ecosistemas como lagunas, bañados, ríos, arroyos, bosques de suelos saturados (Secretaría del Ambiente [SEAM], 2013). La precipitación promedio anual en Asunción es de 1350 mm, y la temperatura promedio mínima y máxima anuales son 19.1 °C y 29.8 °C, respectivamente (DGEEC, 2013).
Estudiamos cuatro áreas verdes urbanas: el Jardín Botánico (JB, 282 hectáreas), el Parque de la Salud (PSa, 19 ha), el Parque Seminario (PSe, 10.8 ha) y el Parque Carlos Antonio López (PCAL, 5.8 ha; Figura 1). Son las áreas que poseen una mayor superficie y cobertura vegetal regular entre los espacios verdes de la ciudad, en comparación con otras muy pequeñas (menores a 2 ha) y severamente fragmentadas en cuanto a su vegetación. Las distancias de las áreas a un mismo punto del centro urbano de Asunción varían entre 1.2 km a 6.6 km (Cuadro 1). Los ambientes estudiados en las áreas verdes fueron las arboledas (presentes en las cuatro áreas verdes) y bordes de fragmentos boscosos (presentes en el PSa y en el JB). Las árboledas se caracterizan por presentar un solo estrato vertical principal, con baja densidad de árboles, en comparación con un área boscosa, en el cual se mantienen varios estratos verticales. Se han diferenciado hasta cinco estratos verticales en las áreas de estudio: 1) suelo desnudo; 2) vegetación herbácea; 3) arbustos; 4) árboles bajos (tres a cinco metros); 5) árboles medios a altos (cinco a ocho metros). El término “borde” implica transición entre hábitats adyacentes (López, 2004), por consiguiente, los bordes de bosque abarcaron parte de las superficies boscosas (aproximadamente 30 metros), como también, una parte similar de los sitios contiguos.
Cuadro 1. Distancia al centro urbano, estratos de la vegetación y superficie de las áreas estudiadas
|
Sitio de estudio |
Distancia a centro urbano (km) |
Estratos verticales de la vegetación |
Superficie (ha) |
|
Jardín Botánico (JB) |
6.6 |
5 |
282 |
|
Parque de la Salud (PSa) |
5.2 |
5 |
19 |
|
Parque Seminario (PSe) |
3.7 |
3 |
10.8 |
|
Parque Carlos Antonio López (PCAL) |
1.2 |
3 |
5.8 |
Las áreas de estudio albergan especies arbóreas nativas, entre las que se destacan: Albizia hassleri (yvyra ju), Delonix regia (chivato), Peltophorum dubium (cana fistula), Cecropia adenopus (ambay), Handroanthus impetiginosus (lapacho rosado), Handroanthus heptaphyllus (lapacho negro), Handroanthus pulcherrimus (lapacho amarillo), Anadenanthera colubrina (curupáy), Acrocomia totai (mbocayá), Ceiba speciosa (palo borracho), Jacaranda mimosifolia (jacaranda), Inga marginata (inga), Cedrela fissilis (cedro), Geoffroea striata (manduvirá), Patagonula americana (guayaibí), Genipa americana (ñandypa) y Eugenia uniflora (pitanga).

Figura 1. Localización de sitios de estudio en la ciudad de Asunción. Fuente: base de datos catastrales DGEEC (2002). QGIS 2.18.
Cuatro estaciones de conteo al azar fueron ubicadas en cada una de las áreas, en los ambientes de arboledas y bordes de bosque, con una distancia mínima de 100 m entre estación, para evitar doble conteos de individuos (Figura 2). Las aves fueron censadas a través de puntos de conteo de 10 min. (Bibby et al., 2000; Esquivel & Peris, 2008), al registrarse individuos oídos u observados en un radio de 30 m. Se realizaron seis visitas a cada estación de conteo, entre mayo y julio de 2016, época en que las poblaciones de aves suelen ser relativamente estables, aunque no tan cuantiosas como en la época reproductiva. Los censos fueron realizados por el mismo observador (AM) y se han llevado a cabo en las primeras tres horas del día, el cual es el horario sugerido para censar aves, de manera que se pudiera evitar variaciones en la actividad de ellas, por tiempo del día (Bibby et al., 2000; Esquivel & Peris, 2008).
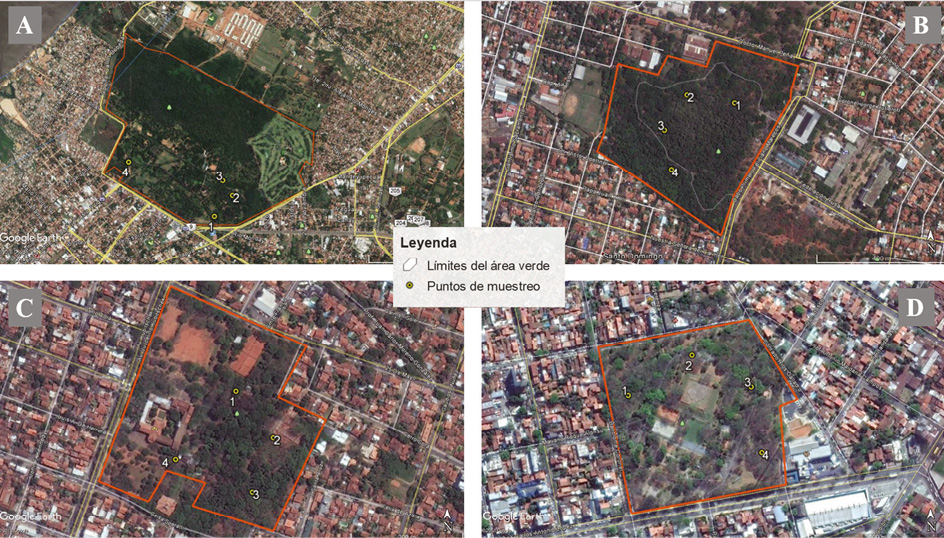
Figura 2. Puntos de muestreo en cada área verde. Imágenes tomadas de Google Earth Pro 2016. A: Jardín Botánico. B: Parque de la Salud. C: Parque Seminario. D: Parque Carlos Antonio López.
Las variables consideradas han sido: abundancia, abundancia relativa, riqueza específica, diversidad mediante el índice de Shannon, similitud entre áreas a través del índice de Jaccard, sensibilidad a disturbios en el hábitat (Stotz et al., 1996) y el estado de conservación de especies según la categorización de la UICN (2017) y de la SEAM (2006).
Para evaluar la representatividad de los datos o la calidad del muestreo y obtener estimadores de riqueza de especies, y los índices de Shannon y Jaccard, se utilizó el software EstimateS 9.1.0 (Colwell, 2013). Con el propósito de comparar estadísticamente los índices de Shannon obtenidos en cada uno de los seis días de muestreo en los cuatro sitios de estudio, se recurrió, primeramente, a una prueba de normalidad de datos Anderson Darling, al emplear el software Minitab 15, y luego se realizó un análisis de varianza (ANOVA) con su posterior prueba de Tukey. Se adoptó un nivel de significancia de 0.05. El coeficiente de correlación Spearman fue considerado para analizar la relación entre el logaritmo de la superficie total de cada área verde (2.45; 1.27; 1.03; y 0.7 6, respectivamente para el JB, PSa, PSe y PCAL) con las variables de riqueza, diversidad y abundancia de aves, para cada una de las estaciones de conteo (al sumar el totalde los seis conteos) de las cuatro áreas verdes, utilizando el software Past 3.15 (Hammer, 2013).
3. Resultados y discusión
3.1 Análisis de la riqueza observada y estimada
Se obtuvo un total de 1 777 registros para 71 especies de aves: 497 registros de 61 especies en el Jardín Botánico, 332 para 39 especies en el Parque de la Salud, 479 para 33 en el Parque Seminario y 469 para 30 especies en el Parque Carlos Antonio López.
Con excepción del Jardín Botánico, las curvas de acumulación de especies, graficadas mediante el estimador Jackknife 1 (Figura 3), presentan una asíntota, que indica que el esfuerzo de muestreo empleado para las tres áreas verdes ha sido suficiente (Jiménez y Hortal, 2003). Con este esfuerzo, el estimador calcula que el Parque de la Salud contiene una riqueza de 44 especies (IC 95 % = 39 – 49), 40 (IC 95 % = 35 – 45) para el Parque Seminario y 36 (IC 95 % = 31 – 41) para el Parque Carlos Antonio López. Estos valores son ligeramente mayores a la riqueza observada para cada sitio. En cambio, en el Jardín Botánico el estimador calcula que contiene 85 (IC 95 % = 76 – 94) especies, un valor relativamente mayor a la riqueza observada. Esta riqueza estimada y el comportamiento de la curva de acumulación de especies, demuestran que convendría un mayor tamaño muestral para esta área, lo cual permitiría un mayor número de registros (Nolazco, 2011; Villareal et al., 2004).
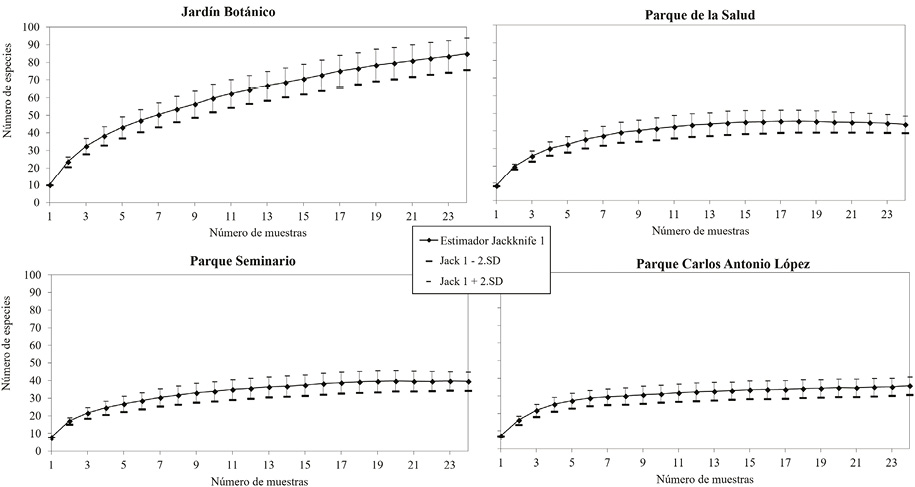
Figura 3. Curvas de acumulación de especies basadas en el estimador Jackknife 1 con un intervalo de confianza de 95 %.
El análisis de las curvas de los singletons y doubletons (Figura 4) también demuestra que se requiere un mayor esfuerzo muestral en el JB, a diferencia de las otras tres áreas verdes. En el caso del JB, se puede observar que a medida que aumenta el esfuerzo de muestreo, los singletons y los doubletons fueron aumentando, en el caso de las otras tres áreas, se observa una disminución de singletons para PSa y PSe, y una asíntota para PCAL, así como una asíntota de doubletons para PSa y PCAL, mientras que en PSe sigue aumentando durante el muestreo. Esto apoya la idea de que en JB convendría aumentar el número de repeticiones, dado que, con base en el supuesto de que en la naturaleza no existen individuos solos, sino poblaciones, un muestreo que posee muchos singles implica que no se ha censado un número suficiente de individuos o realizado suficientes repeticiones (Villareal et al., 2004).
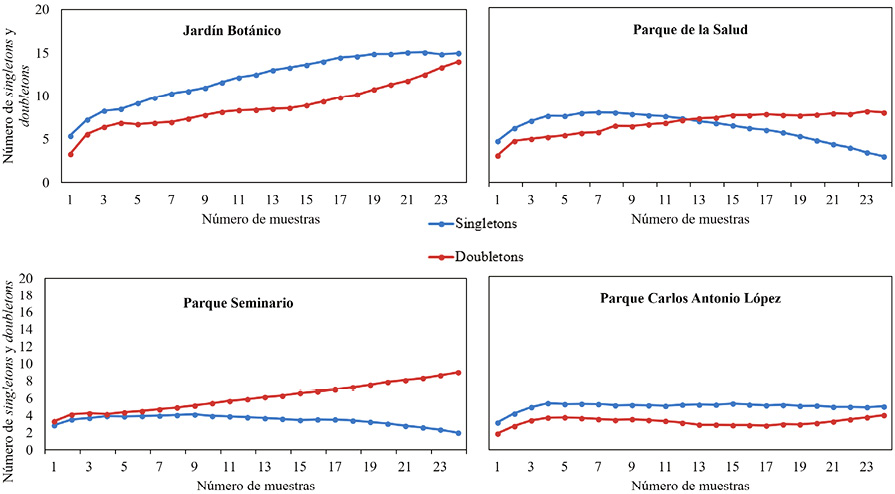
Figura 4. Curva de los singletons y curva de los doubletons para cada sitio.
Muchas especies de aves no fueron registradas durante los conteos, por encontrarse fuera del radio establecido de los puntos, o fuera del tiempo de conteo o porque fueron registradas durante los traslados entre puntos: 22 especies en JB, 10 en PSa, seis en PSe y cinco en PCAL, siendo 24 especies distintas en relación con las 71 registradas en los puntos. Varias de estas especies no censadas, utilizan los hábitats estudiados en este trabajo, pero algunas utilizan ambientes húmedos/acuáticos o áreas más abiertas (desprovistas de vegetación de estrato medio y alto), incluye pastizales (Clay & del Castillo, 2004).
3.2 Abundancia relativa, sensibilidad a disturbios y estado de conservación de las especies registradas
Del total de registros obtenidos durante los conteos (Apéndice 1), 88.52 % correspondieron a especies nativas y 11.48 % a introducidas; de estos últimos, 174 fueron del Gorrión (Passer domesticus), que constituyen la especie con más registros, y 30 de la Paloma Doméstica (Columba livia). PCAL presenta mayor abundancia de especies introducidas, con 157 y 25 registros para el Gorrión y la Paloma Doméstica respectivamente, al representar así el 39 % de los registros obtenidos en esta área. En el PSe, solo se obtuvieron 16 y cinco registros, respectivamente; mientras que en el JB hubo uno solo de Passer domesticus, y no fueron registradas durante los censos en el PSa. Estas dos especies son reconocidas por tener una exitosa adaptación a las zonas más urbanizadas. En el PCAL y el PSe, la vegetación es más fragmentada y dichas áreas están expuestas a mayor presión antrópica, por lo que ellas son las que encuentran mejores condiciones, ya que son favorecidas por la presencia de construcciones, residuos, áreas pavimentadas y céspedes (Wilson & Peter, 1988; Leveau & Leveau, 2004; White et al., 2005; Filippi, 2008).
Especies nativas generalistas, que se habitúan a las áreas urbanas, suelen tener poblaciones densas y estables. El Tordo Renegrido (Molothrus bonariensis) que es una especie que prefiere ambientes abiertos, incluso áreas urbanizadas (Narosky & Yzurieta, 2006), fue abundante en el PSe, frecuente en el PCAL, pero ausente en los puntos de las dos áreas restantes, las cuales presentan una vegetación más densa y menos espacios abiertos o artificiales.
El JB contiene una comunidad de aves en la cual el 48 % de sus especies son raras, y 13 % escasas (3 a 5 registros); el restante 39 % tienen abundancia relativa entre poco común (6 a 11 registros), frecuente y común (30 a 90 registros). El 34 % de las especies del PSe tienen una abundancia relativa rara, y 12 % son escasas. En el PSa, el 28 % son raras, y 26 % escasas. Por el contrario, en el PCAL el 47 % de las aves son frecuentes y tres por ciento abundantes (Figura 5). Esto demuestra una marcada diferencia en las comunidades de aves entre el PCAL con las otras áreas, donde en la primera el 50 % de sus especies ocurren con abundancias relativas altas, mientras que en las demás, entre el 46 % y 61 % de ellas ocurren con abundancias relativamente bajas. Al comparar los dos sitios más distintos en cuanto a sus abundancias relativas, en el JB la estructura del bosque contiene mayor estratificación, al ofrecer así más diversidad de hábitats para las especies de aves, mientras que en el PCAL la estructura del hábitat es más reducida, con solamente un estrato vegetal arbóreo (alto). Esta influencia de la estructura de la vegetación en la abundancia relativa de las aves, en áreas urbanas ha sido igualmente observada en otros estudios (Cueto, 1996; Hernández et al., 2010; Pérez & Tenorio, 2008).
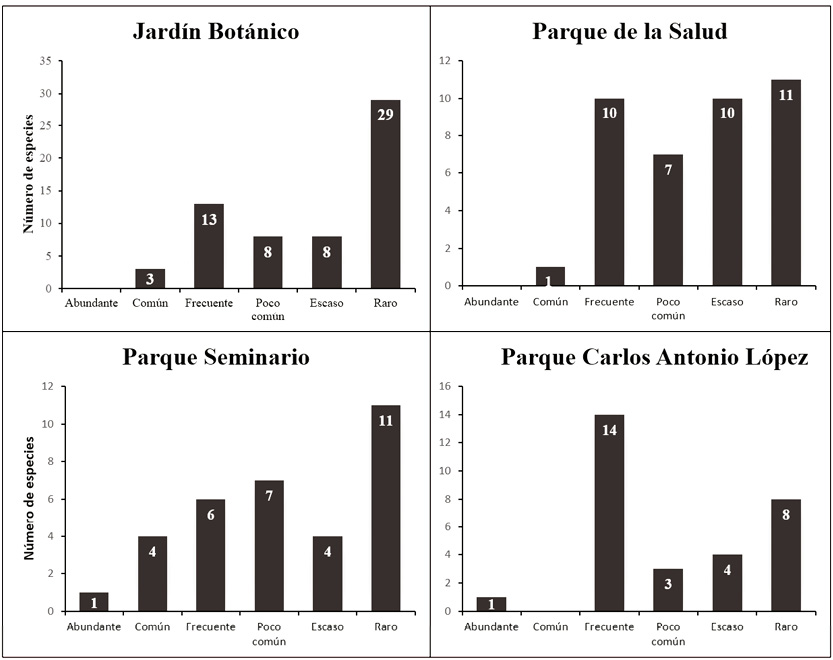
Figura 5. Abundancia de especies por área verde estudiada
Si bien no se registraron especies con sensibilidad alta a disturbios (Stotz et al., 1996), el JB presentó el mayor número con sensibilidad mediana (13 especies), seguido por el PSa (10 especies; Figura 6). La falta de especies sensibles a disturbios demuestra que la gran mayoría de las aves que componen estas comunidades tiene requerimientos de hábitats generales (Davies & Krebs, 2002) que se han adaptado a las condiciones establecidas por los procesos de urbanización en las áreas. Incluso en el JB y en el PSa, más del 74 % de sus comunidades de aves está compuesta por aquellas con sensibilidad baja a disturbios. La predominancia de especies generalistas en áreas con influencia de la urbanización ha sido documentada en varios estudios (Cursach & Rau, 2008; Germain et al., 2008; Almazán & Hinterholzer, 2010).
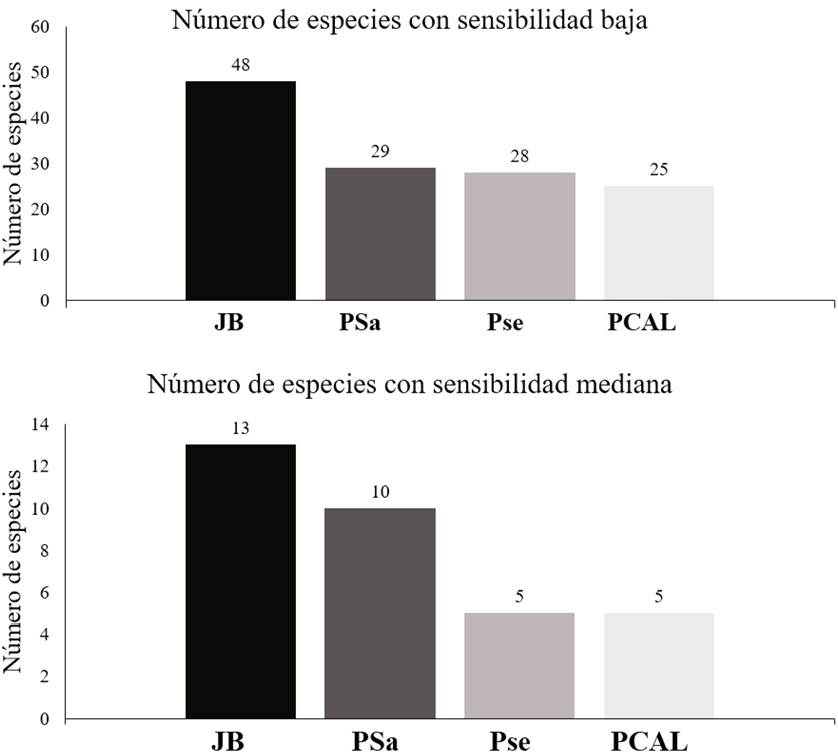
Figura 6. Cantidad de especies registradas en cada sitio, clasificadas según su sensibilidad a disturbios, basado en Stotz et al. (1996).
Todas las especies censadas pertenecen a la categoría Preocupación menor (UICN, 2017). Ninguna se encuentra en las listas de peligro de extinción o amenazadas de extinción de la SEAM. Las especies amenazadas, generalmente son registradas en hábitats silvestres con poca intervención humana, ya sea en áreas protegidas, como las IBAS (Áreas Importantes para la Conservación de Aves) (Guyra Paraguay, 2008). Aún ante la falta de especies amenazadas, varios autores sugieren estudiar los ecosistemas urbanos, con el propósito de proporcionar una base que permita comprenderlos de forma más precisa (Lizée et al., 2011; Faeth et al., 2011), y así, apuntar hacia la conservación de la biodiversidad en estos ambientes (Deaborn & Kark, 2010).
Ocho especies registradas en los puntos de conteo están incluidas en el Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES): Falco rufigularis, Paroaria coronata, los colibríes (Chlorostilbon lucidus, Hylocharis chrysura, Anthracothorax nigricollis) y los psitácidos (Amazona aestiva, Brotogeris chiriri, Forpus xanthopterygius), lo que significa que estas actualmente, no amenazadas, podrían llegar a estarlo si no se controla estrictamente su comercio (CITES, 2013).
3.3 Cálculo de similitud entre áreas verdes y diversidad de especies
3.3.1 Índice de Jaccard
Las áreas verdes situadas en zonas más cercanas al centro urbano, presentaron la mayor similitud (PSe y PCAL; 27 especies compartidas; índice: 0.75), al formar un nudo apreciable en el dendrograma de similitud (Figura 7), resultado que concuerda con Blair (1996), Parsons et al. (2003) y Faggi y Perepelizin (2006), en cuyos estudios se encontró que las zonas más intervenidas exhiben comunidades más homogéneas. Además, estas dos áreas contienen ambas una vegetación con menos estratos verticales (Cuadro 1).
El otro nudo del dendrograma representa al segundo mayor índice, el cual fue obtenido entre las dos áreas de mayor tamaño (JB y el PSa; 34 especies; índice: 0.51), sitios que, a diferencia de los demás, poseen mayor extensión de cobertura arbórea, mayor número de estratos verticales y se encuentran más lejanos al centro urbano, así como más cercanos a otras zonas con vegetación importante, lo cual contribuiría a mejorar la conectividad entre hábitats urbanos (Monsalve, 2009; Reyes & Figueroa, 2010); mientras que el PCAL y el PSe están aislados de otros sitios más naturales en la zona.
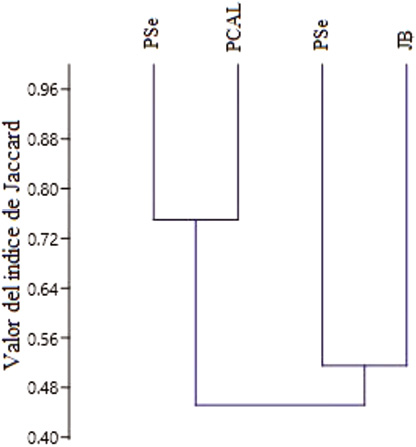
Figura 7. Dendrograma basado en el índice de similitud de Jaccard.
Veintiuna especies han sido comunes en todos los sitios. El JB (0.46) resultó ser, en promedio, el área verde que tiene el menor valor de similitud, evidencia que es el área con la comunidad de aves más diferente en comparación con las otras estudiadas. Al contrario, el PSe (0.56) demostró ser el más afín a las demás áreas verdes.
3.3.2 Índice de Shannon
La diversidad de especies más alta ocurrió en el JB (3.48), seguida por el PSa (3.25), el PSe (2.76), y por último, el PCAL (2.62) (Figura 8). De acuerdo con el orden citado, los valores del índice representan 32, 26, 16 y 14 especies con igual número de individuos (riqueza efectiva).
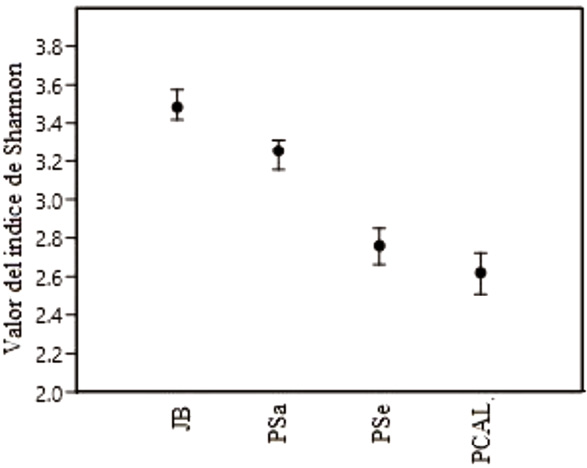
Figura 8. Valor de índice de Shannon (± ٢ SD) para cada sitio.
Los índices de diversidad entre las muestras diarias en cada sitio tuvieron una distribución normal mediante la prueba Anderson – Darling (p = 0.112). Se ha encontrado una diferencia altamente significativa (F2,20 = 49.39; p < 0.001) entre los índices de diversidad obtenidos para las cuatro áreas (Cuadro 2).
Cuadro 2. Análisis de varianza monofactorial de los índices de diversidad.
|
Origen de las variaciones |
Suma de los cuadrados |
Grados de libertad |
Promedio de los cuadrados |
F |
Probabilidad |
Valor crítico para F |
|
Entre grupos |
1.931 |
3 |
0.644 |
49.395 |
<0.001 |
3.098 |
|
Dentro de los grupos |
0.261 |
20 |
0.013 |
|||
|
Total |
2.192 |
23 |
El análisis post hoc de comparaciones múltiples, mediante la prueba de Tukey, indica que no existe diferencia estadísticamente significativa en los índices promedio de diversidad entre JB y PSa y entre el PSe y PCAL (Figura 9). Quedan conformados de esta forma dos subconjuntos homogéneos en cuanto a la diversidad en concordancia con los resultados de la Figura 7.
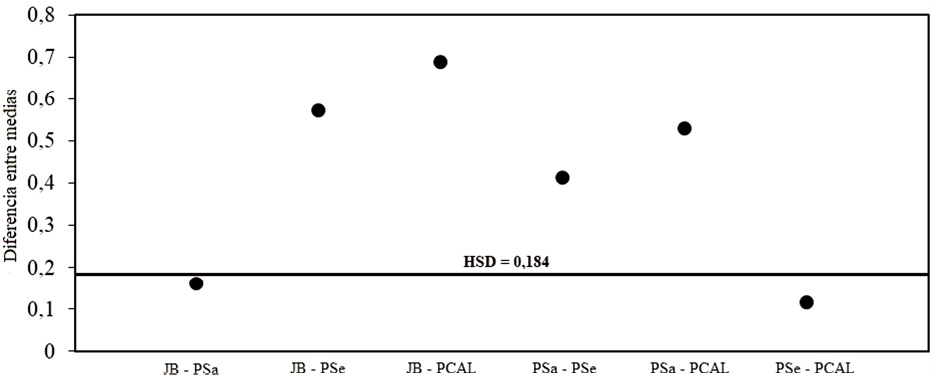
Figura 9. Valores correspondientes a la comparación de medias de los índices de diversidad de las comunidades de aves de cuatro áreas verdes urbanas de la ciudad de Asunción, Paraguay.
Los resultados concuerdan con trabajos similares como los de Blair (1999), Leveau & Leveau (2004), Tratalos (2007), Van Rensburg et al. (2009), Faggi & Perepelizin (2009), en los cuales también se observó una menor diversidad en áreas con mayor nivel de urbanización, en tanto que las que tienen menor grado de disturbios, generalmente localizadas en zonas suburbanas o en interfaces urbano-naturales, han sido más diversas.
El JB presentó la mayor diversidad, y fue también el sitio con menor similitud en relación con los demás (Jaccard), aunque no mostró diferencia significativa en relación con el PSa. Su proximidad con otros espacios verdes, naturales, y amplios espacios abiertos, además de la presencia de cuerpos de agua cercanos, son características que, según Faggi & Perepelizin (2006) y Melles et al. (2003), favorecen a que la avifauna del lugar no sea tan uniforme, así también como la estratificación vegetal más compleja que posee (Cueto, 1996: Pérez & Tenorio, 2008: Hernández et al. 2010). Al contrario, el hecho de que en el PCAL y en el PSe la diversidad hallada fue baja, apoya las observaciones de Chace & Walsh (2006), quienes expresan que la dominancia de unas pocas especies se da en los ambientes más urbanizados.
Clergeau et al. (2001) encontraron que las características internas de las áreas verdes son más determinantes para la diversidad que la influencia de las cualidades circundantes a las áreas, idea que cobra relevancia al tener en cuenta la vegetación más fragmentada de PSe y PCAL, frente a las otras dos. De hecho, en varios estudios llevados a cabo en áreas verdes urbanas (Estades, 1995; Díaz & Armesto, 2003; Berget, 2006; Nolazco, 2012), se ha demostrado que la variable cobertura vegetal es el principal factor que determina la composición y la estructura de la avifauna.
3.4 Relación entre la superficie de las áreas verdes y la abundancia, la riqueza y la diversidad de especies en cada una de ellas
Se encontró una correlación positiva significativa (rho = 0.716; p-valor bilateral = 0.002) entre la riqueza y la superficie de las áreas. También, ha sido positiva significativa (rho = 0.751; p-valor bilateral = 0.001) entre la diversidad y la superficie. Por el contrario, se observó una correlación negativa no significativa (rho = -0.285; p-valor bilateral = 0.284) entre la abundancia de las especies y la superficie de las áreas verdes.
El mayor tamaño del JB y el PSa permite un considerable número de hábitats que se traduce en una estructura más compleja de las especies vegetales, lo cual, según Kühn et al. (2004) y Knapp et al. (2008) va generalmente acompañado también de una mayor diversidad de fauna. Ortega y MacGregor (2009) explican que la influencia del tamaño de las áreas es consecuencia de la oferta específica de alimentos y refugios en sitios con menor disturbio humano. Por otra parte, Chávez (2014) no encontró una relación entre los tamaños de parques y plazas de la ciudad de Valdivia (Chile) con la riqueza de avifauna. El mismo autor discute que ese resultado podría deberse a que la mayoría de las aves no perciben fragmentación en razón a la cobertura arbórea continua que existe en calles, jardines y áreas verdes, por sobre las construcciones humanas.
A pesar de que el análisis indica que el mayor tamaño de las áreas verdes favorece la riqueza y la diversidad de la avifauna, varias especies se mantienen en una abundancia menor que en áreas más pequeñas y homogéneas, en las cuales se observa un menor número de especies y dominancia de aquellas generalistas con reducidas necesidades de hábitats específicos. Esto coincide con Margalef (1998) y Schmitz (2007), quienes sostienen que, en ambientes más naturales, son pocas las especies con mucha ocurrencia de individuos, no obstante, son muchas con condiciones de vida más definidas (especialistas) que se encuentran representadas con pocos individuos. Por lo tanto, se comprende la relación negativa, aunque no significativa, que resultó entre la abundancia y el tamaño de los espacios verdes.
4. Conclusiones
Hemos encontrado que las comunidades de aves en cuatro áreas verdes urbanas de la ciudad de Asunción, presentan una composición distinta, con una marcada diferencia en su riqueza de especies y abundancia relativa de ellas. Las áreas verdes de mayor tamaño, con una estructura de la vegetación más compleja y que se encuentran más distantes del centro urbano, han demostrado contener una mayor riqueza y diversidad; sus comunidades son más similares, y la abundancia relativa de las especies es más heterogénea, no observándose una dominancia de especies generalistas o especies “explotadores” urbanos, como es el caso en las áreas urbanas de menor tamaño y a menor distancia del centro urbano evaluadas en el presente estudio.
Se demuestra la importancia de mantener áreas verdes grandes y con la vegetación nativa de ecosistemas naturales dentro de las urbanas, para que se puedan proveer hábitats a un mayor número de especies de aves. La conectividad entre áreas verdes dentro de la ciudad, o incluso con ecosistemas naturales fuera de la matriz de la zona urbana, podría ser sumamente relevante para mantener una estructura de comunidades de aves más diversa, y deben ser abordados en nuevas investigaciones. Estos podrían servir de base para un ordenamiento territorial de las ciudades, para las cuales se tengan en cuenta criterios de conectividad y área mínima representativa entre sus zonas verdes, y un tamaño mínimo viable para mantener comunidades naturales.
5. Agradecimientos
Agradecemos las sugerencias y los comentarios tanto de los editores de la revista como de los dos revisores anónimos que ayudaron a mejorar el escrito. A Gustavo Rivas y a Victoria Kubota, por sus sugerencias en cuanto a la estadística aplicada. A Rebeca Irala, por el acompañamiento durante el levantamiento de datos.
6. Referencias
Alberti, M., Bradley, G., Shulenberger, E., Marzluff, J., Ryan, C., & Zumbrunnen, C. (2003). Integrating humans into ecology: opportunities and challenges for studying urban ecosystem. Bioscience, 53(12), 1169-1179. Recuperado de https://academic.oup.com/bioscience/article/53/12/1169/301939. doi: 10.1641/0006-3568(2003)053[1169:IHIEOA]2.0.CO;2
Almazán, R. C. & Hinterholzen, A. (2010). Dinámica temporal de la avifauna en un parque urbano de la ciudad de Puebla, México. Huitzil, 11(1), 26-34. Recuperado de http://huitzil.net/blog/wp-content/uploads/2013/06/HUITZIL-2010-11126-34.pdf
Beninde, J., Veith, M., & Hochkirch, A. (2015). Biodiversity in cities needs space: A meta-analysis of factors determining intra-urban biodiversity variation. Ecology Letters, 18(6), 581–592. https://doi.org/10.1111/ele.12427
Berget, C. (2006). Efecto del tamaño y la cobertura vegetal de parques urbanos en la riqueza y diversidad de la avifauna de Bogotá, Colombia. Gestión y ambiente, 9(2), 45-60. Recuperado de http://www.redalyc.org/pdf/1694/169420986006.pdf
Bibby, C., Jones, B., & Marsden, S. (1998). Expedition field techniques: Bird surveys. Inglaterra: Royal Geographical Society.
Blair, R. B. (1996). Land use and avian species diversity along an urban gradient. Ecological Aplications, 6(2), 506-519. doi: 10.2307/2269387
Blair, R. B. (1999). Birds and butterflies along an urban gradient: surrogate taxa for assessing
biodiversity? Ecological Applications, 9: 164-170.
doi: 10.1890/1051-0761(1999)009[0164:BABAAU]2.0.CO;2
Chace, J. F. & Walsh, J. J. (2006). Urban effects on native avifauna: a review. Landscape and Urban Planning, 74(1), 46-69. doi: 10.1016/j.landurbplan.2004.08.007
Chávez, C. A. (2014). Relación entre la avifauna, la vegetación y las construcciones en plazas y parques de la ciudad de Valdivia. Tesis de grado, Universidad Austral de Chile. Recuperado de http://cybertesis.uach.cl/tesis/uach/2014/fifc512r/doc/fifc512r.pdf
CITES. (2013). Apéndices I, II y III de la CITES. Recuperado de https://cites.org/esp/app/index.php
Clergeau, P., Jokimak, J., Savard, J. P. (2001). Are urban bird communities influenced by the bird diversity of adjacent landscapes? Journal of Applied Ecology, 38, 1122-1134. Recuperado de http://onlinelibrary.wiley.com/doi/10.1046/j.1365-2664.2001.00666.x/pdf
Colwell, R. K. (2013). Estimates: Biodiversity estimation software, ninth version. Recuperado de http://viceroy.eeb.uconn.edu/estimates/EstimateSPages/AboutEstimateS.htm
Croci, S., Butet, A., & Cleargeau, P. (2008). Does urbanization filter birds on the basis of their biological traits? The Condor, 110 (2), 223–240. doi: 10.1525/cond.2008.8409
Cueto, V. R. (1996). Relación entre los ensambles de aves y la estructura de la vegetación: un análisis a tres escalas espaciales. Tesis doctoral en Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Recuperado de http://digital.bl.fcen.uba.ar/gsdl-282/cgibin/library.cgi?a=d&c=tesis&d=Tesis_2858_Cueto
Cursach, J. A. & Rau, J. R. (2008). Influencia de las perturbaciones humanas sobre la diversidad del ensamble de aves costeras en el seno de Reloncaví, sur de Chile. Boletín Chileno de Ornitología 14 (2), 92-91.
Davies, N. B. & Krebs, J. R. (2002). An Introduction on Behavioural Ecology. Inglaterra: Wiley-Blackwell.
Deaborn, D. C. & Kark, S. (2010). Motinvations for conserving urban diversity. Conserv. Biolo. , 24(2), 432-440. doi: 10.1111/j.1523-1739.2009.01328.x
Del Castillo, H. (2014). Lista de aves de Asunción. Paraquaria, 2(1): 29-42. Recuperado de http://guyra.org.py/paraquaria-2014/#
Díaz, I. & Armesto, J. (2003). La conservación de aves silvestres en ambientes urbanos de Santiago. Ambiente y Desarrollo, 19(2), 31-38. Recuperado de https://www.researchgate.net/publication/242091660_La_conservacion_de_las_aves_silvestres_en_ambientes_urbanos_de_Santiago
Dirección General de Estadística Encuestas y Censos (DGEEC) (2013). Compendio Estadístico 2012. Fernando de la Mora. Recuperado de http://www.dgeec.gov.py/Publicaciones/Biblioteca/compendio2012/Compendio%20Estadistico%202012.pdf
Esquivel, A. & Peris, S. (2008). Influence of the time of day, duration and number of the counts in point count sampling of birds in an Atlantic Forest of Paraguay. Ornitología Neotropical, 19, 229-242. Recuperado de http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.483.35&rep=rep1&type=pdf
Estades, C. F. (1995). Aves y vegetación urbana: el caso de las plazas. Boletín Chileno de Ornitología, 2, 7-13.
Evans, K. L., Chamberlain, D. E., Hatchwell, B. J., Gregory, R. D., & Gaston, K. J. (2011). What makes an urban bird? Global Change Biology, 17(1), 32–44. Retrieved from http://search.ebscohost.com/login.aspx?direct=true&AuthType=sso&db=edsgao&AN=edsgcl.243288265&lang=es&site=eds-live&scope=site. doi: 10.1111/j.1365-2486.2010.02247.x
Faeth, S., Bang, C., & Saari, S. (2011). Urban biodiversity: patterns and mechanisms. The Year in Ecology and Conservation Biology, 1223, 69-81. doi: 10.1111/j.1749-6632.2010.05925.x
Faggi, A. & Perepelizin, P. V. (2006). Riqueza de aves a lo largo de un gradiente de urbanización en la ciudad de Buenos Aires. AR. Rev. Museo Argentino de Ciencias Naturales, 8(2), 289-297. Recuperado de http://www.macn.secyt.gov.ar/investigacion/descargas/publicaciones/revista/08/rns_vol08-2_289-297.pdf
Faggi, A. & Perepelizin, P. V. (2009). Diversidad de aves en tres barrios de la ciudad de Buenos Aires, Argentina. Multiequina, n.º 18, 71-85. Recuperado de http://www.redalyc.org/articulo.oa?id=42812317007
Filippi, O., Devictor, V., Clobert, J., & Julliard, R. (2008). Effects of age and intensity of urbanization on farmland bird communities. Biological conservation, 11(141), 2698-2707. doi: 10.1016/j.biocon.2008.08.006
Friesen, L. E., Eagles P. F. J., & MacKay R. J. (1995). Effects of residential development on forest-dwelling Neotropical migrant songbirds. Conservation Biology, 9(6), 1408-1414. doi: 10.1046/j.1523-1739.1995.09061408.x
Garaffa, P. I., Filloy, J., & Bellocq, M. I. (2009). Bird community responses along urban–rural gradients: Does the size of the urbanized area matter? Landscape and Urban Planning, 90, 33–41. Retrieved from http://10.0.3.248/j.landurbplan.2008.10.004. doi: 10.1016/j.landurbplan.2008.10.004
Germain, P., Cuevas, Y., Sanhueza, C., Tizón, F. R., Loydi, A., de Villalobos, A. E., Zapperi, G., Vázquez, B., Pompozzi, G., & Piován, M. J. (2008). Ensamble de aves en zonas con diferente grado de urbanización en la ciudad de Bahía Blanca (Buenos Aires, Argentina). BioScriba, 1(2), 35-45.
Grimm, N. B., Faeth, S. H., Golubiewski, N. E., Redman, C. L., Wu, J., Bai, X., & Briggs, J. M. (2008). Global Change and the Ecology of Cities. Science, 319(2008), 756–760. doi: 10.1126/science.1150195
Haedo, J., Gioia, A., Aráoz, E., Paolini, L., & Malizia, A. (2017). Primary productivity in cities and their influence over subtropical bird assemblages. Urban Forestry and Urban Greening, 26(August 2016), 57–64. doi: 10.1016/j.ufug.2017.04.017
Guyra Paraguay. (2008). Áreas Importantes para la Conservación de las Aves del Paraguay. Paraguay: Guyra Paraguay / BirdLife International.
Hammer, Ø. (2013). Past 3.15: software for scientific data analysis. Recuperado de https://folk.uio.no/ohammer/past/
Hernández, F. R., Báez, S. A., Pérez, A. & Calp, B. (2010). Caracterización de una comunidad de aves y su relación con la estructura de la vegetación en un bosque de Pino-Encino de la localidad del Valle Ancón del Parque Nacional Viñales. Avances, 12(2). Recuperado de http://www.ciget.pinar.cu/Revista/No.2010-2/articulos/caracterizaci%F3n_comunidad_aves.pdf
Jiménez, A. & Hortal, J. (2003). Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología, 8, 151-161. Recuperado de http://jhortal.com/pubs/2003-Jimenez-Valverde&Hortal_Rev_Ib_Aracnol.pdf
Kark, S., Iwaniuk, A., Schalimtzek, A., & Banker, E. (2007). Living in the city: Can anyone become an “urban exploiter”? Journal of Biogeography, 34(4), 638–651. doi: 10.1111/j.1365-2699.2006.01638.x
Knapp, S., Kühn, I., Mosbrugger, V., & Klotz, S. (2008). Do protected areas in urban and rural landscapes differ in species diversity? Biodiversity Conservation, 17, 1595-1612. doi: 10.1007/s10531-008-9369-5
Kühn, I., Brandl, R., & Klotz, S. (2004). The flora of German cities is naturally species rich. Evolutionary Ecology Research, 6, 749-764. Recuperado de http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.594.6967&rep=rep1&type=pdf
Leveau, L. M. (2013). Bird traits in urban–rural gradients: how many functional groups are there? Journal of Ornithology, 154 (3), 655–662. doi: 10.1007/s10336-012-0928-x
Leveau, L. M. & Leveau, C. M. (2004). Comunidades de aves en un gradiente urbano de la ciudad de Mar del Plata, Argentina. El Hornero, 19(1), 13-21.
Leveau, C. M., & Leveau, L. M. (2005). Avian community response to urbanization in the Pampean region, Argentina. Ornitologia Neotropical, 16, 503–510.
Leveau, L. M., & Zuria, I. (2017). Flocking the city: avian demography and population dynamics in urban Latin America. In I. MacGregor-Fors & J. F. Escobar-Ibáñez (Eds.), Avian Ecology in Latin American Cityscapes (pp. 57–77). Springer International Publishing. doi: 10.1007/978-3-319-63475-3
Lizée, M. H., Mauffrey, J. F., Descamps-Cottin, M., & Tatoni, T. (2011). Monitoring urban environments on the basis of biological traits. Ecological Indicators, 11, 353-361. doi: 10.1016/j.ecolind.2010.06.003
López, F. (2004). Estructura y función en bordes de bosques. Ecosistemas 13 (1): 67-77.
Maas, J., Sonja, V. D., Robert, A., Groenewegen, P. P. (2009). Social contacts as mechanism behind relation between green space and health. Health & Place, 15(2), 586-595. doi: 10.1016/j.healthplace.2008.09.006
MacGregor-Fors, I., Morales-Pérez, L., & Schondube, J. E. (2011). Does size really matter? Species-area relationships in human settlements. Diversity and Distributions, 17(1), 112–121. doi: 10.1111/j.1472-4642.2010.00714.x
Margalef, R. (1998). Ecología. 8va. Edición. España: Omega.
Melles, S., Glenn, S. & Martin, K. (2003). Urban bird diversity and landscape complexity: species-environment associations along a multiscale habitat gradient. Conservation Ecology 7 (1). Recuperado de https://www.ecologyandsociety.org/vol7/iss1/art5/main.html. doi: 10.5751/ES-00478-070105
Monsalve, A. M. (2009). Redes ecológicas en la estructura urbana de la ciudad de Medellín (Colombia). Boletin CF+S 42/43. Simposio Internacional Desarrollo, Ciudad y Sostenibilidad. Recuperado de http://habitat.aq.upm.es/boletin/n42/aa-amon.html
Narosky, T. & Yzurieta, D. (2006). Guía para la identificación de las aves de Paraguay. Argentina: Vazquez Mazzini Editores.
Nielsen, A. B., van den Bosch, M., Maruthaveeran, S., & van den Bosch, C. K. (2014). Species richness in urban parks and its drivers: A review of empirical evidence. Urban Ecosystems 17 (1), 305–327. doi: 10.1007/s11252-013-0316-1
Nolazco, S. (2012). Diversidad de aves silvestres y correlaciones con la cobertura vegetal en parques y jardines de la ciudad de Lima. Boletín UNOP, 7(1). Recuperado de https://guzlop-editoras.com/web_des/bio01/zoo/pld0707.pdf
Olds, E. G. (1938). Distribution of sums of squares of rank differences for small numbers of individuals. The Annals of Mathematical Stastics, 9(2), 133-148. doi: 10.1214/aoms/1177732332
Ortega, R. & Macgregor, I. (2009). Living in the big city: Effects of urban land-use on bird community structure, diversity and composition. Landscape and Urban Planning, 90, 189- 195. doi: doi.org/10.1016/j.landurbplan.2008.11.003
Parsons, H., French, K., & Major, R. E. (2003). The influence of remnant blushland on the composition of suburban bird assemblages in Australia. Landscape Urban Plann, 51, 29-36. doi: 10.1016/S0169-2046(03)00094-X
Pérez, E. E. & Tenorio M. I. (2008). Relación entre la estructura del hábitat y la comunidad de aves en el fundo agroecológico Huaquina, Chincha - Perú. Tesis de grado en Biología, Universidad Nacional “San Luis Gonzaga” de ICA. Recuperado de https://www.kew.org/science/tropamerica/peru/resources/Huaquina_thesis.pdf
Ramírez, J. E. (2010). Diversidad de aves de hábitats naturales y modificados en un paisaje de la Depresión Central de Chiapas, México. Biología tropical, 58(1), 511-528. Recuperado de http://www.scielo.sa.cr/pdf/rbt/v58n1/a36v58n1.pdf
Reyes, S. & Figueroa, M. (2010). Distribución, superficie y accesibilidad de las áreas verdes en Santiago de Chile. EURE, 36(109), 89-110. Recuperado de http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0250-71612010000300004
Savard, J. L., Clergeau, P., & Mennechez, G. (2000). Biodiversity concepts and urban ecosystems. Landscape and Urban Planning, 48(3-4): 131-142. doi: 10.1016/S0169-2046(00)00037-2
Schmitz, O. J. (2007). Ecology and Ecosystem Conservation. Estados Unidos: Island Press.
Shanahan, D. F., Strohbach, M. W., Warren, P. S., & Fuller, R. A. (2014). The challenges of urban living. In D. Gil & H. Brumm (Eds.), Avian Urban Ecology: Behavioural and Physiological Adaptations (pp. 3–20). Oxford University Press.
Secretaría del Ambiente (SEAM). (2006). Resoluciones 2242/06 y 2243/06. Paraguay.
Stagoll, K., Manning, A. D., Knight, E., Fischer, J., & Lindenmayer, D. B. (2010). Using bird habitat relationships to inform urban planning. Landscape and urban planning, 98(1): 13-25. doi: 10.1016/j.landurbplan.2010.07.006
Stotz, D. F., Fitzpatrick, J. W., & Parker, T. A. (1996). Neotropical birds: ecology and conservation. Estados Unidos: Universidad de Chicago.
Tratalos, J., Fuller, R. A., Evans, K. L., Davies, R. G., Newson, S. E., Greenwood, J. J. D., & Gaston, K. J. (2007). Bird densities are associated with household densities. Global Change Biology, 13(8), 1685–1695. doi: 10.1111/j.1365-2486.2007.01390.x
UICN (Unión Internacional para la Conservación de la Naturaleza). (2017). The IUCN Red List of Threatened Species. http://www.iucnredlist.org/
Van Rensburg, B., Peacock, D., & Robertson, M. (2009). Biotic homogenization and alien bird species along an urban gradient in South Africa. Landscape and Urban Planning 92: 233- 241. doi: 10.1016/j.landurbplan.2009.05.002
Vázquez, F. (2012). Ciudades intermedias y sustentabilidad urbana en Paraguay. En: El Desafío del Desarrollo Sustentable en América Latina. SOPLA. Recuperado de http://www.kas.de/wf/doc/kas_36621-1522-4-30.pdf?140120190157
Villareal, H., Álvarez, M., Córdoba, S., Escobar, F., Fagua, G., Gast, F., Mendoza, H., Ospina, M., Umaña, A. M. (2004). Manual de métodos para el desarrollo de inventarios de Biodiversidad. Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Recuperado de http://www.zin.ru/animalia/coleoptera/pdf/villareal_et_al_2004.pdf
White, J. G., Antos, M. J., Fitzsimons, J. A., & Palmer, G. C. (2005). Non-uniform bird assemblages in urban environments: the influence of streetscape vegetation. Landscape and Urban Planning, 71, 123-135. doi: 10.1016/j.landurbplan.2004.02.006
Wilson, E. O. & Peter, F. (1988). Biodiversity. Estados Unidos: National Academies Press. Recuperado de https://books.google.com.py/books?id=MkUrAAAAYAAJ&printsec=frontcover&hl=es&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false
7. Apéndices
Apéndice 1. Cuadro de abundancias relativas por área verde y sensibilidad a disturbios de las especies registradas
|
Especies registradas |
Abundancia relativa* |
Sensibilidad a disturbios |
|||
|
Jardín Botánico |
Parque de la Salud |
Parque Seminario |
Parque C. A. López |
||
|
Coragyps atratus |
PC |
- |
- |
- |
B |
|
Accipiter striatus |
R |
- |
- |
- |
M |
|
Rupornis magnirostris |
R |
- |
R |
- |
B |
|
Columba livia |
- |
- |
E |
F |
B |
|
Columbina picui |
R |
- |
R |
F |
B |
|
Leptotila verreauxi |
C |
F |
C |
F |
B |
|
Crotophaga ani |
F |
- |
- |
- |
B |
|
Piaya cayana |
- |
R |
- |
- |
B |
|
Anthracothorax nigricollis |
R |
- |
- |
- |
B |
|
Chlorostilbon lucidus |
F |
PC |
PC |
F |
B |
|
Hylocharis chrysura |
F |
F |
R |
F |
M |
|
Picumnus cirratus |
PC |
R |
R |
R |
B |
|
Melanerpes candidus |
R |
- |
- |
- |
B |
|
Veniliornis passerinus |
- |
E |
- |
- |
B |
|
Piculus chrysochloros |
R |
E |
- |
- |
M |
|
Colaptes melanochloros |
E |
R |
R |
E |
B |
|
Colaptes campestris |
E |
- |
- |
- |
B |
|
Celeus lugubris |
R |
E |
- |
- |
M |
|
Caracara plancus |
R |
R |
- |
- |
B |
|
Falco rufigularis |
R |
- |
- |
- |
B |
|
Brotogeris chiriri |
PC |
PC |
PC |
F |
M |
|
Amazona aestiva |
R |
- |
R |
- |
M |
|
Forpus xanthopterygius |
E |
F |
R |
- |
B |
|
Thamnophilus doliatus |
- |
PC |
- |
- |
B |
|
Sittasomus griseicapillus |
E |
- |
- |
- |
M |
|
Lepidocolaptes angustirostris |
F |
PC |
PC |
E |
M |
|
Furnarius rufus |
F |
F |
C |
F |
B |
|
Phacellodomus ruber |
PC |
E |
- |
- |
B |
|
Synallaxis frontalis |
R |
R |
- |
- |
B |
|
Camptostoma obsoletum |
R |
- |
- |
- |
B |
|
Hemitriccus margaritaceiventer |
E |
PC |
- |
- |
M |
|
Pyrocephalus rubinus |
- |
- |
- |
R |
B |
|
Machetornis rixosus |
R |
- |
R |
- |
B |
|
Myiarchus tyrannulus |
R |
- |
- |
- |
B |
|
Pitangus sulphuratus |
F |
F |
C |
F |
B |
|
Megarynchus pitangua |
R |
R |
E |
E |
B |
|
Pachyrampus viridis |
- |
R |
- |
- |
M |
|
Cyclarhis gujanensis |
E |
PC |
E |
R |
B |
|
Cyanocorax chrysops |
PC |
- |
- |
- |
B |
|
Progne chalybea |
- |
- |
PC |
- |
B |
|
Troglodytes aedon |
F |
F |
F |
R |
B |
|
Campylorhynchus turdinus |
F |
F |
F |
PC |
B |
|
Polioptila dumicola |
F |
F |
E |
F |
M |
|
Turdus leucomelas |
R |
PC |
PC |
PC |
B |
|
Turdus rufiventris |
PC |
E |
F |
F |
B |
|
Turdus amaurochalinus |
F |
F |
F |
F |
B |
|
Mimus saturninus |
- |
- |
- |
R |
B |
|
Geothlypis aequinoctialis |
R |
- |
- |
- |
B |
|
Setophaga pitiayumi |
R |
R |
- |
- |
M |
|
Paroaria coronata |
F |
- |
PC |
E |
B |
|
Nemosia pileata |
R |
E |
- |
- |
B |
|
Thlypopsis sordida |
- |
E |
- |
- |
B |
|
Tachyphonus rufus |
R |
- |
- |
- |
B |
|
Thraupis sayaca |
C |
F |
C |
PC |
B |
|
Conirostrum speciosum |
PC |
E |
- |
- |
B |
|
Poospiza melanoleuca |
R |
- |
- |
- |
M |
|
Sicalis flaveola |
R |
R |
PC |
R |
B |
|
Sporophila leucoptera |
PC |
- |
- |
- |
B |
|
Sporophila angolensis |
E |
- |
- |
- |
B |
|
Sporophila caerulescens |
R |
- |
- |
- |
B |
|
Coryphospingus cucullatus |
E |
E |
- |
- |
B |
|
Saltator coerulescens |
F |
C |
F |
F |
B |
|
Zonotrichia capensis |
R |
- |
R |
R |
B |
|
Gnorimopsar chopi |
R |
- |
- |
- |
B |
|
Agelaioides badius |
C |
- |
- |
- |
B |
|
Molotrhus bonariensis |
- |
- |
A |
F |
B |
|
Icterus pyrrhopterus |
R |
R |
- |
R |
M |
|
Cacicus solitarius |
R |
- |
- |
- |
B |
|
Cacicus haemorrhous |
F |
E |
R |
- |
B |
|
Euphonia chlorotica |
R |
R |
R |
R |
B |
|
Passer domesticus |
R |
- |
F |
A |
B |
* A: Abundante; C: Común; E: Escaso; F: Frecuente; PC: Poco Común; R: Raro.
** B: Baja; M: Mediana.
a Ingeniero ambiental, investigador y consultor. Facultad de Ciencias Agrarias, Universidad Nacional de Asunción, Paraguay.
b Consultor experto en Biología de Conservación y Manejo de Recursos Naturales. Wildlife Paraguay – Birding & Nature Tours, Paraguay. alberto.esquivel@wildlife.com.py. ORCID: 0000-0003-0331-047X
c Especialista en Ciencias de Vida Silvestre. Trabaja en el Laboratorio de Zoología y es directora del Departamento de Biología de la Universidad Nacional de Asunción, Paraguay. andreaweiler1@gmail.com
 |
 |
 |
 |
Los artículos publicados se distribuye bajo una Licencia Creative Commons Atribución 4.0 Internacional (CC BY 4.0) basada en una obra en http://www.revistas.una.ac.cr/ambientales., lo que implica la posibilidad de que los lectores puedan de forma gratuita descargar, almacenar, copiar y distribuir la versión final aprobada y publicada del artículo, siempre y cuando se mencione la fuente y autoría de la obra. |
|