Revista de Ciencias Ambientales (Trop J Environ Sci). (Enero-Junio, 2017). EISSN: 2215-3896. Vol 51(1): 1-15.
DOI: http://dx.doi.org/10.15359/rca.51-1.1
URL: www.revistas.una.ac.cr/ambientales
EMAIL: revista.ambientales@una.cr

Período óptimo de enraizamiento de clones superiores de Gmelina arborea Roxb
Optimal Period of Rooting of Superior Clones of Gmelina arborea Roxb
Juan Pablo Villegas-Espinozaa, Rafael Murillo-Cruzb, Carlos Ávila-Ariasc, William Hernández-Castrod
a Licenciado en Manejo Forestal, investigador de la Universidad Nacional de Costa Rica (UNA), juan.villegas.espinoza@una.cr
b Máster en Ciencias Agrícolas y Recursos Naturales con énfasis en Suelos, investigador y académico, Instituto de Investigación y Servicios Forestales (UNA), murillorafael5454@yahoo.com
c Máster en Gestión de Recursos Naturales y Tecnologías de Producción, investigador y académico, Instituto de Investigación y Servicios Forestales (UNA), carlosenriquea79@gmail.com
d Máster en Ciencias Forestales con Concentración en Silvicultura Clonal, investigador y académico, Instituto de Investigación y Servicios Forestales (UNA), william.hernandez.castro@una.cr
[Recibido: 27 de octubre 2016; Aceptado: 12 de enero 2017; Corregido: 17 de marzo 2017; Publicado: 21 de abril 2017]
Resumen
Aunque la clonación de Gmelina arborea por estaca es relativamente simple, aún se carece de un protocolo de producción clonal con criterios científicos, necesario para mejorar la producción y disminuir los tiempos de enraizamiento, evitar la aparición de plagas y enfermedades, y disminuir costos de reforestación en general. Con tal fin, se evaluó el periodo óptimo de enraizamiento de esquejes de clones superiores de G. arborea dentro de túneles de enraizamiento. Se evaluaron cuatro periodos de enraizamiento (9, 12, 15 y 18 días) utilizando esquejes con diferente diámetro de los clones ٥, ٦ y ٩. Después del proceso de enraizamiento se evaluaron las variables longitud, diámetro, porcentaje de enraizamiento, altura final y biomasa verde y seca total de las plantas. Para el análisis estadístico se realizaron pruebas de media, análisis de varianza y modelos logísticos. Se obtuvo en promedio 98% de enraizamiento en el ensayo, el tratamiento a los 15 días obtuvo 100 % de enraizamiento; sin embargo, no se presentaron diferencias significativas; el diámetro fue significativo en el período de enraizamiento. La altura media de las plantas mostró diferencias significativas; a los 15 días reportó mayor crecimiento (9,71 cm) y después de este período disminuyó en un 7%. El tratamiento de 15 días registró mayor biomasa seca total, únicamente mostró diferencias estadísticas con el tratamiento de 18 días. Entre el período de 12 a 15 días, el peso seco de las raíces aumentó en 55,3%. No se generó ninguna diferencia significativa entre clones para el porcentaje de enraizamiento y altura de las plantas, aunque la biomasa seca total sí mostró divergencias, donde el clon 9 fue el de mayor promedio (0,27 g). El periodo de enraizamiento durante 15 días influyó positivamente en la propagación vegetativa de clones de melina.
Palabras claves: Biomasa verde, clon, diámetro, esqueje, Gmelina arborea.
Abstract
Despite cloning with cuttings of Gmelina arborea is relatively simple, a clonal production protocol with scientific criteria is lacking. The protocol is needed to improve production and reduce rooting times, to avoid the emergence of plagues and illnesses, and reduce costs of reforestation in general. Therefore, the optimal period for rooting cuttings of superior clones of Gmelina arborea in rooting tunnels was assessed during this investigation. We worked with four rooting periods of 9, 12, 15 and 18 days, respectively, and they were evaluated by using cuttings with different diameter of the clones 5, 6 and 9. After the rooting process, some variables, such as length, diameter, rooting percentage, final height and total green and dry biomass of plants, were evaluated. The statistical analyses applied tests of means, analysis of variance, and logistic models. On average, 98% of plants rooted, and the treatment obtained 100% of rooting in 15 days. However, no significant differences were found; the diameter was significant in the rooting period. The average height in plants showed significant differences at 15 days: a highest growth, 3.82 in (9.71 cm), was reported, and after this period it decreased by 7%. The 15 day treatment reported a total increase of dry biomass; only this one showed a statistical difference with the 18 day treatment. The period of 12 to 15 days for rooting presented a dry-root weight increase of 55.3%. No significant differences in the percentage between clones for rooting and plant height were generated; however, the total biomass showed differences with the clone 9, being the highest average (0.27 g). The rooting period for 15 days positively influenced the vegetative propagation of clones of melina.
Keywords: Green biomass, clone, diameter, cutting, Gmelina arborea.
1. Introducción
Gmelina arborea (melina) es una de las especies más ampliamente establecidas en sistemas de producción forestal, en las regiones tropicales y subtropicales; debido, principalmente, a su acelerada tasa de crecimiento y productividad, retorno de la inversión y posibilidades de transformación de su madera (Araya, Murillo, Aguilar & Rocha, 2005; Ávila, Murillo, Murillo & Sandoval, 2015; Dvorak, 2004; Rojas & Murillo, 2004; Indira, 2006). En el país, es la principal especie maderable comercializada internamente, utilizada en la fabricación de productos de embalaje, la construcción y fabricación de muebles (Oficina Nacional Forestal [ONF], 2013).
La investigación de la especie en los últimos años en Costa Rica se basó en impulsar programas de mejoramiento genético, mediante estrategias de producción clonal (Salas, 2012). Lo anterior queda evidenciado en el hecho de ser la especie de mayor producción en los viveros forestales de Costa Rica en el 2012, con más de tres millones de plantas y posiblemente la de mayor tasa de plantación nacional con fines comerciales (Murillo & Guevara, 2013). No obstante, es necesario revisar y actualizar los métodos para la propagación vegetativa de la especie, con el fin de garantizar la producción de material clonal en la cantidad y calidad necesarias (Moraes, Fonseca & Rui, 2014).
Se entiende por estaca o esqueje una porción de la planta que se colecta y que es capaz de adquirir autonomía fisiológica en condiciones ambientales favorables (Gárate, 2010). Dicho proceso reproductivo es fundamental en la propagación vegetativa de muchas especies forestales (Ferreira et al., 2004; Fett-Neto et al., 2001) y en la reproducción clonal de genotipos seleccionados por sus características superiores (Xavier, Wendling & Da Silva, 2009).
El enraizamiento de esquejes está relacionado con la constitución genética (Alfenas, Zauza, Mafía & Assis, 2004), la juventud del jardín clonal y su estado nutricional, las condiciones ambientales, el medio de enraizamiento y el uso de tratamientos hormonales (Muñoz, Vargas, López & Soto, 2009; Xavier et al., 2009). Además, existen otros factores que influyen en el enraizamiento, como la época de cosecha, la longitud de los esquejes, la presencia de hojas y yemas; y el diámetro (Gárate, 2010). Este último parámetro es determinante en el desarrollo del sistema radicular de las plantas, de ahí la importancia de establecer valores óptimos sobre el diámetro de los esquejes y aplicar dicha información en la escogencia de los esquejes que se llevarán posteriormente a los túneles de enrizamiento.
El período que deben permanecer los esquejes en los túneles de enraizamiento varía para cada especie y está directamente relacionado con la velocidad de enraizamiento. En la mayoría de las especies forestales el enraizamiento de los esquejes ocurre entre los 30 y 50 días (Gárate, 2010; Rojas, García & Alarcón, 2004). A nivel del proceso productivo, es indispensable definir el número de días óptimo que los esquejes deben permanecer dentro del enraizador, ya que cada día posterior a ese lapso representa un costo que no será cubierto con mayor calidad de las plantas; al contrario, los esquejes enraizados cada vez tendrán raíces más débiles, suculentas, escasas y mayor riesgo de enfermedades (Ferreira et al., 2004; Gárate, 2010; Mesén, 1998).
La reproducción de la melina mediante dicha técnica es relativamente fácil y muy eficiente, principalmente por su gran capacidad de rebrote y enraizamiento (Rojas et al., 2004). No obstante, con el propósito de completar un protocolo basado en criterios científicos de producción clonal para la especie, es necesario crear nuevas alternativas de mejoramiento de la producción y disminuir los tiempos de enraizamiento de genotipos superiores, para evitar la aparición de plagas y enfermedades, reducir costos de producción y reforestación en general y, a la vez, ayudar a los programas de producción a escala comercial (Chacón & Murillo, 2005). De tal manera que, el presente estudio tuvo como objetivo determinar el período óptimo de días que los esquejes de melina deben permanecer dentro de los túneles de enraizamiento para aumentar la producción en cantidad y calidad de las plantas.
2. Materiales y métodos
2.1 Ubicación del área de estudio
El estudio se llevó a cabo en el vivero de reproducción vegetativa de especies forestales del Instituto de Investigación y Servicios Forestales de la Universidad Nacional de Costa Rica (INISEFOR-UNA), ubicado en el cantón de Golfito, distrito Puerto Jiménez, localidad La Palma.
2.2 Descripción de la investigación
Se colocaron esquejes de melina dentro de túneles de enraizamiento en diferentes periodos de tiempo. Las plantas madres productoras de los esquejes fueron podadas el mismo día, para producir esquejes fisiológicamente de la misma edad, es decir, de 12 días. Se utilizaron únicamente esquejes que contuvieran yemas apicales (Murillo & Badilla, 2005; Rodríguez Xavier, Silva, Amaral & Rosado, 2011) y que mostraran características como buen vigor, sin enfermedades ni anomalías en su desarrollo (Gárate, 2010); estos mismas fueron seleccionadas aleatoriamente en el jardín clonal, de los clones 5, 6 y 9. Los clones provienen del Programa de Investigación y Extensión de la Zona Sur de Costa Rica, INISEFOR.
Los esquejes se trabajaron con 20 cm² de área foliar remanente, para lo cual se utilizó un molde de hoja cuadriculada transparente. La reducción del área foliar de los esquejes se realizó dos días previo a su cosecha del jardín de multiplicación clonal. Luego de cosechados los esquejes, se pesaron para obtener la biomasa verde de entrada, luego se midió el diámetro y la longitud; posteriormente se les aplicó ácido Indol-Butírico con una concentración de 3000 ppm para promover la formación de raíces e incrementar su capacidad de enraizado, luego se colocaron en pastillas marca Jiffy (“Jiffys”) recién hidratados y se introdujeron en los túneles de enraizamiento. En el proceso de cosecha los esquejes se mantuvieron secos para evitar cualquier tipo de contaminación con los demás esquejes por medio de la savia.
2.3 Diseño experimental
En el ensayo se establecieron cuatro bloques completos al azar, para un total de 480 plantas. Cada bloque correspondió a un túnel específico de enraizamiento con 120 plantas, en cada bloque se evaluaron 4 tratamientos según diferentes periodos de enraizamiento. En cada tratamiento se utilizaron los clones número 5, 6 y 9; y 10 plantas por clon para un total de 30 plantas por tratamiento.
2.4 Variables de la investigación
2.4.1 Variables independientes
Las variables independientes o de clasificación que se evaluaron fueron los tratamientos del número de días en los cuales los esquejes de melina deben permanecer dentro de los túneles de enraizamiento, los que se exponen a continuación:
T1: tratamiento 1 con 9 días dentro del túnel de enraizamiento
T2: tratamiento 2 con 12 días dentro del túnel de enraizamiento
T3: tratamiento 3 con 15 días dentro del túnel de enraizamiento
T4: tratamiento 4 con 18 días dentro del túnel de enraizamiento
2.4.2 Variables dependientes
2.4.2.1 Variables de entrada
Proceso realizado previo al enraizamiento de los esquejes:
Longitud: Los esquejes se trabajaron con una longitud promedio de 7,81 cm.
Diámetro: Se midió el diámetro en la base de cada uno de los esquejes con un vernier digital con precisión de 0,00 mm, utilizando diámetros entre 1,53 y 5,08 mm.
Biomasa verde: Se determinó el peso verde de cada esqueje con una balanza digital, con precisión de 0,0 g.
2.4.2.2 Variables de salida
Posterior al enraizamiento de los esquejes:
Porcentaje de enraizamiento o sobrevivencia: Se determinó dividiendo la cantidad de plantas de las que se apreciaban sus raíces saliendo del jiffy, entre la totalidad del tratamiento y multiplicando ese dato por 100.
% enraizamiento = Plantas enraizadas por tratamiento*100 (1)
Total de plantas por tratamiento
Altura final de las plantas: Se midió la distancia desde el cuello de la raíz (donde se une la raíz con el tallo) hasta la yema terminal o apical.
Biomasa verde y seca total de las plantas: Se midió la biomasa verde final de cada tejido por separado, aérea y raíz, luego se introdujeron en un horno de secado a una temperatura de 70° C hasta lograr peso constante. Con una balanza de precisión se procedió a cuantificar el peso seco de la biomasa seca aérea, radicular y total.
2.5 Análisis de datos
Parte de los análisis estadísticos se efectuaron con el software estadístico InfoStat, se calcularon medidas estadísticas resumen, análisis de varianza (ANOVA) y prueba de Tukey (α ≤ 0,05) para comparar las medias de los tratamientos, según las variables dependientes y poder determinar diferencias significativas entre ellos.
Mediante el programa estadístico “R” versión ٣.١.٠ (R Core Team, 2014), se realizaron modelos logísticos utilizando como variable respuesta el enraizamiento de los esquejes; combinando las variables tratamiento, diámetro y biomasa verde, para generar modelos según el criterio de información de Akaike (AIC, Akaike Information Criteria). Este trata de obtener el modelo que proporcione mejores predicciones entre los modelos existentes (Caballero, 2011), generando ecuaciones para los mejores modelos. La selección del modelo que se ajustó mejor a los datos se realizó a partir del valor mínimo del AIC, el cual se trabajó a un 85% para lograr una mejor apreciación de los resultados (Vinuesa, 2008). Se generó un gráfico de cajas (box-plot) para ver la distribución de los datos según la biomasa verde al finalizar el periodo de enraizamiento.
3. Resultados
3.1 Variables de entrada
Previo al proceso de enraizamiento, la longitud promedio de los esquejes fue de 7,81 cm (± 0,54). Se reportó para la población en general un diámetro medio de 3,11 mm (± 0,73) y 1,59 g (± 0,58) en biomasa verde. Ambas variables de entrada registraron coeficientes de variación altos, con 23,4 y 36,7% respectivamente, al no existir control sobre dichas variables.
En la evaluación del diámetro de los esquejes previo al enraizamiento (Cuadro 1), se registraron diferencias estadísticamente significativas entre los T1 y T4, y de ambos con el T2 y T3, los cuales a su vez no observaron diferencias entre ellos; el T1 tenía diámetros 46,9 % mayores que el T4. Esa misma diferencia estadística entre los tratamientos se presentó en biomasa verde inicial, donde se obtuvieron coeficientes de variación mayores a los reportados por el diámetro.
Cuadro 1. Valores promedio y prueba de medias para las variables de entrada, determinados a los esquejes de G. arborea para cada tratamiento previo al enraizamiento
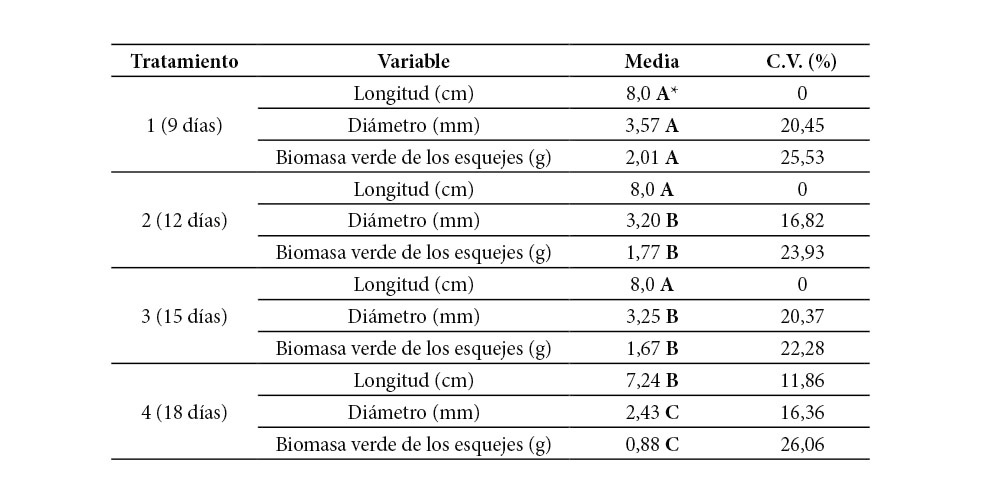
C.V.: Coeficiente de variación. *Letras distintas indican diferencias significativas (p<= 0,05).
Previo al enraizamiento, el clon 9 registró valores promedio mayores en comparación con los clones 5 y 6, con 3,47 mm de diámetro (± 0,76), 1,79 g (± 0,62) de biomasa verde y 7,83 cm (± 0,51) de longitud, mostró diferencias estadísticas significativas en las dos primeras variables. Por otra parte, el clon 5 y 6 registraron 2,99 mm (± ٠,٦٣) y ٢,٨٦ mm (± ٠,٦٤) de diámetro y 1,54 g (± 0,57) y 1,43 g (± 0,49) en biomasa verde respectivamente. No obstante, los coeficientes de variación entre clones para todas las variables evaluadas fueron similares.
3.2 Porcentaje de enraizamiento
La evaluación del porcentaje de enraizamiento de las plantas durante el periodo de enraizamiento registró un promedio general de 98%. Los esquejes que estuvieron en los túneles por 15 días registraron un enraizamiento del 100%, los demás tratamientos obtuvieron 96, 97 y 99%, según los tratamientos 9, 12 y 18 días respectivamente. No obstante, en el análisis de prueba de medias, no se determinaron diferencias estadísticamente significativas entre tratamientos, ni entre clones.
Se probaron 10 posibles modelos en función del enraizamiento de las plantas, reportó menor AIC el modelo que consideró el tratamiento + diámetro (Cuadro 2, Figura 1). El modelo basado en el tratamiento y diámetro reflejó cómo los esquejes con diámetros entre 1,5 y 3 milímetros lograron porcentajes de enraizamiento entre 95 y 100% en los túneles. El tratamiento de 15 días fue el único que no registró mortalidad; los demás tratamientos reportaron mortalidad de los esquejes en relación con el aumento del diámetro de estos.
El diámetro promedio de los esquejes que enraizaron fue de 3,10 mm; por su parte, el diámetro de los esquejes que no enraizaron fue de 3,65 mm en promedio, lo que significa que los esquejes que no enraizaron tenían diámetros 17,74%, mayores que los esquejes que sí enraizaron, lo cual evidencia mayor enraizamiento de las plantas a menor diámetro. El mismo patrón se presentó en la variable biomasa verde de entrada, en donde las plantas que enraizaron reportaron una media de 1,58 g y las que no enraizaron presentaron 1,95 g; es decir, 23,4% más biomasa verde en las plantas que no enraizaron.
Cuadro 2. Modelos estadísticos explicativos basados en el enraizamiento de esquejes de G. arborea según AIC
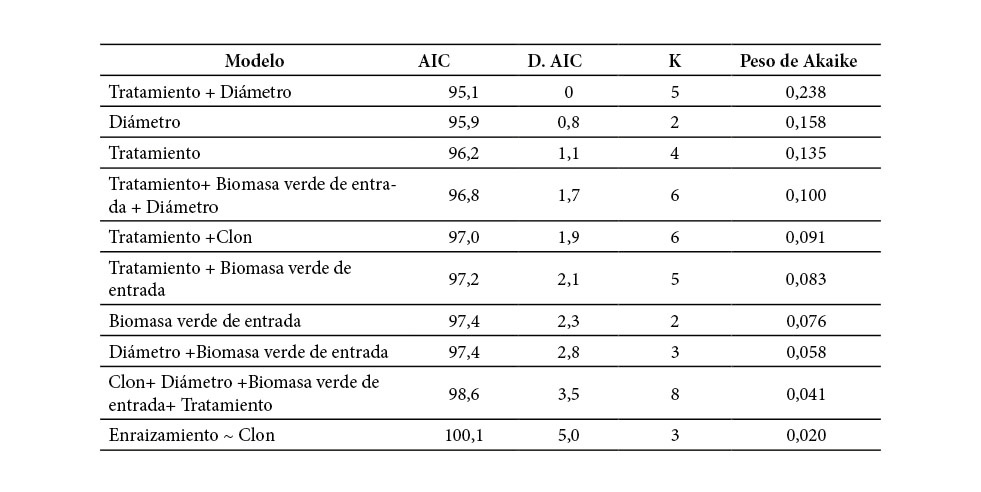
AIC: Criterio de Información de Akaike (AIC, por sus siglas en inglés), D. AIC: Diferencia de AIC entre el mejor modelo y los demás; K: Es el número de parámetros independientes estimados dentro del modelo; Peso de Akaike: La probabilidad de que sea el mejor modelo.
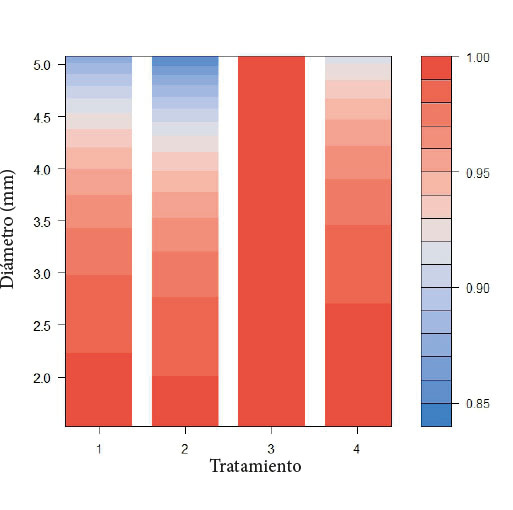
Figura 1. Modelo logístico basado en el porcentaje de enraizamiento de G. arborea de acuerdo con cada tratamiento y diámetro. T1 (9 días), T2 (12 días), T3 (15 días), T4 (18 días), escala a la derecha indica porcentajes de enraizamiento.
A continuación, se muestra la ecuación generada a partir del modelo logístico basado en el porcentaje de enraizamiento como variable respuesta según el diámetro inicial de los esquejes:
Porcentaje enraizamiento = Plogis (7,14 – 0,97 * diámetro (mm) (2)
Dónde:
Plogis = función estadística para calcular probabilidades, d = diámetro inicial esquejes (mm)
A nivel de proceso productivo en los viveros de propagación vegetativa de G. arborea, esta ecuación es relevante, ya que permite estimar la probabilidad de enraizamiento que pueden tener los esquejes al finalizar el periodo de enraizamiento, según el diámetro de entrada en milímetros.
3.3 Altura final de las plantas
En la figura 2 se muestra la distribución de los datos en altura de las plantas de melina para cada tratamiento, así como los valores atípicos. Se aprecia que, al aumentar el número de días de las plantas en los enraizadores, la distribución de los datos es más heterogénea o dispersa, alrededor de la media. En este sentido, las plantas alcanzaron mayor desarrollo a los 15 días dentro de los enraizadores, luego a los 18 días el crecimiento disminuyó en un siete por ciento (9,10 cm) con respecto al tratamiento de mayor altura media.
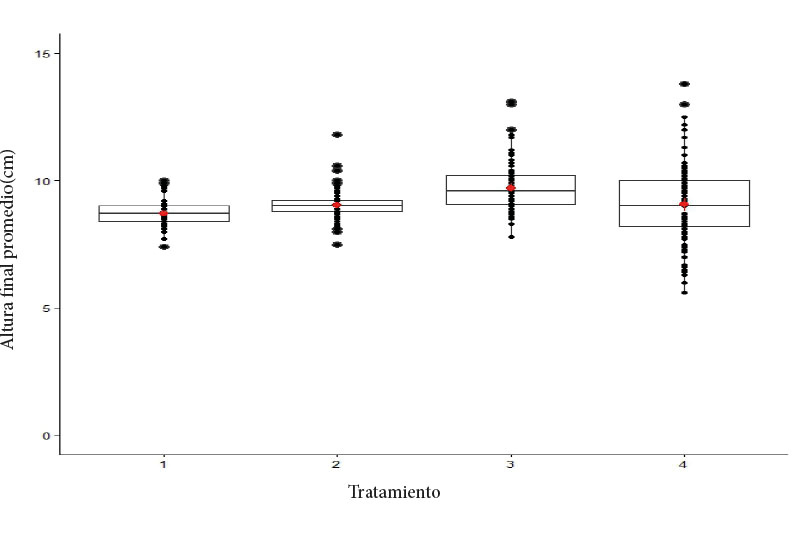
Figura 2. Distribución de la altura final de las plantas de G. arborea al finalizar el periodo de enraizamiento. T1 (9 días), T2 (12 días), T3 (15 días), T4 (18 días).
Por otra parte, no se registraron diferencias estadísticamente significativas en cuanto al desarrollo de la altura final de las plantas enraizadas, entre los tres clones utilizados; es decir, ningún clon sobresalió en el desarrollo de la altura a nivel de vivero. A nivel de genotipo, en edades tempranas de las plantas en vivero, la altura no se debería considerar como una variable por utilizar para selección temprana del material que será llevado al campo, ya que no presenta correlación constante con las características dasométricas (Ávila, 2015).
3.4 Biomasa verde y seca total de las plantas
La distribución de la biomasa verde y seca de las plantas, según los tratamientos, se muestra en la figura 3. La biomasa verde final aumentó al incrementar el número de días que permanecían las plantas en los túneles de enraizamiento, hasta los 15 días (T3), y después de ese periodo hasta 18 días, la biomasa verde disminuyó un 29%, cuando reportó diferencias significativas entre el tratamiento 3 y los demás. Por otra parte, la biomasa seca final de las plantas de melina mostró mayor dispersión de los datos en los tratamientos 1, 2 y 3; por el contrario, el T4 reportó valores más homogéneos o con menor variabilidad en el peso de las plantas al finalizar el proceso de enraizamiento.
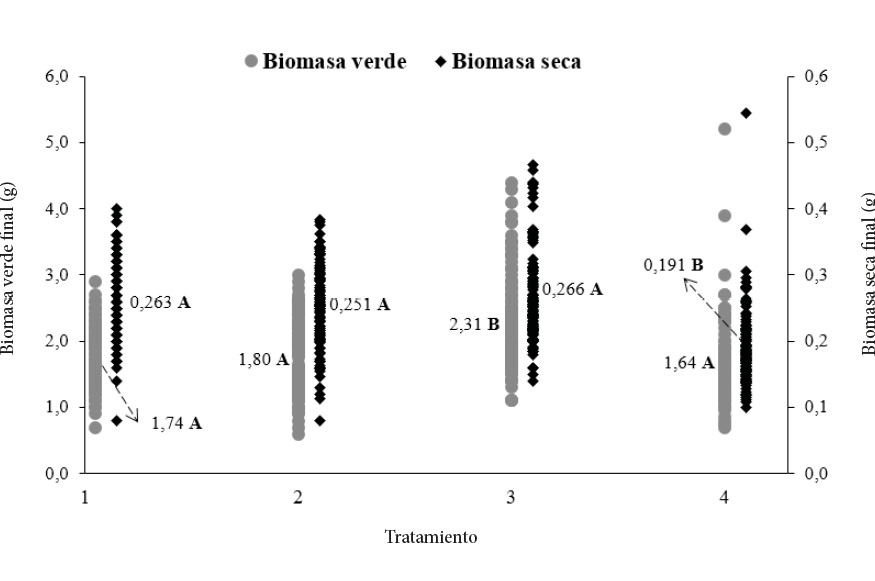
Figura 3. Distribución de la biomasa verde y seca final de las plantas de G. arbórea, según el número de días de enraizamiento. T1 (9 días), T2 (12 días), T3 (15 días), T4 (18 días). Letras distintas indican diferencias significativas (p<= 0,05).
Al finalizar el proceso de enraizamiento, el incremento en la biomasa total de las plantas de melina evaluadas no fue proporcional al número de días según cada tratamiento. El tratamiento de 15 días en los túneles registró mayor cantidad de biomasa total, sin embargo, no registró diferencias significativas con los tratamientos 9 y 12.
Como era de esperarse, se registró un incremento en el crecimiento del sistema radicular de las plantas conforme aumentaba la cantidad de días de permanencia en los túneles, hasta llegar a la evaluación, a los 18 días, donde se registró la mayor cantidad de biomasa de raíz. Lo anteriormente indicado, a excepción de la evaluación realizada a los nueve 9 días, en la cual no se registró crecimiento en raíz, solamente indicios de crecimiento de estas.
El aumento en la biomasa de raíz conforme aumentó la cantidad de días en los túneles se tradujo en diferencias significativas entre todos los cuatro tratamientos evaluados. Por su parte, tanto para la biomasa aérea seca como para la total, solo se determinaron diferencias entre el tratamiento de 18 días (menor media) y todos los demás (9, 12 y 15 días) que fueron estadísticamente iguales entre ellos. Lo anterior sugiere, que si bien es cierto la planta pierde biomasa foliar desde que entra al túnel hasta la evaluación a los 18 días, esta no es estadísticamente significativa.
En cuanto al material genético utilizado, se registraron diferencias significativas entre los tres clones en cuanto a su biomasa total; el clon 9 registró la mayor y el 6 la menor biomasa (Cuadro 3). El mismo patrón se presentó en la biomasa aérea, no obstante, en la biomasa de raíz no se mostraron diferencias estadísticas entre los tres clones, solamente entre el clon 5 y 6. De igual forma, Hernández y Salas (2009) reportaron diferencias significativas en la biomasa aérea y radicular entre fenotipos de G. arborea en vivero.
Cuadro 3. Prueba de medias sobre la biomasa seca de raíz, aérea y total según el material genético evaluado para los esquejes enraizados de G. arborea

Letras distintas indican diferencias significativas (p<= 0,05).
4. Discusión
4.1 Datos de entrada
De los resultados obtenidos en esta investigación, la longitud de los esquejes se encuentra dentro del rango que se aconseja trabajar para el óptimo desarrollo y formación de raíces, de entre 6 y 10 cm y de 4 a 8 cm, recomendado por Xavier et al. (2009) y Alfenas et al. (2009), respectivamente, además Gárate (2010) reportó que esquejes con menos de 4 cm de longitud no son recomendados, para evitar que las hojas entren en contacto con el sustrato y favorecer la producción de la hoja, además recomienda utilizar diámetros entre 3 y 8 mm.
Murrieta (2010) y Gárate (2010) reportaron que la longitud de los esquejes afecta en la formación de raíces por el contenido de sustancias de reserva que se almacenan en estas y que, junto con el diámetro, son dos variables que se deben controlar durante el proceso de enraizamiento, ya que se encuentran estrechamente relacionadas con el tamaño y diámetro de los esquejes.
Con respecto al uso de clones, se reportó una homogeneidad en el desempeño del material genético, lo cual es de suma importancia en la logística de producción en el vivero. Caso contrario a lo reportado por Andrade et al. (2013) quienes concluyeron que el material genético influyó en el periodo de enraizamiento de los esquejes.
Según los resultados, en la biomasa verde inicial se obtuvieron diferencias significativas entre tratamientos; sin embargo, la formación de la biomasa foliar que la planta necesita para soportar las condiciones de campo deben propiciarse en el período de aclimatación y endurecimiento, ya que en este punto las plantas se adaptan progresivamente a la luz y a las condiciones ambientales en general (Gárate, 2010).
4.2 Porcentaje de enraizamiento
Los períodos evaluados para el enraizamiento de los esquejes de melina en el ensayo son muy similares a lo reportado por Rojas et al. (2004) para la misma especie, variando de 2 a 3 semanas; sin embargo, la tasa de enraizamiento para ese estudio osciló entre 70 y 90%, según el clon, manejo del jardín clonal y las condiciones de enraizamiento en el invernadero.
De todas las variables que se probaron en cada uno de los modelos, el diámetro resultó ser el parámetro con mayor probabilidad de ajuste de los datos, por lo tanto, el diámetro es uno de los principales criterios por considerar, a la hora de seleccionar los esquejes en el ingreso al proceso de enraizamiento.
En el análisis de los resultados, según el porcentaje de enraizamiento, no se determinaron diferencias estadísticamente significativas entre tratamientos, ni entre clones, lo cual refleja que no existen grandes diferencias en la genética de los clones evaluados cuando se habla de enraizamiento. Caso contrario reportaron Ferreira et al. (2004) y Rodríguez et al. (2011), con diferencias significativas en el enraizamiento de clones de Eucalyptus a través del tiempo.
Con estos resultados se evidencia que G. arborea es una especie con buena capacidad para enraizar en un periodo relativamente corto, por ejemplo, si se lo compara con el periodo de propagación por esquejes de varios tipos de Eucalyptus, comprendiendo periodos de 20 a 45 días (Xavier et al., 2009).
4.3 Altura final de las plantas
En el análisis de medias del crecimiento en altura de las plantas de melina para cada tratamiento, se observó un aumento proporcional entre el número de días en que las plantas estuvieron en los túneles y la variabilidad en el crecimiento en altura, reportando mayor variabilidad en el T4 con 16,25%, seguido de 9,13%, 6,14% y 4,61%, según T3, T2 y T1 respectivamente y se registraron diferencias significativas, entre los distintos tratamientos; Hernández & Salas (2009) también reportaron diferencias significativas en la altura promedio de plantas de G. arborea con micorrizas y sin ellas, a nivel de vivero. En el presente estudio, el T3 expresó mayor media en altura con 9,73 cm y diferencias estadísticas significativas de 11,35% con respecto al T1, el de menor altura media con 8,73 cm.
Asimismo, refleja que la competencia entre plantas de melina fue mayor conforme aumentó el número de días en los enraizadores; este patrón se reflejó en el periodo de 18 días (T4) y mostró gran heterogeneidad en la altura de las plantas dentro de los túneles. Según Rodríguez (2010), este patrón amenaza con reprimir el crecimiento de plantas que crecen a menor ritmo; por esta razón, es importante obtener plantas más uniformes en altura al finalizar el proceso de enraizamiento y endurecimiento, antes de ser llevadas al campo.
4.4 Biomasa verde y seca total de las plantas
Los valores reportados en la biomasa verde total de las plantas indican que las diferencias significativas entre los tratamientos T3 y los demás pudieron ser causados por la competencia entre plantas, provocando estrés y pérdida de hojas a los 18 días de enraizamiento. Lo anterior es influenciado por el desprendimiento de hojas en los esquejes, una vez que son colocados en los túneles; luego las hojas comienzan a crecer hasta que saturan el espacio aéreo y se inicia la competencia por luz, lo que genera un crecimiento diferencial en altura, que se agrava con el tiempo en perjuicio de las plantas más pequeñas.
Las anteriores diferencias son importantes para seleccionar plantas con mayor cantidad de biomasa que eventualmente estén mejor preparadas para soportar las condiciones de establecimiento en campo, es decir, plantas de buena calidad, vigorosas, con tallos resistentes y raíces abundantes (Vial, Baldini y Duchens, 2013).
La biomasa seca obtenida del sistema radicular de las plantas según los tratamientos, muestra que el período en el cual los esquejes permanecen en los túneles de enraizamiento es precisamente para formar mayor sistema radicular posible, lo que es indispensable, ya que, según Bañon, Martínez, Fernández, Balanzategui & Melgares (2002), las plantas con un sistema radicular de mayor peso son las que obtienen finalmente mayor desarrollo. El tratamiento de 18 días sí presentó diferencias significativas en cuanto a la biomasa seca total con respecto a los demás; este reportó una disminución de 28% con respecto al de 15 días, lo que se considera un resultado por tomar muy en cuenta en la programación y seguimiento de los períodos de enraizamiento de las plantas.
El mayor incremento registrado en biomasa de raíz fue de 55,3% en el periodo de enraizamiento comprendido entre los 12 y 15 días, lo que coincide con el momento antes de que se presente la mayor pérdida de biomasa foliar y, por ende, la mayor disminución en la actividad fotosintética. Al respecto, Flores (1994) indica que la raíz ejerce influencia reguladora sobre el crecimiento de las plantas, ya que son las encargadas de transportar las sustancias que ayudan en los procesos fisiológicos de las plantas como la fotosíntesis y el crecimiento. Por lo tanto, plantas con mayor sistema radicular presentan mayor tasa de supervivencia en el campo (Rodríguez, 2010).
5. Conclusiones
En el estudio se obtuvo un promedio general de 98% de enraizamiento, sin registrar diferencias significativas entre tratamientos. El uso de clones no reportó diferencias significativas en cuanto al enraizamiento y altura final de las plantas, pero sí en biomasa total.
Las plantas registraron mayor altura final y biomasa total promedio a los 15 días de permanencia en los túneles de enraizamiento. La competencia en altura entre las plantas fue mayor conforme aumentó el número de días en los enraizadores, con lo que aumenta el riesgo de reprimir el crecimiento de las plantas que lo hacen a menor ritmo.
Con el sistema de reproducción actual del vivero, los esquejes a los nueve días dentro de los túneles aún no producen raíces. El mayor incremento en cuanto al peso (g) en raíces se presentó entre los 12 y 15 días de enraizamiento con un 55,3%, periodo donde se formó mayor sistema radicular.
La variable diámetro fue significativa en la determinación del período óptimo de enraizamiento y es uno de los principales criterios a considerar en la selección de los esquejes; se identificó que esquejes con menor diámetro inicial, hasta 1,5 mm, tienen mayores posibilidades de enraizar que los de mayor diámetro.
Para lograr un adecuado enraizamiento de G. arborea se determina 15 días como el período óptimo de permanencia de los esquejes en los túneles, según las variables analizadas en el presente estudio. Este resultado sirve de referencia técnica para las actividades de propagación vegetativa que realizan los viveros de pequeña, mediana y gran escala dedicados a la producción de esta especie.
6. Agradecimientos
Los autores agradecen al proyecto Paquete tecnológico para la producción de material vegetal de alta calidad en el establecimiento de plantaciones forestales de manglillo (Aspidosperma spruceanum) y melina (Gmelina arborea) como un medio para fortalecer el desarrollo local en los Cantones de Osa y Golfito del Instituto de Investigación y Servicios Forestales de la Universidad Nacional (INISEFOR-UNA), por su apoyo en el financiamiento y logística de la presente investigación. Además, a la Revista y a los sujetos revisores expertos que con gran esfuerzo realizaron observaciones para enriquecer el presente trabajo.
7. Referencias
Alfenas, A., Zauza, E., Mafía, T. & Assis, T. (2004). Clonagem e doencas do eucalipto. Minas Gerais, Brasil: Editorial Viçosa, Universidade Federal de Viçosa.
Andrade, V., Santos, V., García, M., Rodríguez, R., Franciskievicz, D. & Dos Santos, J. (2013). Índice de área foliar em mudas clonais de Eucalyptus sp. En: Scientific Electronic Archives 2(1), 6-9.
Araya, E., Murillo, O., Aguilar, G. & Rocha, O. (2005). Relaciones genéticas en una colección de clones de Gmelina arborea (Roxb) reveladas con marcadores AFLP. Revista Forestal Mesoamericana Kurú, 2(6), 1-14.
Ávila, C. (٢٠١٥). Evaluación del crecimiento y calidad en clones de Gmelina arborea Roxb. a los dos años, en sitios planos del Pacífico Sur de Costa Rica (Tesis de licenciatura). Heredia, Costa Rica: Universidad Nacional de Costa Rica.
Ávila, C., Murillo, R., Murillo, O, y Sandoval, C. (٢٠١٥). Interacción genotipo sitio para dos conjuntos clonales de Gmelina arborea Roxb., en sitios planos del Pacífico Sur de Costa Rica. Revista Forestal Mesoamericana Kurú, 12(29), 1-14.
Bañon, S., Martínez, J., Fernández, A., Balanzategui, L. y Melgares, J. (2002). Influencia de la topófisis en el esquejado de Coriara myrtifolia. Sevilla, España: Primera Jornada Ibérica de Plantas Ornamentales. Recuperado de http://www.ocamurcia.es/Floricultura/topofisis.pdf
Caballero, F. (2011). Selección de modelos mediante criterios de información en análisis factorial. Aspectos teóricos y computacionales (Tesis doctoral). Granada, España: Universidad de Granada. Departamento de Estadística e I.O.
Chacón, P. y Murillo, O. (2005). Análisis comparativo de la producción de minijardines clonales hidropónicos y jardines clonales en tierra de melina (Gmelina arborea Roxb.). Revista Forestal Mesoamericana Kurú 2(6), 1-7.
Dvorak, W. (2004). World view of Gmelina arborea: Opportunities and challenges. New Forests 28(2), 111-126. doi: https://doi.org/10.1023/b:nefo.0000040940.32574.22
Ferreira, E., Alfenas, A., Goncalves, R., García, H., Cardoso, R. y Penchel, R. (2004). Determinação do tempo ótimo do enraizamento de miniestacas de clones de Eucalyptus spp. Revista Árvore, 28(2), 183-187. doi: https://doi.org/10.1590/s0100-67622004000200004
Fett-Neto, A., Fett, J., Vieira, L., Pasquali, G., Termignoni, R. y Ferreira, A. (2001). Distinct effects of auxin and light on adventitious root development in Eucalyptus saligna and Eucalyptus globules. Tree Physiology 21(7), 457-464. doi: https://doi.org/10.1093/treephys/21.7.457
Flores, E. (1994). La planta: Estructura y función. Cartago, Costa Rica: Editorial Tecnológica de Costa Rica.
Gárate, M. (2010). Técnicas de propagación por estacas. Ucayali, Perú: Universidad Nacional de Ucayali.
Hernández, W. y Salas, E. (2009). La inoculación con Glomus fasciculatum en el crecimiento de cuatro especies forestales en vivero y campo. Agronomía Costarricense 33(1), 17-30.
Indira, E. (2006). Provenance variations in Gmelina arborea with particular reference to tree form. Journal of Tropical Forest Science 18(1), 36-50.
Mesén, F. (1998). Enraizamiento de estacas juveniles de especies forestales: Uso de propagadores de sub-irrigación. Proyecto de Semillas Forestales-PROSEFOR. Serie Técnica. Manual Técnico No. 30. Turrialba, Costa Rica: CATIE.
Moraes, C., Fonseca, R. y Rui, M. (2014). Influencia das folhas no enraizamento de miniestacas de híbridos de eucalipto. Nucleus 11(1), 101-106. doi: https://doi.org/10.3738/1982.2278.995
Muñoz, L., Vargas, J., López, J. y Soto, M. (2009). Effect of cutting age and substrate temperature on rooting of Taxus globosa. New forests 38(2), 187-196.
Murillo, O. y Badilla, Y. (2005). Propagación vegetativa de la teca en Costa Rica. Cartago, Costa Rica: Instituto Tecnológico de Costa Rica.
Murillo, O. y Guevara, V. (2013). Estado y manejo sostenible de los recursos genéticos forestales. En Estado de los recursos genéticos forestales de Costa Rica (Capítulo IV, pp. 66-75). San José, Costa Rica: MINAET/FAO/CONAGEBIO.
Murrieta, C. (2010). Influencia del morfotipo, fitohormona y sustrato en la propagación de estacas juveniles de Cedrela odorata L. (Cedro colorado), en Pucallpa, Perú (Tesis de licenciatura). Pucallpa, Perú: Universidad Nacional de Ucayali.
Oficina Nacional Forestal. (2013). Usos y aportes de la madera en Costa Rica: Estadísticas 2013. San José, Costa Rica: Oficina Nacional Forestal.
R Core Team. (2014). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Recuperado de: http://www.R-project.org/
Rodríguez, S., Xavier, A., Silva, L., Amaral, L. y Rosado, A. (2011). Enraizamiento de miniestacas de clones híbridos de Eucalyptus globulus. Revista Árvore 35(3), 425-434. doi: https://doi.org/10.1590/S0100-67622011000300006
Rodríguez, R. (2010). Manual de prácticas de viveros forestales. Instituto de Ciencias Agropecuarias. Pachuca, México: Universidad Autónoma del Estado de Hidalgo. Recuperado de http://www.uaeh.edu.mx/investigacion/icap/LI_IntGenAmb/Rodri_Laguna/2.pdf
Rojas, F., Arias, D., Moya, R., Meza, A., Murillo, O. y Arguedas, M. (2004). Manual para productores de melina (Gmelina arborea) en Costa Rica: Botánica y ecología. Cartago, Costa Rica: Instituto Tecnológico de Costa Rica.
Rojas, F. y Murillo, O. (2004). Botánica y ecología. En Manual para productores de melina (Gmelina arborea) en Costa Rica. Cartago, Costa Rica: Instituto Tecnológico de Costa Rica.
Rojas, G., García, J. y Alarcón, M. (2004). Propagación asexual de plantas: Conceptos básicos y experiencias con especies amazónicas. Bogotá, DC, Colombia. Recuperado de: https://ecojardines.files.wordpress.com/2013/12/propagacinasexualdeplantas.pdf
Salas, R. (2012). Evaluación de un ensayo genético de Gmelina arborea en Siquirres, Limón (Tesis de licenciatura). Cartago, Costa Rica: Instituto Tecnológico de Costa Rica.
Vial, E., Baldini, A. y Duchens, L. (2013). Guía básica de buenas prácticas para plantaciones forestales de pequeños y medianos propietarios. Santiago, Chile. Corporación Nacional Forestal. Recuperado de http://www.conaf.cl/wp-content/files_mf/1386687876guiabuenaspracticas_ppf.pdf
Vinuesa, P. (2008). Máxima verosimilitud, estima de parámetros y selección de modelos. Universidad Autónoma de Nuevo León, Monterrey, México. Recuperado de: http://www.ccg.unam.mx/~vinuesa/Cursos_PDFs/Tema7_ML_estima_de_parametros_y_seleccion_de_modelos.pdf
Xavier, A., Wendling, A. y Da Silva, R. (2009). Silvicultura clonal: Princípios e técnicas. Viçosa, Brasil: Universidade Federal de Viçosa.

Revista de Ciencias Ambientales por Universidad Nacional de Costa Rica se distribuye bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Basada en una obra en http://www.revistas.una.ac.cr/ambientales.
Permisos que sobrepasen el ámbito de esta licencia, pueden ser consultados en revista.ambientales@una.cr