

Vol 19, No 37, Enero-Junio 2021 ISSN: 1409-3251 EISSN: 2215-5325

Emisiones de gases efecto invernadero (GEI) derivadas de dos tipos de fertilización del cultivo de piña (Ananas comosus) en ultisoles de Sarapiquí, Costa Rica tomando como referencia el bosque secundario Greenhouse gas (GHG) emissions derived from two types of fertilization of pineapple crops (Ananas comosus) in ultisols from Sarapiquí, Costa Rica, taking the secondary forest as reference
DOI: http://doi.org/10.15359/prne.19-37.3
Sofía Coto Brenes
Universidad Nacional, Costa Rica.
socobre5@gmail.com
ORCID: 0000-0002-2252-0045
Jorge Herrera Murillo
Universidad Nacional, Costa Rica.
jorge.herrera.murillo@una.ac.cr
ORCID: 0000-0003-4660-0178
Wagner Peña Cordero†
Universidad Estatal a Distancia, Costa Rica.
wpena@uned.ac.cr
ORCID: 0000-0002-4678-0503
Recibido: 31/05/2021 ![]() Aceptado: 22/06/2021
Aceptado: 22/06/2021 ![]() Publicado: 30/06/2021
Publicado: 30/06/2021
Dedicado a mi querido amigo y mentor Wagner Peña,
Agradecida eternamente por la oportunidad de haberte conocido y de compartir este viaje a través del conocimiento. Sofía Coto Brenes
Resumen
La producción del cultivo de la piña ha aumentado significativamente en el país en los últimos años y, por consiguiente, el uso de agroquímicos utilizados, ocasionando cambios físicos, químicos y biológicos en los suelos, además de la generación de emisiones de gases de efecto invernadero (GEI). En el presente trabajo se evaluaron las emisiones de GEI generados por dos tipos diferentes de fertilización del cultivo de piña en plantaciones con suelos ultisoles ubicados en Sarapiquí, Costa Rica. Para el análisis se delimitaron tres sitios (plantaciones con dos tipos de fertilización y un sitio de referencia = bosque secundario) mediante la definición de dos parcelas de 20 × 40 m, subdivididas en subparcelas de 20 × 20 m. Las muestras de gases se recolectaron por medio de dos técnicas: cámara estática y analizador de gases continuo (LGR), durante la época seca y época lluviosa en los años 2018 y 2019. Los flujos de CO2 medidos registraron una correlación positiva con el contenido de materia orgánica y la concentración de carbono en el suelo, la cual varió ligeramente entre las épocas. Los flujos de N2O variaron entre épocas, y resultaron mayores en la parcela con manejo orgánico durante la época lluviosa (11 a 161 mgm-2d-1) y el bosque secundario en época seca (3 a 76 mgm-2d-1). La fertilización convencional se caracterizó por generar suelos con menor cantidad de materia orgánica, carbono y humedad, disminuyendo la actividad microbiana, situación que produce mayores emisiones de GEI.
Palabras clave: mitigación, flujos de emisión, agricultura, piña, Sarapiquí.
Abstract
Pineapple production in Costa Rica increased significantly in the last years, impacting agrochemical usage, which cause greenhouse gas emissions, as well as physical, chemical, and biological changes in the soil. This project evaluates the GHG emissions generated by two different types of fertilization of pineapple crops in ultisol soils in Sarapiqui, Costa Rica. Samples were collected in three different locations delimited by two 20 x 40 m plots, which were also subdivided into two 20 x 20 m subplots. Gas samples were collected using two techniques: static chamber and continuous gas analyzer (LGR), during both dry and rainy seasons in 2018-2019. The measured CO2 fluxes registered a positive correlation with organic matter content and carbon concentration in the soil, which varied slightly between seasons. N2O fluxes also varied between seasons, with organic management registering higher data (11 to 161 mgm-2d-1) in the rainy season and the forest in the dry season (3 to 76 mgm-2d-1). Conventional fertilization was characterized by soils with less organic matter, carbon, and moisture, which reduces the microbial activity, a situation that produces higher GHG emissions.
Keywords: mitigation, emission fluxes, agriculture, pineapple crops, Sarapiquí.
Introducción
El cultivo de la piña es de importancia económica en el país debido a su alta demanda en los mercados internacionales. En el año 2018, ocupó el segundo lugar en la exportación total de productos del sector agrícola en Costa Rica, con un 34.9% del valor exportado para fruta fresca, y presentó un incremento del 1.9% con respecto al periodo anterior (SEPSA, 2020). De acuerdo con la herramienta de monitoreo de cambio de uso de la tierra en paisajes productivos vinculados a su tenencia (MOCCUP), en el país existen alrededor de 65 670 ha dedicadas al cultivo de piña (Sánchez, 2019). La principal región productora del país es la Huetar Norte, la cual concentra un 67.3% de la distribución regional del cultivo (44 193 ha). Los cantones de esta región donde existen mayores extensiones son: San Carlos, Los Chiles, Sarapiquí y Río Cuarto. De estos, Sarapiquí ocupa el tercer lugar en área sembrada de piña en Costa Rica, con 6 202.50 ha (Vargas, et al., 2020). El crecimiento del cultivo implica una mayor aplicación de sustancias químicas para proteger la fruta de plagas, mejorar su calidad y acelerar el proceso de crecimiento con el fin de cumplir con los estándares que exige el mercado internacional (Echeverría, et al., 2012). Según un estudio realizado por el Instituto Regional de Estudios en Sustancias Tóxicas de la Universidad Nacional (IRET, 2016), el cultivo de piña a nivel nacional utiliza en promedio 44 kg de agroquímicos por hectárea al año. Estas plantaciones consumen tanto fertilizantes nitrogenados (N) como potásicos (K2O). Por lo tanto, este monocultivo podría contribuir a la degradación ambiental, incluida la contaminación de las aguas superficiales y subterráneas por plaguicidas y nitratos, además de la emisión de gases de efecto invernadero (GEI). Esta situación ha ocasionado conflictos tanto sociales como ambientales, derivados de la contaminación de fuentes de agua y la exposición a plaguicidas de las comunidades cercanas (Valverde, et al., 2016).
La expansión y aumento de la superficie sembrada de un monocultivo influye en las emisiones de GEI, ya que algunas prácticas como la labranza, quema, y aplicación de fertilizantes afectan la producción de los gases, ya que el suelo cumple una función muy importante en la regulación de la composición gaseosa de la atmósfera por medio de los ciclos biogeoquímicos. De acuerdo con la FAO, la expansión de la agricultura industrial es responsable del 70-90% de la deforestación global y al menos la mitad de estos cultivos son de exportación, lo que significa que la contribución de la agricultura a la deforestación es responsable del 15-18% de las emisiones globales de GEI (Scherr, et al., 2012).
La concentración de GEI en la atmósfera ha aumentado considerablemente en las últimas cuatro décadas. Las emisiones antropogénicas de GEI totales en el periodo del 2000 al 2010 fueron las más altas en la historia de la humanidad y llegaron a 49 (± 4,5) GtCO2eq/año en el 2010. En la agricultura, los GEI que más se producen son el dióxido de carbono (CO2), el metano (CH4) y el óxido nitroso (N2O) (Schaufler et al., 2010). La formación de CO2 se atribuye al cambio de uso del suelo y al agotamiento de los depósitos de carbono en el mismo. El N2O, por su parte, se forma por variaciones en los procesos microbianos aerobios y anaerobios, debido a condiciones específicas del sitio (contenido de agua, aireación, contenido de nitrato y amonio, temperatura, disponibilidad de sustratos orgánicos y pH). En cuanto al metano, los suelos agrícolas con buenas condiciones de aireación pueden generar este gas durante determinados períodos, dependiendo de las concentraciones de materia orgánica y del grado de compactación (Parrado, 2015).
Históricamente, la piña se ha cultivado bajo dos patrones de fertilización: convencional y orgánico. El cultivo de piña convencional tiene la característica de tener aplicaciones programadas de fertilizantes y plaguicidas. En un ciclo de producción se llevan a cabo entre 10 y 15 series de aplicación de fertilizantes, de 2 a 3 en herbicidas, de 2 a 3 en insecticidas líquidos para la planta, y de 6 a 8 de insecticidas líquidos para la flor. Debido a que el cultivo convencional se ha caracterizado por sus efectos negativos en el ámbito social y ambiental, se requieren tecnologías alternativas para aprovechar la radiación solar, que permitan la acumulación de biomasa para estimular las interacciones benéficas entre plantas y microorganismos, además de propiciar los procesos de ciclaje y disponibilización de nutrientes presentes en la materia orgánica (Sánchez-Navarro, et al., 2019). Como respuesta a las necesidades anteriores, surge la agricultura orgánica, la cual tiende a disminuir el gasto económico en plaguicidas y fertilizantes sintéticos, ya que estos pueden ser sustituidos por bioplaguicidas y fertilizantes orgánicos. Asimismo, contribuye en la conservación del suelo ya que reduce la erosión, la pérdida de nutrimentos y la compactación. En el 2019, el valor de las exportaciones por concepto de piña certificada como “orgánica” fue de 13 697 millones de dólares mientras que el manejo convencional reportó 962 826 millones de dólares (SEPSA, 2020). La agricultura orgánica permite implementar una amplia gama de métodos para reducir las emisiones de GEI y mitigar el cambio climático. Diversos autores reportan que las emisiones de GEI de la agricultura orgánica resultan ser entre un 12-36% más bajas en comparación con la agricultura convencional (Niggli et al., 2009; Sarauskis et al., 2012).
En el presente trabajo de investigación, se evaluaron las emisiones de GEI generadas por dos tipos de fertilización en cultivos de piña: convencional y orgánico, estableciendo información base para la creación de posibles acciones de mitigación de GEI en el sector.
Materiales y métodos
Descripción del área de estudio
El experimento se desarrolló en el distrito Puerto Viejo de Sarapiquí. Esta región fue elegida por conveniencia debido a la cercanía de las fincas productoras con el Refugio de Vida Silvestre Lapa Verde. La zona de estudio se caracteriza por tener un promedio anual de precipitaciones de 4 000 mm. Registra una temperatura media de 26.1 °C, con una mínima de 20.7 °C y una máxima de 32.5 °C (datos de enero a diciembre del 2015) (Brenes, 2015). La zona tiene influencia de vientos alisios y por temporadas de depresiones tropicales y frentes fríos. Presenta elevaciones de 37 a 187 metros sobre el nivel del mar. Pertenece a la Zona de Vida de Holdridge (1967): bosque Muy Húmedo Tropical (bmh-T). El área de estudio posee una taxonomía de suelos tipo ultisol: suelos ácidos, de cristalinidad 1:1 caolinítico y de baja fertilidad con respecto a otros de la región. También presenta régimen de humedad údico y relieve casi plano (Mata, et al., 2013).
Selección de sitios de muestreo
En la presente investigación se seleccionaron dos fincas dedicadas al cultivo de piña; una con manejo convencional y otra orgánico; además, se incluyó un sitio de bosque ubicado cerca de las plantaciones, que funcionó como línea base para la realización de las comparaciones con un espacio sin afectación antropogénica significativa (Figura 1). En la Tabla 1 se muestran las características propias de los sitios de muestreo seleccionados para el presente estudio.
Tabla 1.
Características de los tres sitios de muestreo en Sarapiquí, Heredia
|
Convencional |
Orgánico |
Bosque |
|
|
Distrito |
Puerto Viejo |
||
|
Coordenadas |
10°30’ 31.2” N 84°08’ 38.4” O |
10°28’ 25.7” N 84°05’ 23.3” O |
10°30’ 15.7” N 84°07’ 27.9” O |
|
Extensión |
42 ha cultivadas |
78 ha cultivadas |
1039 ha bosque secundario |
|
Antecedentes |
Ganadería |
ganadería y cultivo de plantas ornamentales |
explotación forestal y ganadera |
|
Variedad de piña |
híbrida MD2 |
híbrida MD2 |
No aplica |
|
Certificaciones |
Global GAP |
Programa Orgánico Nacional de los Estados Unidos (NOP-USDA) y la certificación costarricense del Reglamento Nacional N° 29782 |
No aplica |
|
Frecuencia de aplicación de fertilizantes |
Cada 10 o 12 días, utilizando Spray Boom. |
Cada 15 días se aplican fertilizaciones a nivel foliar, utilizando Spray Boom y subsolador para el encamado |
No aplica |
Fuente: Elaboración propia, 2020.
Previamente al establecimiento de los ensayos se realizaron entrevistas para conocer el manejo ejecutado en cada una de las fincas, y se obtuvo la siguiente información: tipo y dosis de agroquímicos que se utilizan en los sistemas, la frecuencia de las aplicaciones, el período del cultivo, entre otros datos. Además, se recopiló información para identificar elementos que pudieran influir en los resultados, tales como la presencia de fuentes puntuales de emisiones de GEI cercanas (Tablas 2 y 3).
Figura 1.
Localización de los sitios de muestreo en las tres fincas en estudio, Sarapiquí, Heredia
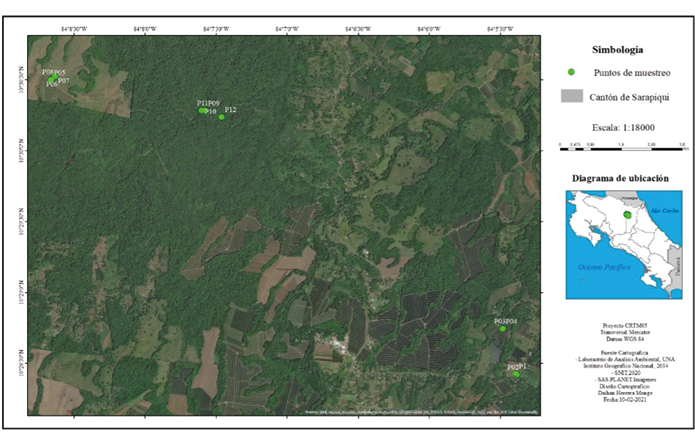
Fuente: Herrera, 2020
Tabla 2.
Información referente a la aplicación de fertilizantes y otros insumos al cultivo convencional de piña durante las campañas de medición (2018-2019).
|
Muestreo |
Número de semanas después de la siembra |
Días después de la fertilización |
Fórmula aplicada para fertilización foliar |
Dosis (kg/ha) |
|
1 |
16 |
8 |
Urea |
45 |
|
Nitrato de amonio |
90 |
|||
|
2 |
21 |
Sulfato de magnesio |
100 |
|
|
Fosfato monoamónico |
50 |
|||
|
3 |
37 |
Tricoderma harzianum |
1 |
|
|
Hierro |
25 |
|||
|
4 |
43 |
Sulfato de zinc |
5 |
Fuente: Elaboración propia, 2020.
Tabla 3.
Información referente a la aplicación de fertilizantes y otros insumos al cultivo orgánico de piña durante las campañas de medición (2018-2019).
|
Muestreo |
Número de semanas después de la siembra |
Días después de la última fertilización |
Fórmula aplicada |
Dosis (kg/ha) |
|
1 |
19 |
11 |
Bacillus thuringiensis |
1 |
|
Pinolene |
0.3 |
|||
|
2 |
24 |
18 |
Azufre |
10 |
|
Sulfato de magnesio |
50 |
|||
|
Potasio |
10 (l/ ha) |
|||
|
Multicompost |
150 |
|||
|
Pinolene |
0.3 |
|||
|
Extracto de ajo |
0.4 (l/ha) |
|||
|
Sulfato de cobre y cal hidratada |
1 |
|||
|
Borato doble de sodio y calcio |
6 |
|||
|
Bacillus thuringiensis |
1 |
|||
|
3 |
40 |
1 |
Bacillus thuringiensis |
1 |
|
Pinolene |
0.3 |
|||
|
4 |
46 |
36 |
Pinolene |
0.3 |
|
Bacillus thuringiensis |
1 |
|||
|
Co-polimero de Polyeter y Silicona heptametiltrisiloxano |
0.3 |
|||
|
Extracto de ajo |
0.4 (l/ha) |
Fuente: Elaboración propia, 2020.
Muestreo y análisis de suelos
El periodo de muestreo se inició en octubre del 2018 y finalizó en mayo del 2019. Para recolectar muestras se delimitaron los tres sitios de estudio mediante el establecimiento de dos parcelas de 20 × 40 m, subdivididas en dos subparcelas de 20 × 20 m para conformar una muestra compuesta (Figura 2). En cada subparcela se tomaron muestras en tres puntos y se recolectaron submuestras de 500 g de suelo a una profundidad de 20 cm, utilizando un barreno. Además, se tomaron dos muestras por cada sitio para determinación de densidad aparente con un cilindro muestreador.
Figura 2.
Esquema del diseño de muestreo utilizado en los tres tipos de manejo
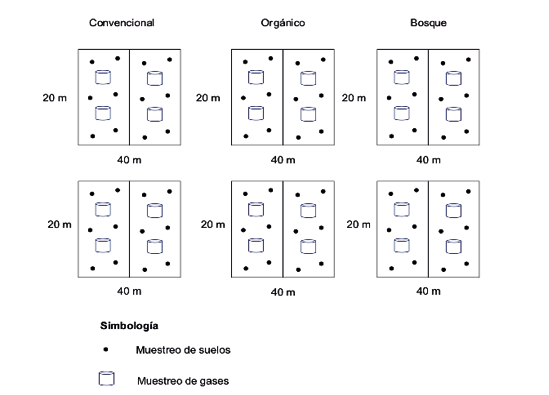
Fuente: Elaboración propia, 2020.
A cada una de las muestras colectadas se les ejecutaron análisis fisicoquímicos, con el fin de determinar las propiedades de los suelos. Las metodologías utilizadas para cada parámetro evaluado se incluyen en la Tabla 4.
Tabla 4.
Metodología empleada para el análisis fisicoquímico de las muestras de suelos
|
Propiedad |
Método |
|
Textura |
Método de Bouyoucos (Andrades, et al., 2015) |
|
Densidad aparente |
Metodología del cilindro de volumen conocido |
|
pH |
pH-metro en agua 1:25 |
|
K, Fe, Cu, Zn, P y Mn |
Extracción con Olsen modificado |
|
Acidez, Ca y Mg |
Extracción de cloruro de potasio (KCl) 1 M |
|
Porcentaje de materia orgánica, carbono orgánico y nitrógeno |
Método de Dumas digestión seca (Gregorio, et al., 2016). |
|
Respiración microbiana del suelo |
Sensor Vernier de CO2 |
Fuente: Elaboración propia, 2020.
Para determinar los procesos de mineralización, se relacionaron los valores de carbono total (MOS) y del C-CO2 emitidos por la actividad microbiana. Lo anterior se estableció relativamente (%) utilizando la siguiente ecuación:

Muestreo y medición de los flujos de CH4, N2O y CO2
En lo que respecta al muestreo de gases, para el CO2 se usó la cámara estática, la cual estaba conformada por un tubo de cloruro de polivinilo cilíndrico opaco con un diámetro medio de 36 cm y una altura efectiva de 50 cm. Adicionalmente, se equipó con un ventilador y un pequeño puerto de muestreo lateral para la toma de muestras. El procedimiento consistió en extraer el aire acumulado en el interior de la cámara utilizando una jeringa de 12 ml en distintos tiempos (0, 10, 20, 30 y 40 min). Las muestras se colocaron en un tubo al vacío de 10 ml y se transportaron al laboratorio para su análisis.
Por otra parte, para la medición de CH4 y N2O se empleó un analizador de gases de efecto invernadero marca Los Gatos Research (LGR), el cual utiliza la tecnología de cavidad integrada fuera del eje espectroscopía de salida (por sus siglas en inglés: OA-ICOS). En este equipo la bomba interna del analizador extrae el gas por el puerto de entrada, lo arrastra hasta llegar al filtro de 10 µm, antes de ingresar al controlador de presión, el cual determina la tasa de flujo. Luego, el gas viaja por la celda óptica y es expulsado por el escape interno de la bomba. Los datos son anotados in situ y visualizados por medio de la computadora interna con la que cuenta el equipo. Al igual que en el método con cámara estática, se registraron los datos a los 0, 10, 20, 30 y 40 min.
Para determinar el CO2 se utilizó el equipo CO2 meter Model CO250, marca EXTECH INSTRUMENTS. Este utiliza tecnología de sensor infrarrojo no dispersivo (NDIR, por sus siglas en inglés), el cual es sensible a la absorción de luz infrarroja de las moléculas de CO2 en el aire contenidas en su celda óptica (Arzoumanian, et al., 2019). Luego, por medio de la siguiente fórmula se determinó el flujo de cada gas en función del área y del tiempo:

Donde:
E= flujo de gas por unidad de área y tiempo
dx/dt = tasa de acumulación del gas en el aire dentro del cámara expresado en partes por millón por minuto
V= volumen del gas expresado en litros
A= área de la cámara en m2
M= masa de N por cada mol N2O o si es el caso de CH4o CO2, masa de C por cada mol
Vm= Volumen molecular del gas, se calcula con la ecuación de los gases ideales
Análisis estadístico
La normalidad de los datos de flujos de CO2, N2O y CH4 se analizó mediante la aplicación de la prueba de normalidad Anderson-Darling. Además, se realizó un análisis de varianza (ANOVA) para determinar la variación temporal de los flujos entre campañas de muestreo, y entre los diferentes tratamientos agrícolas. Finalmente, se identificaron las posibles correlaciones entre las variables medidas por medio de correlaciones de Pearson (Martínez, et al., 2009). Para el análisis estadístico se utilizó el software MINITAB STATISTICAL 19.
Resultados y discusión
Propiedades de los suelos
Los valores promedio de textura registrados para los tres sitios (Tabla 5) resultaron no ser significativamente diferentes entre sí a un nivel de significancia del 5%, lo anterior debido probablemente, a la cercanía relativa entre estos y a que son suelos pertenecientes a un mismo orden. En cuanto a densidad aparente, el bosque secundario presenta los menores niveles y, por ende, un mayor porcentaje de retención de humedad.
Tabla 5.
Características generales de los suelos presentes en los tres sitios de monitoreo.
|
Parámetro |
Unidades |
Manejo de los sistemas |
**Niveles críticos medios del contenido de nutrimentos |
||
|
Convencional |
Orgánico |
Bosque |
|||
|
Número de muestras |
16 |
16 |
16 |
||
|
Textura |
-- |
A |
FA, A |
A |
-- |
|
Densidad Aparente |
gcm-3 |
1.2 (0.3) |
1.2 (0.3) |
1.0 (0.1) |
-- |
|
Humedad |
% |
49.7 (12.4) |
51.3 (11.9) |
68.8 (9.4) |
-- |
|
pH |
-- |
4.4 (0.1) |
4.4 (0.3) |
4.1 (0.2) |
6.0-7.0 |
|
K |
cmol(+)l-1 |
0.22 (0.03) |
0.32 (0.06) |
0.25 (0.08) |
0.5-0.8 |
|
Ca |
0.5 (0.5) |
0.1 (0.5) |
0.3 (0.2) |
6.0-15.0 |
|
|
Mg |
0.1 (0.1) |
0.2 (0.1) |
0.2 (0.4) |
3.0-6.0 |
|
|
Acidez |
1.9 (0.6) |
2.2 (0.9) |
3.6 (0.4) |
<0.3 |
|
|
Saturación Acidez |
% |
67.4 (10.4) |
57.7 (14.1) |
83.3 (4.4) |
<10.0 |
|
P |
mg∙l-1 |
1.5 (0.6) |
2.0 (1.4) |
5.5 (1.7) |
20.0-50.0 |
|
Fe |
84.5 (36.3) |
102.0 (35.0) |
26.3 (2.6) |
10.0-50.0 |
|
|
Cu |
13.0 (1.6) |
15.8 (1.6) |
15.8 (7.3) |
1.0-20.0 |
|
|
Zn |
3.0 (1.0) |
3.1 (1.0) |
2.4 (0.7) |
3.0-10.0 |
|
|
Mn |
10.7 (26.7) |
28.6 (28.0) |
7.9 (2.2) |
10.0-50.0 |
|
|
MO |
% |
3.4 (1.9) |
5.4 (1.1) |
5.9 (1.7) |
5.0-10.0 |
|
C |
% |
2.5 (1.2) |
3.8 (0.7) |
4.1 (0.8) |
1-3 |
|
N |
% |
0.2 (0.1) |
0.3 (0.0) |
0.3 (0.1) |
0.5-0.8 |
|
C/N |
-- |
11.9 (1.8) |
12.2 (1.3) |
12.5 (1.3) |
10-12 |
|
CICE |
cmol(+)l-1 |
2.8 (0.8) |
3.6 (0.9) |
4.3 (1.7) |
5-12 |
|
Ca/Mg |
-- |
3.5 (0.3) |
5.4 (0.6) |
1.7 (0.1) |
2.0-5.0 |
|
Ca/K |
-- |
2.2 (0.2) |
3.4 (0.5) |
1.5 (0.1) |
50.0-25.0 |
|
Mg/K |
-- |
0.6 (0.1) |
0.6 (0.1) |
0.9 (0.1) |
2.5-15.0 |
|
Ca+Mg//K |
-- |
1.1 (0.2) |
1.6 (0.4) |
1.2 (0.1) |
10.0-40.0 |
Nota: El valor en paréntesis corresponde a la desviación estándar de los datos
**Referencia de los niveles críticos medios del contenido de nutrimentos para fertilización (Bertsch, 1995 y Peña., 2017).
A: arcillosa, F: franca., CICE: capacidad de intercambio catiónico efectivo; el valor entre paréntesis corresponde a la desviación estándar.
En general, los valores obtenidos de pH son bajos en los tres manejos; por lo tanto, son suelos muy ácidos. Además, los niveles de calcio y magnesio están por debajo de los valores óptimos, es decir, que existe un desbalance evidente en los tres manejos. En este punto es importante considerar también el tipo de suelo que se está analizando, ya que los tres suelos son altamente meteorizados. Los ultisoles se caracterizan por ser suelos viejos; se encuentran en lugares muy húmedos, lo que provoca que se laven las bases (sodio, potasio, calcio y magnesio). Tienen alto contenido de aluminio extraíble y son bajos en calcio; de ahí su nivel de acidez. Además, son suelos de texturas finas a muy finas y su alto contenido de arcillas facilita una buena estructura y un drenaje interno óptimo (INTA, 2014). Asimismo, la saturación de acidez suele superar el 50 %, lo que limita el aprovechamiento de elementos esenciales, como N, P K, y mejora la disponibilidad de microelementos o metales pesados, como Cu y Fe. Por tanto, el contenido de materia orgánica es muy bajo, y un aumento de esta posiblemente provoque acumulación y una degradación del medio, por la poca capacidad de mineralización del sustrato orgánico; es decir, la actividad microbiana se ve afectada y, por consiguiente, el sustrato dependerá del manejo y la cobertura.
Además, el estudio muestra las relaciones catiónicas en valores de desbalance entre cationes, con excepción de Ca/Mg. La relación C/N se califica como media, es decir, hay un suministro normal de nutrimentos al suelo por la descomposición de la materia orgánica. Otro dato relevante del estudio es que, en época lluviosa, se observa un alto equilibrio metabólico en los manejos más equilibrados (orgánico y bosque). Pero durante la época seca, es notoria una mayor mineralización en bosque con respecto a los otros sistemas de manejo (Figura 3), posiblemente debido a la mayor retención de humedad y al ciclaje de nutrimentos que se presentan en este ecosistema.
Figura 3.
Variación estacional del índice de mineralización de los suelos para los tres sitios de monitoreo.
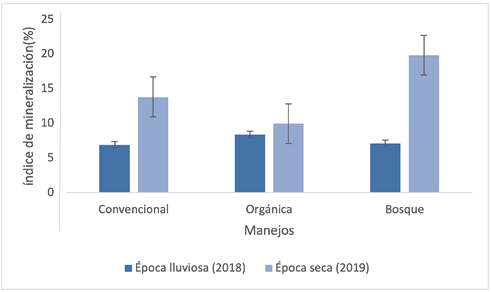
Fuente: Elaboración propia, 2020.
La mineralización en el sistema convencional resultó ligeramente superior en época seca que, para el tratamiento orgánico, lo cual se puede deber al estrés microbiano, que genera mayor cantidad de CO2 por unidad de área.
Finalmente, el porcentaje de carbono orgánico en los dos manejos agrícolas fue muy similar durante la época lluviosa y seca. Este comportamiento se explica, como se mencionó, por la aplicación de abonos y materia orgánica (Figura 4). El bosque no es comparable, por ser un sistema equilibrado.
Figura 4.
Variación estacional del contenido de carbono orgánico para los suelos de los tres sitios de muestreo
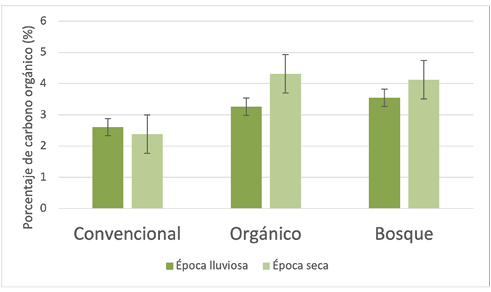
Fuente: Elaboración propia, 2020.
Medición de flujos de CH4, N2O y CO2
Al analizar la distribución de los datos obtenidos para cada uno de los GEI por medio de la prueba Anderson-Darling, se infiere que los flujos de CO2y N2O siguen una distribución normal, con un nivel de significancia de 5% para todas las campañas de muestreo en los distintos manejos agrícolas y de bosque secundario. En el caso del CH4, no se realizó la prueba, dado que la mayoría de los datos se encuentran por debajo del límite de detección (4 mgm-2d-1). En la tabla 6 se observan los promedios de los flujos obtenidos durante las campañas de muestreo, con su respectiva desviación estándar. La dispersión de los datos puede ser atribuida a las variaciones de los parámetros meteorológicos y las propiedades del suelo durante el ciclo de siembra, además de la variabilidad propia del sistema de medición.
Los flujos de emisión de CO2 medidos en los suelos del bosque secundario resultaron ser mayores con un nivel de significancia del 5%, seguidos del manejo orgánico y los más bajos se registraron en el manejo convencional. El contenido de C en el suelo, que es la principal fuente de energía para los microorganismos del suelo que contribuyen a las emisiones de este gas, también mostró la misma tendencia (bosque secundario>manejo orgánico>manejo convencional). Tal como se indicó en la sección anterior, el suelo del bosque secundario resulto ser más ácido, además de poseer una menor densidad aparente, una relación C:N y una concentración de C más alta en comparación con los restantes manejos. Los resultados obtenidos son coincidentes con lo reportado por Arellano (2017), quien determinó que el flujo de CO2en pastizales, humedales y zonas de cultivo es menor al de los bosques.
Tabla 6.
Valores promedio (±DE) de flujos de emisión para CO2, N2O y CH4durante las campañas de muestreo en dos sistemas productivos de piña (fertilización química y orgánica) y un bosque secundario.
|
CO2 (mgm-2d-1) |
|||
|
Manejos |
Convencional |
Orgánico |
Bosque |
|
Nov. 2018 |
187 (80) |
718 (13) |
735 (495) |
|
Dic. 2018 |
165 (28) |
281 (165) |
737 (356) |
|
Mar. 2019 |
251 (189) |
369 (307) |
851 (647) |
|
May. 2019 |
280 (144) |
428 (272) |
956 (237) |
|
N2O (mgm-2d-1) |
|||
|
Nov. 2018 |
24 (19) |
161 (99) |
76 (79) |
|
Dic. 2018 |
5 (8) |
137 (89) |
38 (25) |
|
Mar. 2019 |
3 (5) |
11 (4) |
3 (3) |
|
May. 2019 |
27 (32) |
23 (34) |
59 (44) |
|
CH4 (mgm-2d-1) |
|||
|
Nov. 2018 |
ND |
ND |
ND |
|
Dic. 2018 |
ND |
9 (4) |
ND |
|
Mar. 2019 |
ND |
10 (3) |
ND |
|
May. 2019 |
18 (2) |
ND |
ND |
Nota: ND: no detectable. Elaboración propia, 2020
El comportamiento de los flujos de CO2 se puede deber al tipo de suelo, la cantidad de materia orgánica, la concentración de C, N, P y las condiciones de humedad en el suelo. La combinación de respiraciones autótrofas y heterótrofas en el suelo del bosque secundario probablemente podría explicar los mayores flujos de CO2. Lo anterior también explica por qué el manejo orgánico obtuvo valores de flujos de CO2 superiores al convencional, ya que la concentración de P (2.0 mg∙l-1), C (3.8 %), N (0.3 %) y el porcentaje de humedad (51.3%) mostraron valores superiores debido al uso de abonos con alto contenido de materia orgánica, pues tanto la respiración heterótrofa y autótrofa podrían haber sido estimuladas por la adición de compost orgánico incrementando el suministro de C lábil a los microorganismos del suelo, elevando la actividad microbiana y consecuentemente aumentando la tasa de respiración del suelo (Guerrero-Ortiz, et al., 2012).
Las medias de los flujos de CO2 obtenidas para cada una de las campañas de muestreo no resultaron ser significativamente diferentes entre sí (p > 0.05). Esto se puede deber a que el C es el factor más influyente en el comportamiento de los flujos de CO2 y durante la investigación, este parámetro mostró una tendencia muy similar en los muestreos realizados tanto en la época seca como la lluviosa.
Los flujos de N2O registraron valores mayores para el manejo orgánico en todas las campañas de muestreo, debido al hecho de que los desechos orgánicos suelen ser ricos en carbono y nitrógeno, y su adición aumenta el contenido de C lábil del suelo y acelera la actividad de los microorganismos del suelo, así como las tasas de nitrificación y desnitrificación (Jones et al., 2005).
A diferencia de los patrones observados para las emisiones de CO2, los flujos de N2O presentaron variaciones significativas entre las medias para cada campaña. En esta investigación, el N2O resultó ser más sensible a los cambios en la temperatura y a las condiciones climáticas (nivel de precipitaciones). Lo anterior se explica porque la producción de N2O depende de la nitrificación y desnitrificación, y este último proceso ocurre bajo condiciones anaerobias (Berger, et al., 2013). Por lo general, durante la época lluviosa se presenta un aumento del flujo de N2O atribuido a un incremento de la actividad microbiana y, por lo tanto, a una descomposición más rápida de los residuos vegetales facilitada por un aumento de la humedad del suelo, lo que eleva la disponibilidad de N. Además, según Signor y Cerri (2013), la humedad del suelo afecta la difusión del gas del suelo, la disponibilidad de oxígeno (O2) y el movimiento del sustrato necesario para el crecimiento y metabolismo microbiano.
Específicamente en cuanto a los flujos de N2O en el manejo orgánico, se observa que durante la época lluviosa se produjo un crecimiento diferenciador. El acolchado plástico (que se utiliza para disminuir el crecimiento de maleza y, por ende, evitar el uso de herbicidas) puede haber influido en este proceso. Muchas investigaciones han evidenciado que el uso de una cobertura de plástico incrementa la temperatura y mejora la dinámica del agua en el suelo (Berger, et al., 2013). Lo anterior, en conjunto con un alto contenido de nitrógeno inorgánico, materia orgánica y baja concentración de oxígeno en el suelo, puede facilitar la producción de N2O en algunos suelos cubiertos. Además, según Uriza (2011), el acolchado plástico fomenta la formación de nitratos, cuyo proceso está asociado a la emisión de N2O a la atmósfera.
Unido a lo anterior, los flujos de N2O provenientes de suelos cultivados pueden aumentar tanto por la aplicación de fertilizantes como por fuertes lluvias. Esto explica los altos valores de N2O durante la época lluviosa, sumado a los ya mencionados (manejo orgánico y acolchado plástico).
En síntesis, el manejo orgánico obtuvo los datos más altos de flujos de N2O. A la vez, los flujos de los tres manejos fueron significativamente diferentes en las campañas realizadas en la época lluviosa con respecto a la seca. El manejo orgánico alcanzó los flujos de N2O más altos durante la época lluviosa, mientras que el bosque obtuvo la concentración más alta de N2O durante la época seca. Este aumento de N2O en el manejo orgánico se relaciona con la aplicación de fertilizantes orgánicos en ese período.
Los flujos de emisión de CH4 resultaron ser no detectables para cada uno de los tres manejos. En el caso del bosque es conocido que sus suelos funcionan más como un sumidero neto. Los altos niveles de humedad en los suelos puede ser una variable limitante para la metanogénesis, que necesita condiciones anóxicas durante un cierto período hasta que se establezcan las arqueas metanogénicas (Serrano-Silva, et al., 2014). Tanto en los manejos orgánicos como convencionales, la labranza continua interfiere con la estructura del suelo, afectando así el microambiente que favorece a los metanótrofos (Jacinthe, et al., 2014).
Correlación entre variables
Al realizar el análisis de Pearson, se puede observar que la materia orgánica tuvo una correlación positiva significativa con los flujos de CO2 (Tabla 7). La relación entre los flujos de este gas y la materia orgánica obedece a los procesos de descomposición, a través de la respiración metabólica de la comunidad de microorganismos, así como el aumento en la concentración de C, tal y como fue el comportamiento de los flujos durante los muestreos. De igual forma se presenta una correlación positiva débil con la acidez y la humedad del suelo, factores que también afectan la actividad microbiana que influye en los procesos de descomposición tanto de los residuos añadidos al suelo como del material humificado (Arellano, 2017).
Tabla 7.
Correlaciones de Pearson entre las propiedades del suelo y los flujos de CO2
|
Variable |
Flujos de CO2 Correlación |
|
pH |
0.152 (0.091) |
|
Densidad aparente |
0.175 (0.413) |
|
Acidez |
0.369 (0.076) |
|
Humedad |
0.349 (0.094) |
|
Materia orgánica |
0.558 (0.005) |
|
Carbono orgánico |
0.197 (0.357) |
|
Fósforo |
0.214 (0.316) |
Nota: **El valor entre paréntesis corresponde al valor de p. Elaboración propia, 2020
La densidad aparente tuvo una correlación negativa con los flujos de N2O generados en el bosque secundario y en el manejo convencional (Tabla 8). Es decir, cuando la densidad aparente es baja, los flujos de N2O aumentan. Ante esta relación, Klefoth, et al. (2014), mencionan que una baja densidad aparente implica suelos porosos y buena aireación, lo que favorece la difusión de los gases y la retención de agua en los porosos del suelo. El contenido de materia orgánica del suelo no parece ser un factor principal que afecte los flujos de emisión de N2O. Por otra parte, el pH mostró una correlación negativa débil con respecto a los flujos de emisión que se puede explicar por la correlación negativa de este parámetro con la relación N2O/(N2+N2O). Resulta rescatable el rol de la humedad del suelo en la generación del óxido nitroso, ya que es bien conocido que valores elevados de este parámetro generan condiciones de anaerobiosis que favorecen la desnitrificación y por lo tanto una mayor emisión de N2O (Mora, et al., 2005). Este efecto se percibe con mayor fuerza en los suelos del bosque secundario donde se registran los mayores valores de humedad.
Por otro lado, el contenido de P tuvo una correlación positiva fuerte entre los flujos de N2O en el bosque y moderada en el caso de los manejos convencional y orgánico. Lo que coincide con lo reportado por Mori, et al. (2017) y Mori, et al. (2013), ya que la adición de P aumenta las emisiones de N2O, lo que sugiere que P estimula el ciclo de N, activando las bacterias nitrificantes y/o desnitrificantes y estimulando el consumo de O2 por actividades heterotróficas, lo que ocasiona una condición más reductiva adecuada para el proceso de desnitrificación.
Tabla 8.
Correlaciones de Pearson entre las propiedades del suelo y los flujos de N2O
|
Variables |
Flujos de N2O |
||
|
Convencional |
Orgánico |
Bosque |
|
|
pH |
-0.456 (0.713) |
-0.419 (0.301) |
-0.224 (0.954) |
|
Densidad aparente |
-0.275 (0.509) |
0.076 (0.233) |
-0.667 (0.071) |
|
Acidez |
-0.024 (0.955) |
0.167 (0.693) |
-0.524 (0.183) |
|
Humedad |
0.115 (0.787) |
0.323 (0.271) |
0.444 (0.435) |
|
Materia orgánica |
-0.108 (0.799) |
-0.071 (0.867) |
-0.357 (0.385) |
|
Carbono orgánico |
0.314 (0.449) |
-0.074 (0.861) |
-0.206 (0.624) |
|
Fósforo |
0.338 (0.928) |
0.396 (0.933) |
0.549 (0.159) |
Nota: **El valor entre paréntesis corresponde al valor de p. Elaboración propia, 2020
Conclusiones
A partir de los resultados obtenidos se puede concluir que los flujos de emisión de cada uno de los gases evaluados presentan un comportamiento diferenciado, tanto en su variación temporal como en la definición de las variables de influencia asociadas a las características del suelo. De esta forma los flujos de CO2 mostraron una relación directa con la concentración de C orgánico en los suelos, el cual no varió durante las campañas de medición propiciando que los flujos no presentaran cambios significativos entre épocas del año. Los mayores flujos de este gas se registraron en el bosque secundario debido probablemente a una mayor actividad microbiana, provocada por sus altos contenidos de materia orgánica, humedad, N y P, en comparación con los manejos agrícolas del cultivo de piña. Por su parte, los flujos de N2O si registraron variaciones entre épocas, por lo que se concluye que las condiciones climáticas, como los cambios de temperatura y la humedad influyen en la generación de este gas. Además, por los datos obtenidos durante la época lluviosa en el manejo orgánico, se infiere que el uso de acolchado plástico ocasiona microclimas que favorece la actividad microbiana provocando mayores flujos. Para este gas, la humedad del suelo, el pH y su contenido de P resultaron ser las variables determinantes de los flujos de emisión.
El manejo convencional se caracterizó por tener menor cantidad de humedad, materia y carbono orgánicos, lo que disminuye la actividad microbiana y genera mayores emisiones de GEI. Además, el índice de mineralización indicó un mayor desequilibrio entre la época seca y la época lluviosa en el manejo convencional, debido al manejo de suelos labrados y al uso de productos químicos. No obstante, para el estudio de GEI, es necesario realizar un monitoreo más prolongado con el fin de aumentar la representatividad en los datos y así poder validar las correlaciones encontradas con las propiedades del suelo, el manejo y las condiciones climáticas. Lo anterior debido a las variaciones temporales y espaciales del suelo, a su complejidad y a la diversidad de microorganismos que lo habitan.
Referencias
Arellano-Martín, F. (2017). Flujo de CO2 del suelo en una selva mediana subcaducifolia de Yucatán, México. Tesis de Maestría. Centro de Investigación Científica de Yucatán, CICY. Yucatán, México. 6 p.
Andrades, M., Moliner, A. y Masaguer, A. (2015). Prácticas de Edafología: métodos didácticos para análisis de suelos. España, Universidad de la Rioja. 25 p.
Arzoumanian, E., Vogel, F. R., Bastos, A., Gaynullin, B., Laurent, O., Ramonet, M., y Ciais, P. (2019). Characterization of a commercial lower-cost medium-precision non-dispersive infrared sensor for atmospheric CO2 monitoring in urban areas. Atmospheric Measurement Techniques, 12 (5), 2665-2677.
Berger, S., Kim, Y., Kettering, J., y Gebauer, G. (2013). Plastic mulching in agriculture—Friend or foe of N2O emissions. Agriculture, Ecosystems & Environment, 167, 43-51.
Bertsch, F. (1995). La fertilidad de los suelos y su manejo. Asociación Costarricense de la Ciencia del Suelo. San José, C.R. 157 p.
Brenes, L. (2015). Composición florística y estructura horizontal de dos fragmentos de bosque tropical con características distintas en el Refugio de Vida Silvestre Lapa Verde, Puerto Viejo, Sarapiquí (Licenciatura en Manejo de Recursos Naturales). Universidad Estatal a Distancia. 23 p.
Choo, L. N. L. K., y Ahmed, O. (2017). Nitrous Oxide Emission of a Tropical Peat Soil Grown with Pineapple at Saratok, Malaysia. Sustainable Agriculture Research, 6 (3), 75 p.
Choo, L. N.L.K, y Ahmed, O. H. (2014). Partitioning Carbon Dioxide Emission and Assessing Dissolved Organic Carbon Leaching of a Drained Peatland Cultivated with Pineapple at Saratok, Malaysia. The Scientific World Journal; Hindawi.
Echeverría, S.; Mena, F.; Pinnock, M; Ruepert, C.; Solano, K.; De la Cruz, E.; Campos, B.; Sánchez, J.; Lacorte, S. y Barata, C. (2012). Environmental hazards of pesticides from pineapple crop production in the Río Jiménez watershed. Science of the total environmental. 440: 106-114.
FAO. (2014). Anuario Estadístico de la FAO. Santiago, Chile: Organización de las Naciones Unidas para la Agricultura y la Alimentación. 140 p.
Guerrero-Ortiz, P., Quintero-Lizaola, R., Espinoza-Hernández, V., Benedicto-Valdés, G. y Sánchez-Colín, M. (2012). Respiración de CO2 como indicador de la actividad microbiana de abonos orgánicos de Luínus. Terra Latinoamericana. 30 (4): 355–362.
Gregorio, J., Lanza, P., Churión, C., y Gómez, N. (2016). Comparación entre el método Kjeldahl tradicional y el método Dumas automatizado (N cube) para la determinación de 33 proteínas en distintas clases de alimentos. Revista Multidisciplinaria del Consejo de Investigación de la Universidad de Oriente, 28 (2): 245-249.
INTA. (2014). Boletín Técnico 1 Suelos de Costa Rica: Orden Ultisol. Instituto Nacional de Innovación y Transferencia en Tecnología Agropecuaria. Plataforma de Tecnología, Información y Comunicación Agropecuaria y Rural. (en línea) Costa Rica. Consultado el 3 marzo 2020. http://www.platicar.go.cr/images/buscador/documents/pdf/07/00517-boletin-suelos-de-cr.pdf
IRET. (2016). Highly Hazardous Pesticides phase out and alternatives in Costa Rica. Universidad Nacional. (en línea) Costa Rica. Consultado el 3 marzo 2020. Disponible en https://www.pan-uk.org/site/wp-content/uploads/HHP-Phase-Out-and-Alternatives-in-Costa-Rica-Project-Intro.pdf
Jacinthe, P., Dick, W., Lal, R., Shrestha, R., Bilen, S. (2014). Effects of No-till Duration on the Methane Oxidation Capacity of Alfisols. Biological Fertilization Soils, 50, 477–486, https://doi.org/10.1007/s00374-013-0866-7.
Jones, S., Rees, R., Skiba, U., Ball, B. (2005).Greenhouse gas emissions from a managed grassland Global Planet Change, 47 , 201-211
Klefoth, R., Clough, T., Oenema, O., y Van Groenigen, J. W. (2014). Soil Bulk Density and Moisture Content Influence Relative Gas Diffusivity and the Reduction of Nitrogen-15 Nitrous Oxide. Vadose Zone Journal, 13 (11).
Martínez, R., Pendás, L., C, L., Martínez, M., Pérez, A., y Cánovas, A. (2009). El coeficiente de correlación de los rangos de Spearman caracterización. Revista Habanera de Ciencias Médicas, 8 (2).
Mata, R.; Rosales, A.; Vasquez, A. y DAngelo, S. (2013). Mapa de suelos de Costa Rica según Soil Taxonomy USDA (en línea) Costa Rica. Consultado el 3 marzo 2020. Disponible en http://www.mag.go.cr/bibliotecavirtual/av-1630.pdf
Mora, S., Sandoval, M., Gavi, F., Sánchez, P. (2005). Emisión de N2O con fertilización nitrogenada en fertirriego y fertilización convencional. Revista Internacional de Contaminación Ambiental, 21(1), 23-29.
Mori, T., Ohta, S., Ishizuka, S., Konda, R., Wicaksono, A., Heriyanto, J., Hamotani, Y., Gobara, Y., Kawabata, C., Kuwashima, K., Nakayama, Y., y Hardjono, A. (2013). Soil greenhouse gas fluxes and C stocks as affected by phosphorus addition in a newly established Acacia mangium plantation in Indonesia. Forest Ecology and Management, 310, 643-651.
Mori, T., Wachrinrat, C., Staporn, D., Meunpong, P., Suebsai, W., Matsubara, K., Boonsri, K., Lumban, W., Kuawong, M., Phukdee, T., Srifai, J., y Boonman, K. (2017). Effects of phosphorus addition on nitrogen cycle and fluxes of N2O and CH4 in tropical tree plantation soils in Thailand. Agriculture and Natural Resources, 51(2), 91-95.
Niggli, U., Fließbach, A., Hepperly, P., Scialabba, N. (2009). Low greenhouse gas agriculture: mitigation and adaptation potential of sustainable farming systems. Ökologie & Landbau, 141, 32-33.
Parrado, C. (2015). Flujos de gases efecto invernadero y lixiviación de nutrientes en agroecosistemas de rosas de corte en la Sabana de Bogotá. Tesis Doc. Bogotá, Colombia, Universidad Nacional de Colombia. 1 p.
Peña, W. (2017). Edafología del trópico. San José, Costa Rica: EUNED. 25 p.
Sánchez, B. (2019). Deuda piñera: Costa Rica continúa sin medir impacto en la salud de las comunidades contaminadas (en línea). Consultado el 3 marzo 2020. https://delfino.cr/2019/11/deuda-pinera-costa-rica-continua-sin-medir-impacto-en-la-salud-de-las-comunidades-contaminadas
Sánchez-Navarro, V., Zornoza, R., Faz, A., Fernández, J. (2020). A comparative greenhouse gas emissions study of legume and non-legume crops grown using organic and conventional fertilizers. Scientia Horticulturae, 260, 108902.
Sarauskis, E., Buragiene, S., Romaneckas, K., Sakalauskas, A., Jasinskas, E., Vaiciukevicius, D. (2012). Working time, fuel consumption and economic analysis of different tillage and sowing systems in Lithuania. Engineering for Rural Development Proceedings of 11th International Scientific Conference on Engineering for Rural Development. Jelgava, Latvia,11, 52-59.
Schaufler, G., Kitzler, B. Schindlbacher, A. Skiba, U., Sutton, M. y Zechmeister-Boltenstern, S. (2010). Greenhouse gas emissions from European soils under different land use: effects of soil moisture and temperature. European Journal of Soil Science. 61 (5): 683-696.
Scherr, S., Shames, S., Friedman, R. (2012). From climate-smart agriculture to climate-smart landscapes. Agriculture and Food Security. 1, 12.
Secretaría Ejecutiva de Planificación Sectorial Agropecuaria [SEPSA]. (2020). Informe Comercio Exterior del Sector Agropecuario 2017-2018 (en línea). Consultado el 3 marzo 2020. http://www.sepsa.go.cr/docs/2019-004Comercio_Exterior_Sector_Agropecuario_2017-2018.pdf
Serrano-Silva, N., Sarria-Guzmán, Y., Dendooven, L., Luna-Guido, M. (2014). Methanogenesis and Methanotrophy in Soil: A Review, Pedosphere, 24, 291–307, https://doi.org/10.1016/S1002-0160(14)60016-3..
Signor, D., y Cerri, C. E. (2013). Nitrous oxide emissions in agricultural soils: A review. Pesquisa Agropecuaria Tropical, 43: 322-338.
Uriza, D. (2011). Paquete tecnológico piña MD2. Centro de Investigación Regional Golfo Centro. Campo Experimental Cotaxtla. Veracruz, México.
Valverde, K., Porras, M. y Jiménez, A. (2016). Nuevos estudios sobre el impacto ambiental de la actividad piñera. Contribución especial realizada para el Vigésimo segundo Informe Estado de la Nación. San José, Costa Rica. Estado de la Nación. 238 p.
Vargas, C., Miller, C. y Arguedas, C. (2020). Informe: monitoreo del estado de la piña en Costa Rica para el año 2018. Informe técnico presentado al PNUD dentro del marco del MOCUPP. (en línea) Consultado el 3 marzo 2020. http://repositorio.conare.ac.cr/handle/20.500.12337/7892
World Meteorological Organization (WMO). (2009). Construcción de Comunidades Resilientes a las Inundaciones en la Región de Sarapiquí. Costa Rica. (en línea) Consultado el 3 marzo 2020. https://www.wmo.int/pages/prog/drr/projects/CostaRica/Documents/CostaRicaProject_esp.pdf
AEmisiones de gases efecto invernadero (GEI) derivadas de dos tipos de fertilización del cultivo de piña …
Sofía Coto Brenes, Jorge Herrera Murillo y Wagner Peña Cordero

Revista Perspectivas Rurales. Nueva Época se encuentra bajo una licencia Creative Commons Reconocimiento-NoComercial-CompartirIgual 4.0 Internacional License.
Creado a partir de la obra en http://www.revistas.una.ac.cr/index.php/perspectivasrurales