
ISSN: 1659-455X • e-ISSN: 1659-407X. Vol. 11 (1), enero-junio 2019.
Recibido: 16 julio 2018 • Corregido: 21 noviembre 2018 • Aceptado: 18 enero 2019
DOI: http://dx.doi.org/10.15359/revmar.11-1.1
Concentración y tiempo máximo de exposición de juveniles de pargo manchado Lutjanus guttatus al eugenol Syzygium aromaticum
Concentration and maximum exposure time of Lutjanus guttatus juveniles to Syzygium aromaticum eugenol
Jonathan Chacón-Guzmán1, 2*, Milagro Carvajal-Oses1, 2, Silvia Pauletto3 y
Ángel Herrera-Ulloa1
|
RESUMEN Se definieron las dosis más eficientes de aceite de eugenol Syzygium aromaticum para la sedación quirúrgica en juveniles de pargo manchado (Lutjanus guttatus) y se determinó el tiempo mínimo de exposición de no retorno, como una fuente de información para contar con un rango de tiempo seguro en la manipulación del pez durante labores de rutina. En el Laboratorio de Acuicultura y Biotecnología Marina del Parque Marino del Pacífico en el Golfo de Nicoya, se seleccionaron 76 juveniles de pargo manchado, producidos en enero del 2016, con un peso promedio 21.61± 2.0 g. Los juveniles fueron expuestos a concentraciones de eugenol 25, 100, 175 y 250 mg/L en tanques de 30 L, se vigiló los estados de inducción a la anestesia y su recuperación. Definida la dosis más eficiente, se procedió con ella a determinar el tiempo máximo de exposición; para este estudio se definieron cuatro tiempos de inducción en 4, 8, 12 y 16 min., y se establecieron 10 min., como umbral de recuperación. Se determinó que el eugenol es eficaz para la anestesia de juveniles de pargo con temperaturas entre 24.0 y 24.8°C. La concentración de 25 mg/L fue suficiente para la inducción parcial de los peces, apropiado para realizar actividades rutinarias menos complejas en el manejo de pargos, mientras que la concentración más eficiente fue de 100 mg/L, en tiempos de exposición no mayor a 8 minutos luego de la anestesia total. Palabras clave: Lutjanus guttatus, anestésico, eugenol, dosis eficiente, tiempo de no retorno ABSTRACT The most efficient doses of eugenol oil from Syzygium aromaticum for surgical sedation in Lutjanus guttatus juveniles were defined, and the minimum exposure time of no return was determined as a source of information to have a safe time range when handling fish during routine work. A total of 76 juveniles produced in January 2016 with an average weight of 21.61 ± 2.0 g were selected at the Aquaculture and Marine Biotechnology Laboratory of the Marino del Pacífico Park (Gulf of Nicoya). Juveniles were exposed to 25, 100, 175, and 250 mg/L eugenol concentrations in 30 L tanks, and their induction of anesthesia and recovery were monitored. Once the most efficient dose was defined, the maximum exposure time was determined. Four times of induction were defined for this study: 4, 8, 12, and 16 min, and the recovery threshold was established at 10 min. Eugenol was determined to be an effective anesthetic for rose snapper juveniles with temperatures ranging between 24.0 and 24.8°C. The 25 mg/L concentration was sufficient for partial induction of fish and appropriate to perform less complex routine activities in the handling of snappers, while the most efficient concentration was 100 mg/L, with exposure times no greater than 8 minutes after total anesthesia. Keywords: Lutjanus guttatus, anesthetic, eugenol oil, efficient dose, time of no return |
INTRODUCCIÓN
El pargo manchado Lutjanus guttatus (Steindachner, 1869) ha sido desde los años noventa una especie de mucho interés para la piscicultura marina en América Latina tropical, ya que se distribuye en el océano Pacífico, desde México hasta Perú y por presentar una demanda atractiva en los Estados Unidos (Fischer et al. 1995; Herrera-Ulloa et al. 2009). En Costa Rica su reproducción natural y espontánea permitió la masificación en la producción de juveniles en cautiverio en el año 2005, lo que permitió el cultivo con fines comerciales en granjas marinas desde el año 2006 (Herrera-Ulloa et al. 2009; Chacón-Guzmán, 2010).
En varios países, se han desarrollado investigaciones dirigidas a conocer y controlar diferentes aspectos de su ciclo de vida en cautiverio (Abdo-de la Parra et al. 2015). En Costa Rica la producción en granjas marinas alcanzó las 528 toneladas métricas en el año 2016 (Barrantes-Elizondo et al. 2016). Este incremento ha hecho necesario que se optimicen los protocolos en todas las etapas del proceso productivo, especialmente aquellos que representen un riesgo para la salud de los peces. En el manejo de juveniles ha sido esencial aplicar medidas de manipulación eficientes que eviten lesiones, estrés, enfermedades y mortalidad. En este contexto, los anestésicos son una forma indispensable de tratamiento; sin embargo, el desconocimiento de las dosis adecuadas, tiempos de exposición y efectos en la salud de los peces podrían generar pérdidas económicas.
En la producción de peces se ha acostumbrado utilizar técnicas de anestesia para los trabajos rutinarios como: captura, muestreos, inducción hormonal y transporte; siendo los más empleados benzocaína, quinaldina, metanosulfonato de tricaína (MS222©) e isoeugenol (Aqui-S©) (García-Gómez et al. 2002). No obstante, se han considerado de alto costo y con cierto grado de toxicidad asociada (Coyle et al. 2004; Roubach et al. 2005; Velísek et al. 2006).
El aceite de eugenol [2-methoxy-4-2-(2-propenyl)-phenol], se obtiene de segmentos de hojas, tallos, flores, y brotes de varias especies de árboles (Eugenia caryophyllata y Eugenia aromatica) (Soto & Burhanuddin, 1995). Se ha convertido en uno de los productos de mayor uso para anestesiar en la industria piscícola, ya que es económico, ambientalmente amigable, y seguro para los acuicultores y los peces (Iversen et al. 2003; Cunha & Rosa, 2006; Roo et al. 2014; Cárdenas et al. 2016). Se utiliza por medio de baños de inmersión en los peces donde es absorbido por piel y branquias (Javahery et al. 2012). Según la US Food and Drug Administration, este aceite es considerado como seguro para el humano cuando su concentración no supera los 1 500 mg/kg (Anderson et al. 1997). Roubach et al. (2005) considera que como las dosis utilizadas en acuicultura no superan las concentraciones tóxicas para el ser humano, debe considerarse seguro para ser utilizado en acuicultura. Javahery et al. (2012), lo recomienda para usos comerciales y de acuicultura ya que no causan efectos negativos a los cuerpos de agua, ni al ser humano y puede ser fácilmente manipulable por personas sin alto grado de preparación técnica.
En peces marinos, García-Gómez et al. (2002), probaron la eficacia del eugenol como anestésico y obtuvieron resultados positivos a dosis de 40 ppm en organismos de seriola (Seriola dumerili), lubina (Dicentrarchus labrax), dorada (Sparus aurata), dentón (Dentex dentex) y sargo picudo (Diplodus puntazzo); en dichos experimentos se logró la anestesia total de los peces en 3-6 minutos y su recuperación en 2-5 minutos, y no se observó en ellos ningún efecto negativo. En el pargo (Lutjanus synagris), Souza et al. (2015) aplicaron el eugenol en larvas, juveniles y adultos. Los resultados mostraron que cuanto mayor fue la concentración de eugenol utilizado, menor fue el tiempo necesario para llegar a cada etapa de anestesia. En esta especie, el tiempo total para la inducción de la anestesia fue menos de tres minutos y la mejor concentración de 50 mg/L para todos los estados biológicos de los peces analizados. El tiempo de recuperación a esta concentración fue de 120.7±36.3 seg., 78.95±16.52 seg., 103.33±22.09 seg., para larvas, juveniles y adultos, respectivamente.
Otro aspecto necesario de conocer es su toxicidad. En el cultivo de peces, se debe saber la concentración ideal para su uso apropiado, ya que concentraciones erróneas conducen a efectos indeseados en el organismo de los peces como es en el caso del cortisol, un corticosteroide para la regulación metabólica, que en presencia de eugenol podría aumentar su concentración y con él componentes hematológicos como lactato, glucosa y potasio (Grush et al. 2004; Javahery et al. 2012) lo que podría generar mortalidad (Roubach et al. 2001). Autores como Hoskones & Pirhonen (2004) afirman que los peces, sometidos repetidamente al eugenol, pueden tener un efecto negativo en su crecimiento y ser afectados en su fisiología (Park et al.2008). Barata et al. (2016) hallaron que el uso de eugenol en la perca regia (Argyrosomus regius) puede generar grados de estrés que se podrían ver reflejados de manera negativa en la calidad de la carne.
Se ha encontrado que la toxicidad del eugenol puede estar relacionada con el daño que ocasiona al sistema respiratorio (Din, 2006; Guénette et al. 2007); en peces limnéticos se ha descrito una CL50 entre 14 y 60 mg/L (Marín-Méndez et al. 2012); en peces marinos se han realizado ensayos en juveniles de cobia (Rachycentron canadum) donde se determinó una concentración letal de 60 mg/L (Gullian & Villanueva, 2009), por lo que según Marín-Méndez et al. (2012) el uso del eugenol en peces requiere investigaciones que validen su utilización en la acuicultura.
El aceite de eugenol ha sido empleado con éxito en la reproducción y producción de juveniles de L. guttatus en Costa Rica (Chacón-Guzmán, 2010), sin embargo, no se han realizado investigaciones formales para la definición del procedimiento idóneo.
Este trabajo tuvo como objetivo definir la dosis más eficiente para la sedación quirúrgica de juveniles de pargo manchado y con esta, determinar el tiempo mínimo de exposición de no retorno, que permita al acuicultor contar con un rango de tiempo seguro para realizar las actividades rutinarias de manipulación de los peces.
MATERIALES Y MÉTODOS
La investigación se realizó durante los meses de septiembre y octubre del año 2017, en el Laboratorio de Acuicultura y Biotecnología Marina del Parque Marino del Pacífico (PMP), Puntarenas, Costa Rica.
Se seleccionaron 76 peces juveniles sanos de pargo manchado L. guttatus, producidos en el laboratorio, con un peso promedio de 21.61± 2.0 g. Previamente a la investigación, los peces permanecieron aclimatados en tanques circulares de 10 m3 de fibra de vidrio, con recirculación de agua marina y alimentados ad libitum con alimento fresco (sardina, atún, camarón y calamar). Los juveniles se dejaron de alimentar 24 horas antes de la exposición al anestésico.
Se utilizó aceite de eugenol al 100% de pureza. El aceite se diluyó con etanol (99.9%) en una relación 1:9. Para desestimar cualquier efecto del etanol (99.9%) utilizado como diluyente del aceite de eugenol, se expusieron por diez minutos seis juveniles de pargo a la concentración más alta de etanol que se utilizaría en los tratamientos (41.4 ml/20L). Las condiciones experimentales fueron las mismas descritas para la exposición al anestésico. No se observó ningún efecto o cambio visible en el comportamiento de los juveniles con la exposición al etanol.
La exposición de los peces al aceite de eugenol para la inducción y al agua para su recuperación, se realizó en tanques de fibra de vidrio circulares transparentes de 30 L. En la recuperación para cada pez se procedió a cambiar completamente el agua para evitar residuos del producto, dejados por el pez anterior.
Para definir la concentración más eficiente para la sedación total de juveniles de pargo manchado se establecieron cuatro tratamientos con 25, 100, 175 y 250 mg/L de aceite de eugenol (las cuales fueron diluidas en el etanol antes de ser agregadas a los tanques). Estas cantidades fueron elegidas de acuerdo a la experiencia de trece años adquirida en el PMP en la aplicación de anestesia a juveniles de pargo manchado. Posteriormente, se realizó su respectiva dilución con etanol. La solución fue aplicada en el agua dos minutos antes de la inmersión del primer pez. En cada una de las dosis evaluadas se anestesiaron seis peces por tanque consecutivamente. Las etapas de anestesia y recuperación (Cuadro 1) se determinaron de acuerdo a ensayos previos (Walsh & Pease, 2002; Woody et al. 2002; Cunha & Rosa, 2006) y con base en la experiencia práctica en su aplicación en juveniles de esta especie en el PMP.
Cuadro 1. Estados de inducción a la anestesia y recuperación aplicados a juveniles (peso promedio= 21.61±2g) de L. guttatus
Table 1. States of induction of anesthesia and recovery applied to L. guttatus juveniles (mean weight = 21.61 ± 2g)
|
Estados |
Inducción |
|
I |
Pérdida total del eje de nado (sedación parcial) |
|
II |
Pérdida total de movimiento corporal con movimiento continuo de opérculo |
|
III |
Pérdida de movimiento corporal y del opérculo (sedación quirúrgica) |
|
Recuperación |
|
|
IV |
Recuperación del movimiento continuo del opérculo |
|
V |
Recuperación de la actividad corporal |
|
VI |
Recuperación de la línea de nado |
Cuando se alcanzó la fase de inducción última, se procedió a esperar dos minutos manteniendo los peces sedados dentro del agua (tiempo de trabajo, TT, establecido como promedio para desempeñar tareas rutinarias o de manejo con los juveniles completamente sedados). Cumplidos los dos minutos los juveniles fueron trasferidos a los tanques con agua limpia, para evaluar su retorno al estado natural.
Se evaluó el efecto del eugenol en cada pez para facilitar la observación de los estados de anestesia y recuperación.
Para definir el tiempo máximo de no retorno, se utilizó la dosis del tratamiento con mejores resultados en la primera etapa. Para este estudio se definieron cuatro tiempos de inducción 4, 8, 12 y 16 minutos. Estos fueron elegidos por pruebas previas en las cuales se determinó que en cada uno ocurrían cambios visibles en el comportamiento del pez. Además, se partió de datos obtenidos de otros autores (Summerfelt & Smith, 1990) que reportaron sedaciones a partir de 4 minutos. Se establecieron 10 minutos como umbral de recuperación; al considerar que en la práctica el tiempo debe ser menor a este valor para la eficiencia del manejo de la producción. El tiempo fue medido con un cronómetro digital.
Se determinaron los estados de inducción y recuperación (Cuadro 2) por medio de ensayos previos y con base al método para definir la dosis idónea en la primera etapa de este estudio.
Cuadro 2. Estado de inducción a la anestesia, recuperación y de no retorno aplicados a los juveniles (peso promedio= 21.61±2g) de L. guttatus con el tratamiento de mayor eficiencia
Table 2. State of induction of anesthesia, recovery and no return applied to L. guttatus juveniles (mean weight = 21.61 ± 2g) with the most efficient treatment
|
Inducción |
I |
Pérdida de movimiento corporal y del opérculo |
|
Recuperación |
II |
Recuperación del movimiento continuo del opérculo |
|
III |
Recuperación del movimiento corporal |
|
|
IV |
Recuperación total del eje de nado |
|
|
V |
Inactividad Total (no retorno) |
Para cada tratamiento se determinó la salinidad (g/L) con un refractómetro de luz Red Sea RS7945, el oxígeno disuelto (mg/L) y la temperatura (°C) con un Oxigenómetro HANNA HI9146 y el pH con un pHmetro HANNA pHEP4.
Por medio del programa InfoStat (Di Rienzo et al. 2008) se analizaron los datos obtenidos de las mediciones ambientales, se determinaron diferencias significativas entre los tiempos de inducción, recuperación y total, así como, en los periodos que inciden o no, al no retorno. Los resultados se contabilizaron en segundos. Para todos los análisis estadísticos se verificó la normalidad utilizando el test de Shapiro-Wilk y posteriormente, se analizó la homocedasticidad de la varianza al utilizar el test de Levene. Verificados estos dos criterios se empleó el análisis de varianza y la prueba de Tukey.
Los tratamientos realizados a los peces en la presente investigación se desarrollaron con base en las normas éticas establecidas por las pautas de uso de peces en investigación (UFR Committee, 2013).
RESULTADOS
El tratamiento de 25 mg/L fue insuficiente para que todos los peces alcanzaran el estado III, anestesiándolos parcialmente (2 organismos alcanzaron la sedación completa y 4 solo hasta el tiempo II). A pesar de que el tiempo de inducción fue menor en 250 mg/L, su tiempo de recuperación fue mayor respecto a las demás concentraciones. El tratamiento de 100 mg/L fue el que presentó un menor tiempo en completar el proceso (Cuadro 3 y Fig. 1).
Cuadro 3. Tiempo de inducción, recuperación y total promedio del procedimiento de anestesia con diferentes dosis de aceite de eugenol en juveniles (peso promedio= 21.61±2g) de L. guttatus
Table 3. Time of induction, recovery, and total average of the anesthesia procedure with different doses of eugenol oil in L. guttatus juveniles (mean weight=21.61±2g)
|
Tratamientos |
|
T1 |
T2 |
T3 |
T4 |
|
Dosis mg/L |
25 * |
100 |
175 |
250 |
|
|
Peso promedio (g) |
21.97±0.90 |
21.61±0.75 |
21.60±1.25 |
22.01±1.12 |
|
|
Temperatura (°C) |
24.0 |
24.0 |
23.8 |
23.9 |
|
|
Oxígeno (ppm) |
6.7 |
6.8 |
6.6 |
6.4 |
|
|
pH |
|
8.0 |
7.8 |
8.1 |
8.1 |
|
Tiempo de inducción en segundos |
I |
78±0.15 |
41±0.07a |
38±0.17a |
27±0.07a |
|
II |
175±0.29 |
64±0.13a |
67±0.17a |
56±0.14a |
|
|
III |
201±0.11 |
77±0.20a |
80±0.17a |
72±0.17a |
|
|
Tiempo de trabajo (seg.) |
TT |
120 |
120 |
120 |
120 |
|
Tiempo de recuperación en segundos |
IV |
18±0.04 |
52±0.15a |
108±0.28ab |
136±0.72b |
|
V |
53±0.38 |
121±0.22a |
211±0.44b |
254±0.44b |
|
|
VI |
146±0.26 |
197±0.17a |
296±0.37b |
345±0.30c |
|
|
TOTAL (Seg.) |
347** |
274** |
376** |
417** |
|
|
TOTAL (+TT Seg.) |
467 |
394 |
496 |
537 |
* En dosis de 25 mg/L solo cuatro peces llegaron al estadio II y V, y solo dos peces llegaron al estadio III y IV.
* At a 25 mg / L dose only four fish reached stage II and V and two reached stage III and IV.
** Los tiempos totales son acumulativos (se suma el tiempo de inducción total III más el total de recuperación VI).
** Total intervals are cumulative (total induction time III plus total recovery VI).
a,b,c indican diferencias significativas (P≤0.05) entre las filas.
a,b,c indicate significant differences (P≤0.05) between rows.
El tratamiento de 25 mg/L no se tomó en cuenta para el análisis debido a que no todos los peces alcanzaron la sedación.
The 25 mg/L treatment was not taken into account in the analysis because not all fish reached sedation.
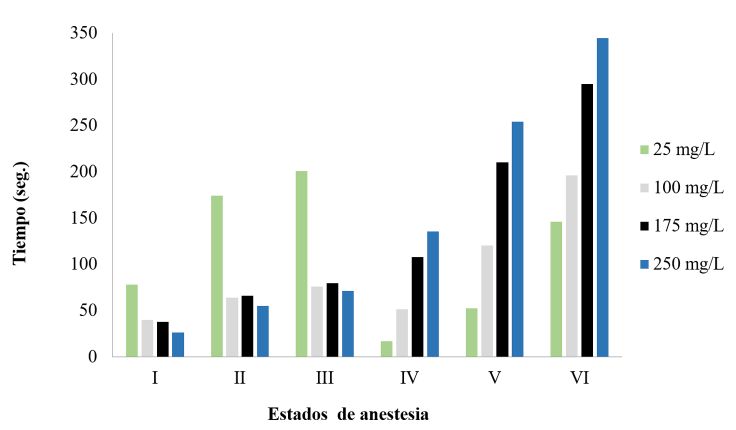
Fig. 1. Tiempos de anestesia y recuperación en juveniles (peso promedio= 21.61±2g) de L. guttatus expuestos a cuatro dosis de aceite de eugenol
Fig. 1. Anesthesia and recovery times in L. guttatus juveniles (mean weight=21.61±2g) exposed to four doses of eugenol oil
No se encontraron diferencias significativas (P ≥ 0.05) entre el tiempo de inducción en los peces de los tratamientos 250, 100 y 175 mg/L. Sin embargo, sí existieron (P ≤ 0.05) en los tiempos de recuperación ya que los peces en 100 mg/L se recuperaron con mayor rapidez. Además, en 100 mg/L igualmente existieron diferencias (P ≤ 0.05) respecto a la eficiencia del proceso, por lo cual esta representó la mejor opción para anestesiar juveniles de pargo manchado procediendo a la siguiente etapa del estudio.
En la evaluación de la exposición de los juveniles en cuatro tiempos con la dosis de 100 mg/L, se pudo determinar que sí hay retorno con 8 minutos de sedación quirúrgica y 75 segundos de inducción a esta. A partir de los 12 minutos se presentó una mortalidad del 50% y a los 16 minutos el 100% (Cuadro 4).
Cuadro 4. Estado de inducción a la anestesia, recuperación y no retorno aplicados a los juveniles (peso promedio= 21.61±2g) de L. guttatus con una dosis de 100 mg/L
Table 4. State of induction of anesthesia, recovery and no return applied to L. guttatus juveniles (mean weight = 21.61 ± 2g) with a dose of 100 mg / L
|
Tratamientos |
T1 |
T2 |
T3 |
T4 |
|
|
Dosis (mg/L) |
100 |
100 |
100 |
100 |
|
|
Tiempo de anestesia total (min) |
4 |
8 |
12 * |
16 * |
|
|
Temperatura (°C) |
24.9 |
24.8 |
24.4 |
25.1 |
|
|
Oxígeno (ppm) |
6.6 |
6.7 |
6.6 |
6.7 |
|
|
pH |
7.4 |
7.6 |
7.8 |
7.4 |
|
|
Tiempo de inducción (Seg.) |
I |
58±27a |
75±16a |
67±08 |
74±25 |
|
Tiempo de recuperación (Seg.) |
II |
61±25a |
117±38a |
278±97 |
0 |
|
III |
130±21a |
201±64b |
389±25 |
0 |
|
|
IV |
211±26a |
290±120a |
480±9 |
0 |
|
|
V |
R ** |
R** |
NR** |
NR** |
|
|
Sobrevivencia (%) |
100 |
100 |
50 |
0 |
|
|
Tiempo de inducción más tiempo de recuperación más tiempo de anestesia total |
TOTAL (Seg.) |
509 |
845 |
1 267 |
NA*** |
* Letras distintas en los superíndices indican diferencias significativas (P ≤ 0.05) entre las filas. Solo se tomó T1 y T2 debido a que en los otros tratamientos existió mortalidad.
* Different superscript letters indicate significant differences (P ≤ 0.05) between the rows. Only T1 and T2 were taken because there was mortality in the other treatments.
** R = Recuperación; NR = No Recuperación.
** R = Recovery; NR = No Recovery.
*** NA = No aplica por no obtener un tiempo de recuperación.
*** NA = Not applicable because recovery time is not available.
Entre los 4 y 8 minutos de exposición al aceite de eugenol no se presentaron diferencias significativas (P ≥ 0.05), por lo que se puede asumir que el tiempo máximo de exposición a una dosis de 100 g/L, para actividades rutinarias de manejo con juveniles de pargo manchado, no debe sobrepasar los 8 minutos a partir de la sedación.
Las variables físicas químicas no presentaron diferencias significativas entre los tratamientos (P ≥ 0.05) y se mantuvieron entre los valores normales de la época para la zona.
DISCUSIÓN
A pesar de que el eugenol, desde hace siglos se considera seguro, por ser empleado como analgésico y local en humanos y como aditivo alimentario; en peces podría tener efectos no deseados si se aplica una concentración incorrecta o a una exposición prolongada (Grush et al. 2004; Javahery et al. 2012; Zahl et al. 2012; Cárdenas et al. 2016). En salmónidos, por ejemplo, se ha encontrado que bajas concentraciones de este compuesto pueden ser tóxicas (Hussein et al. 2000), por ello las dosis no pueden ser consideradas estándar para todas las especies. Se deben realizar, obligatoriamente, estudios para definir las concentraciones idóneas de cada especie y cuál es el tiempo máximo de exposición a estas sin causarles la muerte (Cho &Heath, 2000; Barata et al. 2016).
A pesar de que su aplicación es común, Prashar et al. (2006), advierten que el aceite de eugenol puede ocasionar quemaduras en la piel cuando se aplica directamente y en altas dosis sobre los tejidos blandos, por ello González-Escobar (2002) recomienda en acuicultura su dilución en etanol o como último recurso, su agitación vigorosa en el agua, para disminuir el tamaño de las gotas que puedan depositarse en las branquias y causar severos daños. En este estudio se determinó que las concentraciones de etanol empleadas no ejercieron ningún efecto visible en el comportamiento de los juveniles de pargo manchado. Bajo un procedimiento similar, Mylonas et al. (2005) expusieron un grupo de 10 peces de lubina (Dicentrarchus labrax) y dorada (Sparus aurata) a concentraciones de etanol y no encontraron efectos negativos significativos sobre esas especies. Sin embargo, al seguir el precepto de que todas las especies no son iguales, para otras se recomienda hacer la prueba de exposición previa al etanol, para asegurar que este no influirá en los resultados de anestesia.
El eugenol demostró, utilizando dosis de 25 mg/L, ser efectivo para lograr sedación parcial (solo dos peces alcanzaron la sedación total, Cuadro 3), y quirúrgica, a partir de los 100 mg/L de juveniles de L. guttatus. Resultados similares fueron encontrados por Millán-Ocampo et al. (2012), quienes obtuvieron una ligera anestesia con la aplicación de una concentración de 20 mg/L de eugenol en peces escalares (Pterophyllum scalare), dosis que les permitiría realizar procedimientos menos complejos. Otros autores como Mylonas et al. (2005), han reportado anestesias parciales con dosis de 30 mg/L en lubina (Dicentrarchus labrax).
Se ha observado que la inducción de anestesia con dosis bajas y tiempo de exposición prolongado puede resultar también en tiempos de recuperación prolongados (Sladky et al. 2001; Cooke et al. 2004) e incluso la muerte pues Barata et al. (2016), quienes analizaron el efecto del eugenol sobre perca regia (Argyrosomus regius) hallaron que las mayores mortalidades se identificaron en las concentraciones más bajas del anestésico, a las 2 horas. Sin embargo, otros autores (Taylor & Roberts, 1999; Prince & Powell, 2000; Woody et al. 2002; Webber et al. 2009) han encontrado entre sus resultados que concentraciones más altas en exposiciones más cortas generan tiempos de recuperación menores.
Este fenómeno ha sido explicado por Mylonas et al. (2005), quienes obtuvieron tiempos de recuperación más cortos en dosis más altas de eugenol aplicadas en la lubina europea (Dicentrarchus labrax) y la dorada (Sparus aurata). Asumen, que dosis más altas inducen más rápido el estado de anestesia, por lo que el tiempo de exposición al aceite de eugenol es menor que en los peces expuestos a dosis más bajas. El aceite de eugenol es altamente lipofílico, penetra rápidamente el epitelio branquial, llega a la sangre y de ahí es absorbido por los tejidos del cuerpo, como la grasa y cerebro (Javahery et al. 2012), por lo que cuanto menor sea el tiempo de exposición en el baño de anestesia, será menor la cantidad de anestésico absorbido por el cuerpo, y cuanto más rápido se traslade el pez al agua limpia más rápida será la eliminación de la sangre y por ende, su recuperación. Resulta importante recalcar que el grado de sedación con eugenol puede variar de acuerdo a la temperatura del agua con que se esté desarrollando la investigación (Cup et al. 2014). Otros factores que pueden influenciar en menor grado son el pH, la salinidad o dureza del agua (Perry & Gilmour, 2006).
En este trabajo no se presentaron diferencias significativas (P ≥ 0.05) entre los periodos de inducción con las tres dosis que sí lograron llevar a los juveniles a estados de anestésico III, lo que infiere que el aumento de la dosis por arriba de los 100 mg/L no necesariamente aumentará la velocidad de inducción a la anestesia en juveniles de L. guttatus, pero si aumentará el tiempo de recuperación debido a que en este sí se presentaron diferencias significativas (P ≤ 0.05) entre las concentraciones de 100, 175 y 250 mg/L; con un tiempo más prologado en 250 mg/L. Si relacionamos los resultados de este estudio con los encontrados por Mylonas et al. (2005) nos lleva a sugerir que la diferencia entre ambos se da en que los tiempos de exposición a la inducción en este estudio fueron prácticamente iguales, por lo que en estas circunstancias de inducción la concentración sí influye en el tiempo de recuperación.
Se han establecido varios rangos de tiempo considerados como eficientes para la anestesia en peces (inducción y recuperación), por ejemplo, Park et al. (2003) y Oliveira et al. (2008) recomiendan una inducción en un periodo menor o igual a tres minutos y una recuperación del nado normal en un periodo no mayor a 10 minutos en el bacalao japonés (Hexagrammos otakii) y tilapia del nilo (Oreochromis niloticus); mientras que Roubach et al. (2001) una inducción entre uno y tres minutos y la recuperación menor a cinco minutos en la yaturana (Brycon cephalus). Bajo estos parámetros y a pesar que los juveniles de pargo permanecieron dos minutos en estado de anestésico antes de trasladarlos a la fase de recuperación, se puede concluir que la concentración de 100 mg/L aplicada en este estudio es altamente eficiente, al obtener un tiempo total de inducción de un minuto y diecisiete segundos y recuperación de tres minutos y diecisiete segundos para un periodo total de cuatro minutos y treinta y cuatro segundos.
Otros estudios han llegado a la inducción quirúrgica con dosis similares en tiempos menores a los cinco minutos, entre los que se pueden mencionar la perca regia (Argyrosomus regius) a 80 mg/L (Barata et al. 2016), Salmon atlántico y Salmo salar a 100 mg/L (Iversen et al. 2003); pez gato o americano (Ictalurus punctatus) a 100 mg/L (Small, 2003), anguila de aleta larga (Anguilla reinhardtii) a 100 mg/L (Walsh & Pease, 2002) y pez conejo (Siganus lineatus) a 50-100 mg/L (Soto & Burhanuddin, 1995). Aunque la mayoría de estudios han demostrado que se puede llegar a la inducción quirúrgica en dosis menores, por ejemplo Cunha & Rosa (2006) reportaron concentraciones de 20 a 60 mg/L de aceite de eugenol efectivas para anestesiar peces de arrecife tropical, con periodos de inducción menores a dos minutos y tiempos de recuperación de dos a cuatro minutos, mientras que García-Gómez et al. (2002), lograron anestesiar en un periodo de 3 a 6 minutos y recuperar en 2-5 minutos ejemplares de especies como Seriola dumerili, Dicentrarchus labrax, Sparus aurata, Dentex dentex y Diplodus puntazzo.
El tiempo es un factor importante en todas las actividades operativas en la industria acuícola, en especial a gran escala, por ello con base en los resultados obtenidos en este estudio se considera conveniente una inducción que no supere los dos minutos y una recuperación menor a los cuatro minutos; así como, realizar el mismo estudio con dosis entre 25 y 100 mg/L, debido a la probabilidad de que exista una dosis con iguales o mejores resultados que la de 100 mg/L, que permita una menor dosis de anestésico y por ende, un menor costo económico. La disminución de la dosis evitará el incurrir en gastos económicos innecesarios, ya que los anestésicos son costosos y excesivas dosis aumentarán los costos operativos (Roubach et al. 2005).
Se ha demostrado que pueden darse episodios de mortalidad en peces con el empleo de aceite de eugenol si el tiempo de exposición supera el margen de seguridad (Sladky et al. 2001). En el cultivo de pargo manchado, como en otros peces marinos (Mylonas et al. 2005), muy pocas veces se anestesia individualmente, por lo general, esta práctica se realiza solamente con reproductores. En el caso de larvas, juveniles o adultos en engorde, las inducciones a la anestesia se hacen grupales, lo que implica que los últimos en ser analizados (p. ej. determinación del peso, longitud, revisión de deformidades o biopsias) tendrán una mayor exposición al anestésico, ocasionándose la muerte si se supera el umbral toxicológico de no retorno. Razón por la que en este trabajo se consideró esencial definir el tiempo máximo de exposición de los juveniles de L. guttatus en la dosis más eficiente de inducción y recuperación (100 mg/L).
Los resultados mostraron que los juveniles de L. guttatus toleran la dosis de 100 mg/L hasta un máximo de tiempo de anestesia quirúrgica de ocho minutos, a los 12 minutos se presenta una mortalidad del 50% de los peces y a los 16 minutos el 100%. Estos resultados le permiten al acuicultor cronometrar el tiempo total de trabajo sin riesgos de mortalidad, en este caso, equivalente a la suma del tiempo de inducción de un minuto y quince segundos más el tiempo de sedación quirúrgica de ocho minutos. El tiempo de trabajo con el eugenol a una dosis de 100 mg/L aplicado a juveniles de L. guttatus no debe sobrepasar los 8 minutos tras alcanzar la sedación a una temperatura entre 24.0 y 24.8°C. Según Portz et al. (2006), las dosis de sedación para eugenol deben ser variadas cuando hayan cambios de al menos 2oC en el agua.
El eugenol es eficaz para la anestesia de juveniles (peso promedio=21.61±2g) de pargo manchado (L. guttatus) en temperaturas entre 24.0 y 24.8°C. La concentración de 25 mg/L es suficiente para la inducción anestésica parcial de los peces, la cual es ideal para realizar actividades rutinarias menos complejas, mientras que la concentración más eficiente en lograr la sedación quirúrgica fue de 100 mg/L, con una inducción y recuperación más rápida, sin presentar problemas de mortalidad en un tiempo de exposición total no mayor a los 8 minutos después de la sedación.
AGRADECIMIENTOS
A los estudiantes del programa de Diplomado en Acuicultura de la Escuela de Ciencias Biológicas de la Universidad Nacional por su contribución en el desarrollo de los bioensayos y a los evaluadores por su contribución a la mejora del presente trabajo.
BIBLIOGRAFÍA
Anderson, W., McKinley, R. & Colavecchia, M. (1997). The use of clove oil as an anaesthetic for rainbow trout and its effects on swimming performance. N. Am. J. Fish. Manage., 17, 301-307.
https://doi.org/10.1577/1548-8675(1997)
Abdo-de la Parra, M., Rodríguez-Ibarra, L., Rodríguez-Montes de Oca, G., Velasco-Blanco, G. & Ibarra-Castro, L. (2015). Estado actual de la larvicultura del pargo flamenco (Lutjanus guttatus). Lat Am. J. Aquat. Res., 43(3), 415-423.
Barata, M., Soares, F., Aragao, C., Almeida, A., Pousão-Ferreira, P. & Ribeiro, L. (2016). Efficiency of 2-phenoxyethanol and Clove Oil for Reducing Handling Stress in Reared Meagre, Argyrosomus regius (Pisces: Sciaenidae). J. World Aquacult. Soc., 47(1), 82-92. https://doi.org/10.1111/jwas.12245
Barrantes-Elizondo, A., Álvarez-Corrales, J., Otárola-Fallas, A. & Ramírez-Mixter, O. (2016). Análisis de la situación actual del sector acuícola en Costa Rica. San José, Costa Rica: Organización de las Naciones Unidas para la Alimentación y la Agricultura.
Cárdenas, C., Toni, C., Martos-Sitcha, J., Cárdenas, S., Heras, V., Baldisserotto, B., Heinzmann, B., Vázquez, R. & Mancera, J. M. (2016). Effects of clove oil, essential oil of Lippia alba and 2-phe anaesthesia on juvenile meagre, Argyrosomus regius (Asso, 1801). J. Appl. Ichthyol., 32(4), 693-700. https://doi.org/10.1111/jai.13048
Chacón-Guzmán J. (2010). Efectos de la tecnología de cultivo del pargo manchado Lutjanus guttatus (Steindachner, 1869) en jaulas flotantes en el Golfo de Nicoya, Costa Rica. Tesis de maestría no publicada, Universidad Nacional, Heredia, Costa Rica.
Cho, G. K. & Heath, D. D. (2000). Comparison of tricaine methanesulphonate (MS222) and clove oil anaesthesia effects on the physiology of juvenile Chinook salmon Oncorhynchus tshawytscha (Walbaum). Aquac. Res., 31, 537,546. https://doi.org/10.1046/j.1365-2109.2000.00478.x
Cooke, S. J., Suski, C. D., Ostrand, K. G., Tufts, B. L. & Wahl, D. H. (2004). Behavioural and physiological assesment of low concentrations of clove oil anaesthetic for handling and transporting largemouth bass (Micropterus salmoides). Aquaculture, 239, 509-529. https://doi.org/10.1016/j.aquaculture.2004.06.028
Coyle, S., Durborow, R. & Tidwell, J. (2004). Anesthetics in aquaculture. Texas, EE. UU.: Southern Regional Aquaculture Center.
Cunha, F. & Rosa, I. (2006). Anaesthetic effects of clove oil on seven species of tropical reef teleosts. J. Fish. Biol., 69, 1504-1512. https://doi.org/10.1111/j.1095-8649.2006.01213.x
Cup, A. R., Hartleb, C., F., Fredricks, K. & Gaikowski, M. P. (2014). Effectiveness of eugenol sedation to reduce the metabolic rates of cool and warm water fish al high loading densities. Aquacult. Res., 47(1), 234-242. https://doi.org/10.1111/are.12485
Din, A. (2006). Molluscicidal effect of three monoterpenes oils on schistosomiasis and fascioliasis vector snails. J. Egypt. Soc. Parasitol., 36(2), 599-612.
Di Rienzo J. A., Casanoves F., Balzarini M. G., Gonzalez L., Tablada M. & Robledo C. W. (2008). InfoStat. Buenos Aires, Argentina. Grupo InfoStat, FCA.
Fischer, W., Krupp, F., Schneider, W., Sommer, C., Carpenter, K. E. & Niem, V. H. (1995). Guía FAO para la identificación de especies para los fines de la pesca. Roma, Italia: Organización de las Naciones Unidas para la Alimentación.
García-Gómez, A., De la Gándara, F. & Raja, T. (2002). Utilización del aceite de clavo, Syzygium aromaticum L. (Merr. & Perry), como anestésico eficaz y económico para labores rutinarias de manipulación de peces marinos cultivados. Bol. Inst. Español Oceanogr., 18(1-4), 21-23.
González-Escobar, R. (2002). Eugenol: propiedades farmacológicas y toxicológicas. Ventajas y desventajas de su uso. Rev. Cubana. Estomatol., 39(2), 139-156.
Grush, J., Noakes, D. & Morcia, R. (2004). The efficacy of clove oil as an anesthetic for the zebrafish, Danio rerio (Hamilton). Zebrafish, 1(1), 46-53. https://doi.org/10.1089/154585404774101671
Guénette, S., Uhland, F., Hélie, P., Beaudry, F. & Vachon, P. (2007). Pharmacokinetics of eugenol in rainbow trout (Onchorhynchus mykiss). Aquaculture, 266, 262-265. https://doi.org/10.1016/j.aquaculture.2007.02.046
Gullian, M. & Villanueva, J. (2009). Efficacy of tricaine methanesulphonate and clove oil as anaesthetics for juvenile cobia Rachycentron canadum. Aquac. Res., 40(7), 852-860. https://doi.org/10.1111/j.1365-2109.2009.02180.x
Herrera-Ulloa, A., Chacón-Guzmán, J., Zúñiga-Calero, G., Fajardo-Espinoza, O. & Jiménez-Montealegre, R. (2009). Acuicultura de pargo la mancha Lutjanus guttatus (Steindachner, 1869) en Costa Rica dentro de un enfoque sistémico. Rev. Cien. Mar. Cost., 1, 197-213.
Hoskonen, P. & Pirhonen, J. (2004). Temperature effects on anaesthesia with clove oil in sex temperate-zone fishes. J. Fish Biol., 64, 1136-1142. https://doi.org/10.1111/j.1095-8649.2004.00359.x
Hussein, M., Wada, S., Hatai, K. & Yamamoto, A. (2000) Antimycotic activity of eugenol against selected water molds. J. Aquat. Anim. Health, 12, 224-229. https://doi.org/10.1577/1548-8667(2000)012<0224:AAOEAS>2.0.CO;2
Iversen, M., Finstand, B., Mackinley, R. & Eliassen, R. (2003). The efficacy of metomidate, clove oil, Aqui-S and Benzoak® as anaesthetics in Atlantic salmon (Salmo salar L.) smolts, and their potential stress-reducing capacity. Aquaculture, 221, 549-566. https://doi.org/10.1016/S0044-8486(03)00111-X
Javahery, S., Nekoubin, H. & Moradlu, A. (2012). Effect of anasthesia with clove oil in fish (review). Fish Physiol. Biochem., 38(6), 1545-1552. https://doi.org/10.1007/s10695-012-96825
Marín-Méndez, G., Torres-Cortés, A., Naranjo-Suarez, L., Chacón-Novoa, R. & Rondón-Barragan, L. (2012). Concentración letal 50 a 96 horas de eugenol en cachama blanca (Piaractus brachyopomus). Orinoquia, 16(2), 62-66.
Millán-Ocampo, L., Torres-Cortés, A., Marín-Méndez, G. A., Ramírez-Duart, W., Vásquez-Piñeros, M. A. & Rondón-Barragán, I. (2012). Concentración anestésica del eugenol en peces escalares (Pterophyllum scalare). Rev. Investig. Vet. Peru, 23(2), 171-181.
Mylonas, C. C., Cardinaletti, G., Sigelaki, I. & Polzonetti-Magni, A. (2005). Comparative efficacy of clove oil and 2-phenoxyethanol as anesthetics in the aquaculture of European sea bass (Dicentrarchus labrax) and gilthead sea bream (Sparus aurata) at different temperatures. Aquaculture, 246(1-4), 467-481. https://doi.org/10.1016/j.aquaculture.2005.02.046
Oliveira, L., Branco, R., Luscher, A., Lira, A., Rocha, T. & Santos, G. (2008). Eugenol como anestésico para a tilapia-do-nilo. Pesq. Agropec. Bras., 43, 1069-1074. http://dx.doi.org/10.1590/S0100-204X2008000800017
Park, I., Lee, S., Kim, Y., Park, K., Hur, J., Yoo, J. & Song, Y. (2003). Anesthetic effect of lidocaine hydrochloridesodium bicarbonate and MS-222 on the greenling (Hexagrammos otakii). J. Korean Fish. Soc., 39(8), 449-453. http://dx.doi.org/10.5657/kfas.2003.36.5.449.
Park, M., Hur, W., Im, S., Seol, D., Lee, J. & Park, I. (2008). Anaesthetic efficacy and physiological responses to clove oil anaesthetized kelp grouper Epinephelus bruneus. Aquat. Res., 39, 877-884. https://doi.org/10.1111/j.1365-2109.2008.01941.x
Perry, S. & Gilmour, K. (2006) Acid-base balance and CO2 excretion in fish: unanswered questions and emerging models. Resp. Physiol. Neuro., 154, 199-215. https://doi.org/10.1016/j.resp.2006.04.010
Portz, D., Woodley, C. & Cech, C. (2006) Stress-associated impacts of short-term holding on fishes. Rev. Fish. Biol. Fish , 16, 125-170. https://doi.org/10.1007/s11160-006-9012-z
Prashar, A., Locke, I. C. & Evans, C. S. (2006). Cytotoxicity of clove (Syzygium aromaticum) oil and its major components to human skin cells. Cell Proliferation, 39(4), 241-248. https://doi:10.1111/j.1365-2184.2006.00384.x
Prince, A. & Powell, C. (2000). Clove oil as an anesthetic for invasive field procedures on adult rainbow trout. North Am. J. Fish. Manage., 20, 1029-1032. https://doi.org/10.1577
/1548-8675(2000)020<1029:COAAAF>2.0.CO;2
Roo, J., Fernández-Palacios, H., Hernández-Cruz, C. M., Mesa-Rodriguez, A., Schuchardt, D. & Izquierdo, M. (2014). First results of spawning and larval rearing of longfin yellowtail Seriola rivoliana as a fast-growing candidate for European marine finfish aquaculture diversification. Aquat. Res., 45(4), 689-700. https://doi.org/10.1111/are.12007
Roubach, R., Gomes, L.C. & Val, A.L. (2001). Safest level of tricaine mehanesulfonate (MS-222) to induce anesthesia in juveniles matrinx, Brycon cephalus. Acta Amazon, 31, 159-163. http://dx.doi.org/10.1590/1809-43922001311163
Roubach, R., Gómez, L., Fonseca, F. & Val, A. (2005). Eugenol as na efficacious anaesthetic for tambaqui, Colossoma macropomum (Cuvier). Aquat. Res., 36(11), 1056-1061. https://doi.org/10.1111/j.1365-2109.2005.01319.x
Sladky, K. K., Swanson, C. R., Stoskopf, M. K., Loomis, M. R. & Lewbart, G. A. (2001). Comparative efficacy of tricaine methanesulfonate and clove oil for use as anesthetic in red pacu (Piaractus brachypomus). Am. J. Vet. Res., 62, 337-342. https://doi.org/10.2460/ajvr.2001.62.337
Small, B. (2003). Anesthetic efficacy of metomidate and comparison of plasma cortisol responses to tricaine methanesulfonate, quinaldine and clove oil anesthetized channel catfish Ictalurus punctatus. Aquaculture, 218, 177-185. https://doi.org/10.1016/S0044-8486(02)00302-2
Soto, C. & Burhanuddin, C. (1995). Clove oil as a fish anaesthetic for measuring length and weight of rabbitfish (Siganus lineatus). Aquaculture, 136, 149-152. https://doi.org/10.1016/0044-8486(95)01051-3
Souza, M., Vettorazzi, M., Kobayashi, R., Neto, F. & de Andrade, M. (2015). Eugenol as an anaesthetic in the management of farmed lane snapper, Lutjanus synagris (Linnaeus, 1758). Rev. Cien. Agron., 46(3), 532-538. http://dx.doi.org/10.5935/1806-6690.20150035
Steindachner, F. (1869). Ichthyologische Notizen. Sitzber. Akad., 60, 290-318.
Summerfelt, R. C. & Smith, L. S. (1990). Anaesthesia, surgery and related techniques. In C. B. Schreck & P. B. Moyle (Eds.), Methods in Fish Biology (pp. 213-272). Maryland, EE. UU.: American Fisheries Society.
Taylor, P. W. & Roberts, S. D. (1999). Clove oil: an alternative anaesthetic for aquaculture. N Am. J. Aquact., 61, 150-155.
UFR (Use of Fishes in Research) Committee. (2013). Guidelines for the use of fishes in research. Bethesda, Maryland: American Fisheries Society.
Velísek, J., Wlasow, T., Gomulka, P., Svobodová, Z., Novotn, L. & Ziomek, E. (2006). Effects of clove oil anaesthesia on European Catfish (Silurus glanis L.). Acta Veterinaria Brno., 75, 99-106. https://doi.org/10.2754/avb200675010099
Walsh, C. T. & Pease, B. C. (2002). The use of clove oil as an anaesthetic for the longfinned eel, Anguilla reinhardtii (Steindachner). Aquat. Res., 33, 627-635. https://doi.org/10.1046/j.1365-2109.2002.00701.x
Webber, R. A., Peleteiro, J., García-Martín, L. & Aldegunde, M. (2009). The efficacy of 2-phenoxyethanol, metomidate, clove oil and MS-222 as anaesthetic agents in the Senegalese sole (Solea senegalensis Kaup 1858). Aquaculture, 288, 147-150. https://doi.org/10.1016/j.aquaculture.2008.11.024
Woody, C. A., Nelson, J. & Ramstad, K. (2002). Clove oil as an anaesthetic for adult sockeye salmon: field trials. J. Fish. Biol., 60, 340-347. https://doi.org/10.1111/j.1095-8649.2002.tb00284.x
Zahl, I. H., Samuelsen, O. & Kiessling, A. (2012). Anaesthesia of farmed fish: implications for welfare. Fish. Physiol. Biochem., 38, 201-218. https://doi.org/10.1007/s10695-011-9565-1
1 Programa Parque Marino del Pacífico, Escuela de Ciencias Biológicas, Universidad Nacional, Puntarenas, Costa Rica. jonathan.chacon.guzman@una.cr*, milagro.carvajal.oses@una.cr y angel.herrera.ulloa@una.cr
2 Programa de Acuicultura y Biotecnología Marina, Parque Marino del Pacífico, Puntarenas, Costa Rica.
3 Universidad de Padua, Padua, Italia. silvia_pauletto@hotmail.it
