ISSN: 1659-455X • e-ISSN: 1659-407X • Vol. 12 (1), enero-junio 2020
REVMAR
REVISTA CIENCIAS MARINAS Y COSTERAS
Recibido: 20 junio 2019 • Corregido: 20 enero 2020 • Aceptado: 27 enero 2020
DOI: http://dx.doi.org/10.15359/revmar.12-1.2
Abundancia, biomasa y estructura de la ictiofauna demersal en el océano Pacífico de Centroamérica, basadas en datos de prospección pesquera realizados a bordo del B/O Miguel Oliver
Abundance, biomass, and structure of demersal ichthyofauna in the Pacific Ocean of Central America, based on fishery prospecting conducted on board the R/V Miguel Oliver
Rosario Benavides Morera1*, Fernando Campos Calderón1 y José Mauro Vargas Hernández1
RESUMEN
A razón de ampliar el conocimiento sobre la estructura y composición de la ictiofauna demersal en el Pacífico de Centroamérica, se realizó el estudio de muestras obtenidas en 98 puntos de arrastre efectuados con el B/O Miguel Oliver entre el 10 de noviembre y el 16 de diciembre de 2010. Con una red tipo Lofoten, se faenó por 30 minutos sobre los puntos ubicados según estratos y profundidad (máxima 1 600 m). La muestra total (17 507 ejemplares) tuvo representación de peces cartilaginosos y óseos divididos en 77 familias y 158 especies. Dicrolene filamentosa (12.27%) mostró la mayor abundancia, las biomasas más representativas del estudio fueron de Peprilus medius (35.67%) y Peprilus snyderi (12.49%) junto con Rhinoptera steindachneri (9.45%), mientras que las especies más frecuentes fueron Peristedion barbiger y Stomias atriventer (ambas con 2.71%). La costa frente a Costa Rica y Panamá mostró diversidad alta (H’:3), mientras que la equidad presentó valores uniformes. Para determinar ensamblajes con respecto a la profundidad, se utilizó un ordenamiento espacial que mostró un agrupamiento de 3 conjuntos (PERMANOVA, R = 0.54, P > 0.05) y un análisis canónico de correspondencia, el cual arrojó evidencia suficiente de que las especies fueron influenciadas en su distribución por la salinidad y la temperatura. La ictiofauna encontrada responde a eventos y condiciones ambientales particulares que revisten de gran importancia ecológica los hallazgos. Se resalta lo fundamental de los ensamblajes para evaluar cómo las poblaciones cambian como resultado de las características que exhiben las masas de agua.
Palabras clave: América Central, océano Pacífico, profundidad, ensamblajes, plataforma continental.
ABSTRACT
In order to expand knowledge about the structure and composition of demersal ichthyofauna on the Pacific of Central America, we analyzed samples collected from 98 sampling points on board the R/V Miguel Oliver from November 10 to December 16, 2010. Using a Lofoten net, trawl surveys were conducted for 30 minutes at each sampling point at different stratums and depths (1600 m maximum). The total sample (17507 specimens) was represented by cartilaginous fish and bony fish divided into 77 families and 158 species. Dicrolene filamentosa (12.27%) showed the highest abundance; Peprilus medius (35.67%) and Peprilus snyderi (12.49%) reported the most representative biomass along with Rhinoptera steindachneri (9.45%); in addition, Peristedion barbiger and Stomias atriventer were the most frequent species (both 2.71%). The coast between Costa Rica and Panama showed the highest diversity (H’:3), while evenness showed uniform values along the studied area. In order to determine fish assemblages in response to depth, a spatial ordering was used showing a 3-set grouping (PERMANOVA, R = 0.54, P> 0.05). Furthermore, a canonical correspondence analysis shows enough evidence that the species distribution was influenced by salinity and temperature. Findings are ecologically significant indicating that ichthyofauna responds to particular environmental conditions and events. In addition, the paper highlights the importance of assemblages to assess how fish populations change as a result of the characteristics exhibited by water bodies.
Keywords: Central America, Pacific Ocean, depth, assemblages, continental shelf.
INTRODUCCIÓN
Las costas en el océano Pacífico, desde México hasta Ecuador, constituyen parte del gran ecosistema marino conocido como el Pacífico Costero Centroamericano (PCC) (Sherman & Hempel, 2008; Spalding et al. 2012). Desde el punto de vista oceanográfico, la región Pacífica del Istmo Centroamericano posee un interés particular, debido a la convergencia de varios eventos oceanográficos y climáticos; tal es el caso de la migración de la ZCIT (Zona de Convergencia Intertropical), los afloramientos costeros, el domo térmico de Costa Rica, entre otros (Willett et al. 2006; Amador, 2008; Kikuchi & Wang, 2008; Sasai et al. 2012). El PCC, además de poseer características físicas muy heterogéneas, es considerado un sistema de alta productividad primaria (300 g • m-2 año) (Dominici-Arosemena & Wolff, 2006; López, 2016).
Existen diversos estudios en esta gran región que abordan la dinámica costera (Trasviña & Barton, 2008), la oceanografía regional (Lavín et al. 2006), los procesos de interacción océano-atmósfera (Amador et al. 2016), los eventos climatológicos (Maldonado et al. 2018) y la biogeografía de especies de peces en ambientes coralinos (Zapata & Robertson, 2007; Robertson & Cramer, 2009). Los trabajos de peces asociados a la plataforma continental se han concentrado en la costa pacífica de México (Bianchi, 1991; Aguilar-Palomino et al. 1996; Rodríguez-Romero et al. 2008; León-Chávez et al. 2010), principalmente, en grupos específicos como los tiburones o rayas (Clarke et al. 2016). Recientemente, Robertson et al. (2017) realizaron un análisis taxonómico de peces óseos capturados en aguas profundas del PCC, con ilustraciones y códigos de barras de ADN. Ellos usaron datos de la misma campaña de prospección que fue utilizada en este trabajo. En la presente contribución, se analizan otras variables, factores e interacciones, con la finalidad de complementar, de cierta manera, el análisis de los datos presentados en el trabajo de Robertson et al. (2017).
Las capturas pesqueras totales de los recursos ícticos en el Pacífico Oriental Central han tenido una tendencia a la disminución (FAO, 2018). Particularmente, para la región del istmo centroamericano, la mayoría de las pesquerías son multiespecíficas, deficientes en datos y realizadas a partir de observaciones a largo plazo (Barange et al. 2018). Las familias que han tenido mayores capturas son Scombridae y Macrouridae (FAO, 2018). Este conocimiento relativamente escaso contrasta con un creciente interés en la región por especies de profundidad con valor comercial, en especial, por organismos bénticos (Arana et al. 2009; Wehrtmann & Nielsen, 2009; Wehrtmann et al. 2017). En el caso de los peces demersales y de aguas profundas, esa información básica no existe en el nivel local o es escasa y dispersa (Ramírez-Llodra et al. 2011; Norse et al. 2012).
A partir de la década de los 70, la pesca comercial en todo el mundo está ocurriendo a profundidades cada vez mayores (Morato et al. 2006) y esta actividad, en aguas profundas, se ha convertido en una importante amenaza para nuevos ecosistemas marinos (Watson & Morato, 2013). En el contexto anterior, estudios como el presente pueden ser importantes para futuras formulaciones e implementaciones de planes de gestión en dichas pesquerías.
Los peces, como muchos otros recursos demersales, destacan por su potencial económico, alimenticio y por su interés científico (Aguilar-Palomino et al. 1996). Al igual que en otras regiones del continente, es recomendable contar con una base sólida de información sobre su biología y ecología. Bianchi (1991) realizó un estudio del ensamblaje de especies acerca de la plataforma y del talud continentales entre el golfo de Tehuantepec y el de Papagayo. Dicha investigación tiene algunas similitudes con esta y abarcó una pequeña porción del área muestreada en la campaña de prospección. Otros trabajos adicionales incluyen análisis taxonómicos en Baja California (Rodríguez-Romero et al. 2008), en el Pacífico colombiano (Rojas & Zapata, 2006) y ensamblajes en aguas someras de una isla oceánica (Friedlander et al. 2012). También, Acevedo-Cervantes et al. (2009) realizaron un análisis del ensamblaje de especies en el golfo de California, a profundidades entre 90 y 540 m.
A pesar de todos los trabajos antes citados y como fue mencionado, los estudios con especies demersales siguen siendo escasos hasta el día de hoy. En este sentido, el principal objetivo de este documento es contribuir al conocimiento de dichas especies, al establecer una base científica para posibles estudios futuros contemplando el componente abordado aquí. La presente investigación es similar a otra realizado previamente y bajo la misma forma de muestreo en una vasta zona del Caribe centroamericano (Benavides & Campos, 2019); se pudo tener, de esta manera, una imagen bastante completa de la ictiofauna demersal para ambas plataformas y taludes continentales.
MATERIALES Y MÉTODOS
Área de estudio: El estudio se efectuó entre el 10 de noviembre y el 16 de diciembre de 2010 y abarcó aguas del océano Pacífico sobre la plataforma y el talud continentales, desde la costa sureste de Panamá (7°24ʼ 22ʼʼ N, 78°07ʼ25ʼʼ O) hasta la costa suroeste de Guatemala (13°45ʼ 55ʼʼ N, 91°52ʼ 54ʼʼ O) (Fig. 1).
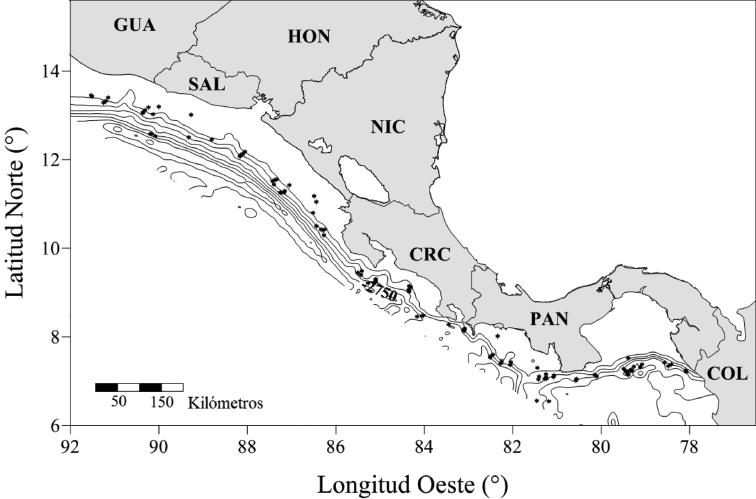
Fig. 1. Área de estudio y posición de estaciones de muestreo (●)
Fig. 1. Study area and position of sampling stations (●)
Metodología de pesca: Se realizaron 107 estaciones de muestreo con 98 lances validos ubicados sobre los 1 568 km de línea de costa a una profundidad entre 100 y 1 600 m, aproximadamente. Cada faena de arrastre tuvo una duración aproximada de 30 min, con una velocidad de ~3-3.5 nudos. La mayoría de las faenas se realizaron durante horas de luz y se contó con un conjunto de sensores de red (ITI-SCANMAR) para ayudar a controlar la duración de cada arrastre. Una descripción detallada de la metodología empleada en estas faenas se puede consultar en Benavides & Campos (2019).
Arte de pesca y equipamientos: El muestreo se realizó a abordo del B/O Miguel Oliver, perteneciente a la Secretaría del Mar de España. La embarcación estaba equipada con una red de arrastre de tipo LOFOTEN, con especificaciones exactas, según Robertson et al. (2017).
Muestreo biológico: En cada estación, los individuos colectados fueron contabilizados, pesados y clasificados taxonómicamente hasta el nivel de especie. Para la identificación, se utilizaron las claves de Carpenter & Niem (1999a; 1999b; 2001a y 2001b). La validez taxonómica, la autoridad y el año de la descripción de cada especie se corroboraron, según Fricke et al. (2017).
Muestreo oceanográfico: En 98 de los lances de pesca, se realizaron perfiles oceanográficos en la columna de agua. Para esto, se utilizó un perfilador CTD Sea Bird, modelo SB 25 plus. En cada estación, se obtuvieron valores de temperatura (°C) y salinidad desde la superficie hasta 1590 m de profundidad.
Análisis estadístico: Con el número de individuos capturados por estación, se formuló una matriz biológica. A fin de reducir influencias de ceros, se transformó la matriz a log (x + 1) y se estandarizó por el área muestreada de arrastre (Páramo et al. 2012). La riqueza de especies fue evaluada mediante una curva de acumulación de especies, utilizando el método de rarefacción basado en muestras (Ugland et al. 2003). Se calculó el índice de diversidad de Shannon (H’) y equidad de Pielou (J’), con el fin de estudiar la uniformidad y proporción de la diversidad encontrada. Se analizaron las especies que representaron al menos el 1% de la frecuencia. La posible influencia de la profundidad con la abundancia se determinó mediante un análisis Clúster, utilizando el índice de similaridad de Bray-Curtis. Para validar la diferenciación entre matrices, se realizó un análisis de varianza multivariado con permutaciones, usando matrices de distancias (PERMANOVA). Finalmente, para estudiar la influencia de las variables hidrográficas, se hizo un análisis canónico de correspondencia (ACC). Todos los análisis estadísticos se realizaron en R 3.5.1 (R Core Team, 2018). Los mapas se generaron con Surfer® 13 (2013).
RESULTADOS
La curva de acumulación de especies (Fig. 2) corresponde a una función que muestra un comportamiento asintótico para puntos de muestreo superiores a 20, siendo más evidente al aproximarse al máximo de sitios de colecta. Por el contrario, la desviación estándar tuvo valores elevados en los primeros puntos (5 sitios), para, posteriormente, decrecer hasta alcanzar su punto más bajo en el último muestreo.
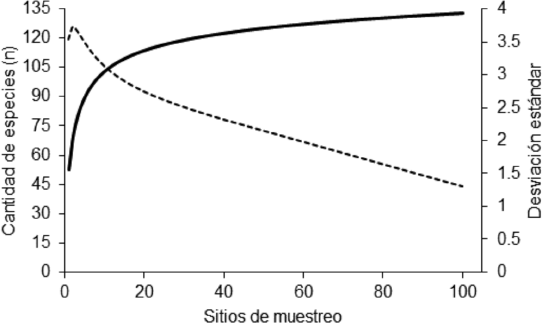
Fig. 2. Curva de acumulación de especies basada en rarefacción de cada sitio de muestreo y la desviación estándar calculada para cada sitio (línea discontinua)
Fig. 2. Species accumulation curve based on each site rarefaction and the standard deviation for all sampling sites (dashed line)
El total de organismos capturados fue 17 507, estos pertenecen a 158 especies (137 de peces óseos y 21 de condrictios) correspondientes a 77 familias (Cuadro 1). El grupo de los peces óseos fue el más abundante (96.77%, n = 16 942), y las especies Dicrolene filamentosa (12.27%), Bathypterois atricolor (6.39%) y Hemanthias signifer (5.99%) tuvieron los valores porcentuales (abundancias relativas) más altos. El grupo de los condrictios (3.23%, n = 565) completó el porcentaje restante con Centroscyllium nigrum (0.83%) como principal contribuyente a la abundancia.
Cuadro 1. Especies demersales capturadas durante el estudio. Se presenta la abundancia porcentual (del conteo de individuos), la biomasa (peso capturado no eviscerado), frecuencia de muestreo y rango de captura
Table 1. Demersal species captured during the study. Percentages are presented for abundance (of the count of individuals), biomass (weight not eviscerated), sampling frequency and range of capture
|
Familia |
Especie |
Abundancia % |
Biomasa % |
Frecuencia % |
Rango de profundidad (m) |
|
Acanthuridae |
Acanthurus coeruleus (Bloch & Schneider 1801) |
0.0057 |
0.0190 |
0.1353 |
140.5 |
|
Alepocephalidae |
Alepocephalus tenebrosus (Gilbert 1892) |
0.1771 |
0.0471 |
1.7591 |
115-1 389 |
|
Alepocephalidae |
Bajacalifornia burragei (Townsend & Nichols 1925) |
0.0286 |
0.0443 |
0.2706 |
320-1 406 |
|
Alepocephalidae |
Bathytroctes microlepis (Günther 1878) |
0.0400 |
0.0621 |
0.1353 |
1 530-1 625 |
|
Alepocephalidae |
Leptoderma ospesca (Angulo, Baldwin & Robertson 2016) |
0.0228 |
0.0020 |
0.1353 |
530-1 625 |
|
Alepocephalidae |
Rouleina attrita (Vaillant 1888) |
0.0228 |
0.0355 |
0.1353 |
1 115-1 119 |
|
Alepocephalidae |
Talismania bifurcata (Parr 1951) |
0.1771 |
0.0471 |
0.2706 |
482.5-1401 |
|
Alopiidae |
Alopias superciliosus (Lowe 1841) |
0.0057 |
0.0048 |
0.1353 |
419.5 |
|
Anoplogastridae |
Anoplogaster cornuta (Valenciennes 1833) |
0.1085 |
0.0088 |
1.7591 |
722-1 469.5 |
|
Antennariidae |
Fowlerichthys avalonis (Jordan & Starks 1907) |
0.0057 |
0.0006 |
0.1353 |
132 |
|
Argentinidae |
Argentina aliceae (Cohen & Atsaides 1969) |
4.3640 |
1.6059 |
0.4060 |
108-138.5 |
|
Ariidae |
Cathorops steindachneri (Gilbert & Starks 1904) |
0.0171 |
0.0024 |
0.2706 |
105.5-933 |
|
Balistidae |
Balistes polylepis (Steindachner 1876) |
0.0057 |
0.0000 |
0.1353 |
106 |
|
Bathylagidae |
Leuroglossus urotranus (Bussing 1965) |
0.0057 |
0.0000 |
0.1353 |
105-107 |
|
Bothidae |
Engyophrys sanctilaurentii (Jordan & Bollman 1890) |
0.1828 |
0.0050 |
1.0825 |
105.5-1 369 |
|
Bothidae |
Monolene dubiosa (Garman 1899) |
1.0053 |
0.0067 |
0.9472 |
130-457 |
|
Bothidae |
Monolene maculipinna (Bruun 1937) |
0.0057 |
0.0685 |
0.1353 |
1 369 |
|
Bregmacerotidae |
Bregmaceros bathymaster (Jordan & Bollman 1890) |
0.0057 |
0.0004 |
0.2706 |
157-183.5 |
|
Bythitidae |
Cataetyx simus (Garman 1899) |
0.0057 |
0.0064 |
0.1353 |
769 |
|
Callionymidae |
Synchiropus atrilabiatus (Garman 1899) |
0.0800 |
0.0001 |
0.1353 |
165.5-182.5 |
|
Caproidae |
Capros aper (Linnaeus 1758) |
0.0057 |
0.0009 |
0.1353 |
941.5 |
|
Carangidae |
Caranx crysos (Mitchill 1815) |
0.0057 |
0.0265 |
0.1353 |
941.5 |
|
Carangidae |
Caranx sexfasciatus (Quoy & Gaimard 1825) |
0.0057 |
0.0038 |
0.1353 |
1345 |
|
Carangidae |
Decapterus macrosoma (Bleeker 1851) |
0.0057 |
0.0006 |
0.1353 |
109-500 |
|
Carangidae |
Selene brevoortii (Gill 1863) |
0.0057 |
0.0000 |
0.1353 |
124-165 |
|
Carangidae |
Selene peruviana (Guichenot 1866) |
0.0171 |
0.0001 |
0.4060 |
149-186 |
|
Carcharhinidae |
Carcharhinus plumbeus (Nardo 1827) |
0.8397 |
0.0093 |
0.1353 |
1 244 |
|
Caulophrynidae |
Caulophryne pelagica (Brauer 1902) |
0.0057 |
0.0027 |
0.1353 |
945 |
|
Chiasmodontidae |
Chiasmodon subniger (Garman 1899) |
0.0286 |
0.0015 |
0.6766 |
614-1577.5 |
|
Chiasmodontidae |
Pseudoscopelus lavenbergi (Melo, Walker & Klepadlo 2007) |
0.0114 |
0.0177 |
0.1353 |
1 113-1126 |
|
Chimaeridae |
Hydrolagus macrophthalmus (de Buen 1959) |
0.4627 |
0.2371 |
2.3004 |
905.5-1 469.5 |
|
Chlorophthalmidae |
Chlorophthalmus mento (Garman 1899) |
0.0457 |
0.0085 |
0.8119 |
135.5-779 |
|
Congridae |
Japonoconger proriger (Gilbert 1891) |
0.0400 |
0.0621 |
0.6766 |
118-920 |
|
Congridae |
Xenomystax atrarius (Gilbert 1891) |
0.6112 |
0.0786 |
0.4060 |
140.5-1 401 |
|
Cynoglossidae |
Symphurus leei (Jordan & Bollman 1890) |
0.4855 |
0.0080 |
0.2706 |
130-176 |
|
Dalatiidae |
Dalatias licha (Bonnaterre 1788) |
0.0057 |
0.7619 |
0.1353 |
875.5 |
|
Echinorhinidae |
Echinorhinus cookei (Pietschmann 1928) |
0.0743 |
0.0010 |
0.8119 |
174-496 |
|
Emmelichthyidae |
Plagiogeneion rubiginosum (Hutton 1875) |
0.0057 |
0.2680 |
0.1353 |
127.5 |
|
Etmopteridae |
Etmopterus benchleyi (Vásquez, Ebert & Long 2015) |
0.8397 |
0.0006 |
0.1353 |
905.5-1469.5 |
|
Etmopteridae |
Etmopterus spinax (Linnaeus 1758) |
0.0228 |
0.0143 |
0.1353 |
1 197.5 |
|
Gadidae |
Micromesistius poutassou (Risso 1827) |
0.0514 |
0.0483 |
0.1353 |
105.5-1 197.5 |
|
Haemulidae |
Pomadasys branickii (Steindachner 1879) |
0.0057 |
0.0023 |
0.1353 |
113-114 |
|
Halosauridae |
Halosaurus attenuatus (Garman 1899) |
0.0286 |
0.0090 |
0.2706 |
1 113-1 472 |
|
Halosauridae |
Halosaurus radiatus (Garman 1899) |
0.0914 |
0.0813 |
2.0298 |
115-844 |
|
Ipnopidae |
Bathypterois atricolor (Alcock 1896) |
6.3917 |
0.1768 |
0.6766 |
153-1 443 |
|
Ipnopidae |
Bathypterois ventralis (Garman 1899) |
2.4276 |
0.1077 |
1.2179 |
165-1 406 |
|
Labridae |
Acantholabrus palloni (Risso 1810) |
0.0057 |
0.0061 |
0.1353 |
132 |
|
Labridae |
Decodon melasma (Gomon 1974) |
0.0571 |
0.0049 |
0.8119 |
105.5-140.5 |
|
Lophiidae |
Lophiodes caulinaris (Garman 1899) |
0.1656 |
0.0645 |
1.6238 |
105.5-143 |
|
Lophiidae |
Lophiodes spilurus (Garman 1899) |
0.0857 |
0.0043 |
0.2706 |
148-474 |
|
Lutjanidae |
Lutjanus viridis (Valenciennes 1846) |
0.0228 |
0.0243 |
0.1353 |
240 |
|
Macrouridae |
Coelorinchus canus (Garman 1899) |
1.8393 |
0.0370 |
0.2706 |
148-174 |
|
Macrouridae |
Coryphaenoides anguliceps (Garman 1899) |
2.5190 |
0.6007 |
0.4060 |
814-1 577.5 |
|
Macrouridae |
Coryphaenoides boops (Garman 1899) |
0.2228 |
0.2605 |
2.0298 |
745.5-1 114.5 |
|
Macrouridae |
Coryphaenoides capito (Garman 1899) |
0.8340 |
0.5051 |
0.6766 |
905.5-1469.5 |
|
Macrouridae |
Coryphaenoides carminifer (Garman 1899) |
2.8160 |
0.1886 |
0.6766 |
814-1 577.5 |
|
Macrouridae |
Coryphaenoides delsolari (Chirichigno & Iwamoto 1977) |
0.5712 |
0.1224 |
0.5413 |
1081-1 285.5 |
|
Macrouridae |
Nezumia convergens (Garman 1899) |
2.2905 |
0.1221 |
0.5413 |
138.5-1 577.5 |
|
Macrouridae |
Nezumia latirostrata (Garman 1899) |
0.0228 |
0.0011 |
0.1353 |
1 023 |
|
Macrouridae |
Nezumia liolepis (Gilbert 1890) |
1.2966 |
0.1387 |
0.2706 |
1 114.5-1 121 |
|
Macrouridae |
Nezumia stelgidolepis (Gilbert 1890) |
0.0571 |
0.4370 |
0.5413 |
115.5-814 |
|
Malacanthidae |
Caulolatilus affinis (Gill 1865) |
0.0114 |
0.0029 |
0.2706 |
108-138.5 |
|
Melanocetidae |
Melanocetus johnsonii (Günther 1864) |
0.0571 |
0.0084 |
0.8119 |
1 121-1 499 |
|
Merlucciidae |
Merluccius angustimanus (Garman 1899) |
0.1200 |
9.1953 |
0.6766 |
115-700 |
|
Moridae |
Antimora rostrata (Günther 1878) |
0.0114 |
0.0027 |
0.1353 |
1 119.5 |
|
Moridae |
Physiculus nematopus (Gilbert 1890) |
0.0057 |
0.0002 |
0.1353 |
174 |
|
Moridae |
Physiculus rastrelliger (Gilbert 1890) |
0.6626 |
0.0131 |
1.3532 |
105.5-1 369 |
|
Muraenidae |
Gymnothorax equatorialis (Hildebrand 1946) |
0.0057 |
0.0010 |
0.1353 |
140.5 |
|
Muraenidae |
Gymnothorax phalarus (Bussing 1998) |
0.0057 |
0.0017 |
0.2706 |
105.5-933 |
|
Myctophidae |
Benthosema panamense (Tåning 1932) |
0.0628 |
0.0827 |
0.5413 |
117-422 |
|
Myctophidae |
Lampanyctus parvicauda (Parr 1931) |
0.0057 |
0.0000 |
0.1353 |
1 320-1 370 |
|
Myliobatidae |
Rhinoptera steindachneri (Evermann & Jenkins 1891) |
0.0628 |
9.4367 |
0.9472 |
105.5-1 225.5 |
|
Nemichthyidae |
Avocettina bowersii (Garman 1899) |
0.0286 |
0.0011 |
0.2706 |
1 107-1 292 |
|
Nemichthyidae |
Avocettina infans (Günther 1878) |
0.1200 |
0.0047 |
2.4357 |
722-1 499 |
|
Nemichthyidae |
Nemichthys scolopaceus (Richardson 1848) |
0.4113 |
0.0335 |
0.8119 |
105.5-1 499 |
|
Neoscopelidae |
Scopelengys tristis (Alcock 1890) |
1.3652 |
0.0640 |
0.4060 |
726.5-1 145 |
|
Nettastomatidae |
Venefica tentaculata (Garman 1899) |
1.4623 |
0.2732 |
0.5413 |
821.5-1 577.5 |
|
Nomeidae |
Cubiceps pauciradiatus (Günther 1872) |
0.0286 |
0.0023 |
0.6766 |
674-1 469.5 |
|
Nomeidae |
Psenes cyanophrys (Valenciennes 1833) |
0.0057 |
0.0005 |
0.2706 |
185.5 |
|
Notacanthidae |
Notacanthus cf. chemnitzii (Bloch 1788) |
0.0114 |
0.0107 |
0.2706 |
1 100-1 527 |
|
Notacanthidae |
Notacanthus spinosus (Garman 1899) |
0.1142 |
0.0242 |
2.3004 |
116-1 527 |
|
Ogcocephalidae |
Dibranchus cracens (Bradbury, McCosker & Long 1999) |
0.0114 |
0.0028 |
0.2706 |
138.5-1 292 |
|
Ogcocephalidae |
Dibranchus erinaceus (Garman 1899) |
0.0628 |
0.0087 |
0.6766 |
470-1 030 |
|
Ogcocephalidae |
Dibranchus hystrix (Garman 1899) |
0.0571 |
0.0117 |
0.5413 |
153-1 527 |
|
Ogcocephalidae |
Dibranchus nudivomer (Garman 1899) |
0.0228 |
0.0087 |
0.4060 |
1 101-1 314 |
|
Ogcocephalidae |
Dibranchus spinosus (Garman 1899) |
0.4284 |
0.0111 |
1.3532 |
836-1 625 |
|
Ogcocephalidae |
Dibranchus velutinus (Bradbury 1999) |
0.0400 |
0.0098 |
0.5413 |
570-965 |
|
Ogcocephalidae |
Zalieutes elater (Jordan & Gilbert 1882) |
4.9694 |
0.1970 |
2.4357 |
113-136 |
|
Ophidiidae |
Cherublemma emmelas (Gilbert 1890) |
2.9131 |
4.5259 |
0.4060 |
105.5-1 401 |
|
Ophidiidae |
Dicrolene filamentosa (Garman 1899) |
12.2751 |
6.2414 |
2.3004 |
140.5-1 577.5 |
|
Ophidiidae |
Lamprogrammus cf. niger (Alcock 1891) |
0.5655 |
0.2126 |
0.2706 |
726.5-1 577.5 |
|
Ophidiidae |
Luciobrotula coheni (Nielsen 2009) |
0.0400 |
0.0010 |
0.6766 |
108-933 |
|
Ophidiidae |
Monomitopus malispinosus (Garman 1899) |
0.0457 |
0.0027 |
1.2179 |
108-1 022 |
|
Ophidiidae |
Monomitopus torvus (Garman 1899) |
0.8225 |
0.0195 |
0.8119 |
122-1 081 |
|
Ophidiidae |
Neobythites stelliferoides (Gilbert 1890) |
0.0057 |
0.0274 |
0.2706 |
136-833.5 |
|
Ophidiidae |
Otophidium indefatigabile (Jordan & Bollman 1890) |
0.0114 |
0.0224 |
0.2706 |
1 369-1 401 |
|
Paralichthyidae |
Citharichthys platophrys (Gilbert 1891) |
0.0171 |
0.0107 |
0.4060 |
108.5-115.5 |
|
Paralichthyidae |
Hippoglossina bollmani (Gilbert 1890) |
1.0510 |
0.0875 |
1.7591 |
105.5-1 225.5 |
|
Paralichthyidae |
Hippoglossina tetrophthalma (Gilbert 1890) |
0.0228 |
0.0061 |
0.1353 |
133.5 |
|
Pentanchidae |
Apristurus brunneus (Gilbert 1892) |
0.0057 |
0.0034 |
0.1353 |
1401 |
|
Pentanchidae |
Apristurus kampae (Taylor 1972) |
0.3484 |
0.2060 |
2.4357 |
674-1 577.5 |
|
Pentanchidae |
Apristurus nasutus (de Buen 1959) |
0.0343 |
0.0103 |
0.5413 |
1 022-1 161.5 |
|
Peristediidae |
Peristedion barbiger (Garman 1899) |
0.0628 |
0.2736 |
2.7064 |
105.5-1 369 |
|
Peristediidae |
Peristedion crustosum (Garman 1899) |
0.0057 |
0.0029 |
0.1353 |
174 |
|
Phosichthyidae |
Yarrella argenteola (Garman 1899) |
0.5883 |
0.0112 |
0.2706 |
115-456 |
|
Platytroctidae |
Barbantus curvifrons (Roule & Angel 1931) |
0.0171 |
0.0030 |
0.2706 |
165-1 116 |
|
Platytroctidae |
Platytroctes apus (Günther 1878) |
0.0971 |
0.0266 |
2.3004 |
103-1 472 |
|
Priacanthidae |
Pristigenys serrula (Gilbert 1891) |
0.1142 |
0.0640 |
0.5413 |
726.5-1 225.5 |
|
Pristigasteridae |
Opisthopterus macrops (Günther 1867) |
0.0971 |
0.0151 |
0.1353 |
133.5 |
|
Psychrolutidae |
Psychrolutes cf. sio (Nelson 1980) |
0.0514 |
0.0657 |
0.9472 |
905.5-1 499 |
|
Rajidae |
Dipturus oxyrinchus (Linnaeus 1758) |
0.0057 |
0.0005 |
0.1353 |
1 107 |
|
Rajidae |
Raja microocellata (Montagu 1818) |
0.0057 |
0.0002 |
0.1353 |
136 |
|
Rajidae |
Raja velezi (Chirichigno 1973) |
0.0057 |
0.0078 |
0.1353 |
135.5 |
|
Rajidae |
Rostroraja equatorialis (Jordan & Bollman 1890) |
0.0057 |
0.0149 |
0.1353 |
108 |
|
Rhinochimaeridae |
Harriotta raleighana (Goode & Bean 1895) |
0.2285 |
0.3842 |
0.1353 |
905.5-1 499 |
|
Rhinochimaeridae |
Rhinochimaera pacifica (Mitsukuri 1895) |
0.0057 |
0.0265 |
0.2706 |
900-1 225 |
|
Sciaenidae |
Cynoscion albus (Günther 1864) |
0.0057 |
0.0004 |
0.1353 |
833.5 |
|
Sciaenidae |
Cynoscion nannus (Castro-Aguirre & Arvizu-Martínez 1976) |
3.3358 |
0.1237 |
1.6238 |
105.5-183.5 |
|
Sciaenidae |
Cynoscion reticulatus (Günther 1864) |
0.0857 |
0.0083 |
0.1353 |
105.5 |
|
Sciaenidae |
Larimus gulosus (Hildebrand 1946) |
0.0114 |
0.0004 |
0.1353 |
105.5 |
|
Sciaenidae |
Nebris occidentalis (Vaillant 1897) |
1.0053 |
0.0097 |
0.2706 |
945-1 414 |
|
Sciaenidae |
Stellifer mancorensis (Chirichigno 1962) |
0.0057 |
0.0006 |
0.1353 |
779 |
|
Sciaenidae |
Stellifer minor (Tschudi 1846) |
0.0857 |
0.0551 |
0.1353 |
1 414 |
|
Sciaenidae |
Umbrina bussingi (López S. 1980) |
0.0457 |
0.0034 |
0.4060 |
133.5-138.5 |
|
Scopelarchidae |
Scopelarchoides nicholsi (Parr 1929) |
0.0057 |
0.0003 |
0.1353 |
1 081 |
|
Scorpaenidae |
Pontinus furcirhinus (Garman 1899) |
0.0228 |
0.0028 |
0.1353 |
148 |
|
Scorpaenidae |
Pontinus sierra (Gilbert 1890) |
0.0457 |
0.0977 |
0.4060 |
122-155 |
|
Scyliorhinidae |
Cephalurus cephalus (Gilbert 1892) |
0.0114 |
0.0002 |
0.1353 |
668.5 |
|
Serivomeridae |
Serrivomer sector (Garman, 1899) |
0.1714 |
0.0554 |
0.8119 |
103-1 527 |
|
Serranidae |
Baldwinella eos (Gilbert 1890) |
1.1767 |
0.0681 |
1.8945 |
115-145 |
|
Serranidae |
Diplectrum euryplectrum (Jordan & Bollman 1890) |
3.0788 |
0.8433 |
1.6238 |
57-150 |
|
Serranidae |
Hemanthias peruanus (Steindachner 1875) |
0.3599 |
0.0031 |
0.1353 |
105.5 |
|
Serranidae |
Hemanthias signifer (Garman 1899) |
5.9976 |
1.7633 |
0.5413 |
113-183 |
|
Serranidae |
Hyporthodus acanthistius (Gilbert 1892) |
0.0057 |
0.0002 |
0.1353 |
409 |
|
Serranidae |
Hyporthodus niphobles (Gilbert & Starks 1897) |
0.0400 |
0.3115 |
0.2706 |
127-143 |
|
Serranidae |
Paralabrax callaensis (Starks 1906) |
0.0057 |
0.0002 |
0.1353 |
138.5 |
|
Serranidae |
Serranus aequidens (Gilbert 1890) |
2.7189 |
7.7374 |
1.8945 |
128-183 |
|
Sternoptychidae |
Sternoptyx diaphana (Hermann 1781) |
0.0286 |
0.0003 |
0.5413 |
197.5-1 225.5 |
|
Stomiidae |
Stomias atriventer (Garman 1899) |
0.3142 |
0.0188 |
2.7064 |
614-1 450 |
|
Stromateidae |
Peprilus medius (Peters 1869) |
5.1351 |
35.6707 |
1.2179 |
109-114 |
|
Stromateidae |
Peprilus snyderi (Gilbert & Starks 1904) |
4.8266 |
12.4856 |
2.0298 |
109-145 |
|
Stromateidae |
Stomias colubrinus (Garman 1899) |
0.7254 |
0.0470 |
0.1353 |
433.5-1 577.5 |
|
Stromateidae |
Stromateus stellatus (Cuvier 1829) |
0.0114 |
0.0098 |
0.1353 |
491.5 |
|
Synodontidae |
Synodus evermanni (Jordan & Bollman 1890) |
2.5076 |
0.9303 |
0.2706 |
105.5-114 |
|
Torpedinidae |
Torpedo peruana (Chirichigno F. 1963) |
0.0057 |
0.0001 |
0.1353 |
779 |
|
Trachichthyidae |
Hoplostethus mento (Garman 1899) |
2.6389 |
0.4354 |
2.0298 |
108-1 119.5 |
|
Triakidae |
Mustelus dorsalis (Gill 1864) |
0.0171 |
0.0896 |
0.1353 |
240 |
|
Triakidae |
Mustelus henlei (Gill 1863) |
0.2342 |
0.1836 |
0.5413 |
122-1 369 |
|
Trichiuridae |
Trichiurus lepturus (Linnaeus 1758) |
1.7707 |
0.0114 |
1.8945 |
103.5-1 369 |
|
Trichiuridae |
Trichiurus nitens (Garman 1899) |
0.0171 |
0.0087 |
0.5413 |
614-1 023 |
|
Triglidae |
Bellator loxias (Jordan 1897) |
0.1599 |
0.0168 |
0.8119 |
105.5-1 369 |
|
Triglidae |
Prionotus ruscarius (Gilbert & Starks 1904) |
0.5655 |
0.0175 |
0.9472 |
108-1 369 |
|
Triglidae |
Prionotus stephanophrys (Lockington 1881) |
0.7883 |
0.6487 |
0.8119 |
103.5-113.5 |
|
Uranoscopidae |
Kathetostoma averruncus (Jordan & Bollman 1890) |
0.7026 |
0.1271 |
0.5413 |
105.5-148 |
|
Zeidae |
Zenopsis conchifer (Lowe 1852) |
0.0057 |
0.0012 |
0.1353 |
164.5 |
|
Zoarcidae |
Bentartia pusillum (Bean 1890) |
0.0628 |
0.0014 |
1.7591 |
407.5-1 527.5 |
|
Zoarcidae |
Bothrocara molle (Bean 1890) |
0.0571 |
0.1064 |
1.7591 |
928-1 309.5 |
|
Zoarcidae |
Lycodonus flagellicauda (Jensen 1902) |
0.0057 |
0.0106 |
0.1353 |
941.5 |
La biomasa total fue de 11 278.18 kg. El 88.34% correspondió a peces óseos (9963.11 kg), representados, principalmente, por Peprilus medius (35.67%), Peprilus snyderi (12.49%) y Merluccius angustimanus (9.20%). Estas 3 especies sumaron el 57.35% del total de biomasa capturada (6468.21 kg). El grupo de los condrictios aportó un 11.66% (1315.06 kg) con Rhinoptera steindachneri como principal contribuyente (9.45%). Entre los 100 y 400 m de profundidad, se capturaron las especies más abundantes. Solo la captura de M. angustimanus se extendió a profundidades mayores (700 m). En el Cuadro 2, se encuentran los valores promedio de la temperatura y la salinidad, según los estratos de profundidad y el número de especies. La mayor cantidad de especies se encontró en el estrato menos profundo (0-400 m), caracterizado por tener las mayores temperaturas y las salinidades más bajas.
Cuadro 2. Valores promedio de temperatura y salinidad según estrato y número de especies
Table 2. Average values of temperature and salinity according to stratum and number of species
|
Estrato (m) |
Especies |
T (°C) |
S (PSU) |
|
I (0-400) |
93 |
17.73 |
32.50 |
|
II (400-800) |
67 |
7.63 |
34.60 |
|
III (800-1 200) |
87 |
5.02 |
34.57 |
|
IV (1 200-1 600) |
59 |
3.36 |
34.59 |
El primer lugar de la frecuencia de especies por muestreo lo ocuparon Peristedion barbiger y Stomias atriventer (2.7%), seguido de Avocettina bowersii, Apristurus kampae y Zalieutes elater (2.4%); el tercer lugar le correspondió a Hydrolagus macrophthalmus, Notacanthus spinosus, Dicrolene filamentosa y Platytroctes apus (2.3%)
Los valores más altos de diversidad se encontraron entre el Pacífico Central de Costa Rica y la península de Azuero en Panamá, mientras que los más bajos se observan frente a la costa de Nicaragua (Fig. 3). La equidad tuvo valores relativamente uniformes en toda la región estudiada, con variaciones entre 0.81 y 0.97. Las zonas con mayores valores de equidad se localizaron frente a las costas de El Salvador y el golfo de Panamá.
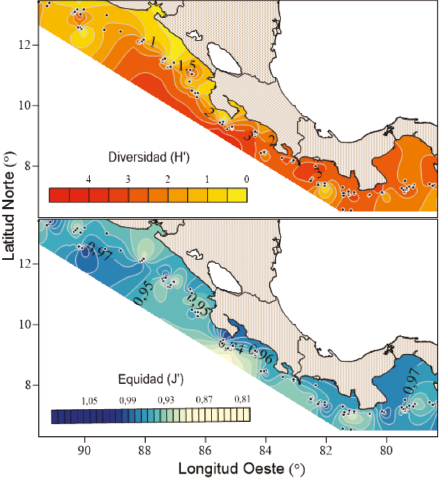
Fig. 3. Distribución espacial de los índices de diversidad (H’) y equidad (J’)
Fig. 3. Spatial distribution of diversity (H’) and evenness (J’) indexes
El análisis de conglomerados relacionado con la profundidad generó una segregación de 3 grupos principales, por lo que se pudo corroborar la influencia de esta variable sobre la riqueza de especies, según la prueba de PERMANOVA (R = 0.54, P > 0.05) (Fig. 4).
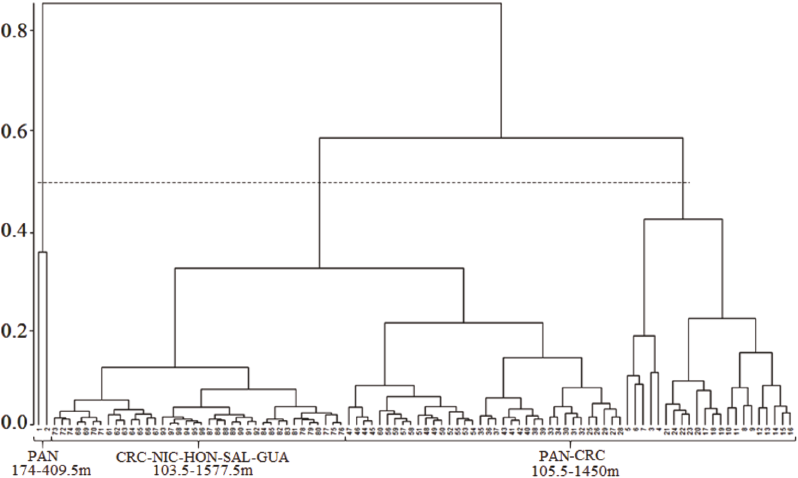
Fig. 4. Dendrograma de las estaciones de muestreo utilizando la similaridad de Bray-Curtis. La línea punteada muestra el 50% de similaridad donde se definen 3 ensamblajes
Fig. 4. Dendrogram of trawl stations using group-average clustering from Bray-Curtis similarity. The upper dotted line indicates groups at 50% level of similarity showing 3 different assemblages
El análisis canónico de correspondencia permitió determinar la influencia de las variables físicas temperatura (˚C) y salinidad (PSU), así como de la profundidad (m) sobre la distribución de las diferentes especies y grupos de especies (Fig. 5).

Fig. 5. Análisis de correspondencia canónica en 2 dimensiones. Se muestra en líneas de magnitud la temperatura (C), salinidad (PSU) y profundidad (m) de cada estación. Abreviaturas de las especies: Dicrolene filamentosa (Dfi), Bathypterois atricolor (Bat), Hemanthias signifer (His), Peprilus medius (Pme), Zalieutes elater (Zel), Peprilus snyderi (Psn), Argentina aliceae (Aal), Cynoscion nannus (Can), Diplectrum euryplectrum (Deu), Cherublemma emmelas (Cem), Coryphaenoides carminifer (Cca), Serranus aequidens (Sae), Hoplostethus mento (Hme), Coryphaenoides anguliceps (Can), Synodus evermanni (Sev), Bathypterois ventralis (Bve), Nezumia convergens (Nco), Coelorinchus canus (Cca), Trichiurus lepturus (Tle), Venefica tentaculata (Vte), Scopelengys tristis (Str), Nezumia liolepis (Nli), Baldwinella eos (Beo), Hippoglossina bollmani (Hbo), Monolene dubiosa (Mdu) y Nebris occidentalis (Noc)
Fig. 5. Two dimension plot of the analysis of canonical correspondence. The temperature (C), salinity (PSU), and depth (m) of each station are shown in lines of magnitude. Species abbreviations: Dicrolene filamentosa (Dfi), Bathypterois atricolor (Bat), Hemanthias signifer (His), Peprilus medius (Pme), Zalieutes elater (Zel), Peprilus snyderi (Psn), Argentina aliceae (Aal), Cynoscion nannus (Can), Diplectrum euryplectrum (Deu), Cherublemma emmelas (Cem), Coryphaenoides carminifer (Cca), Serranus aequidens (Sae), Hoplostethus mento (Hme), Coryphaenoides anguliceps (Can), Synodus evermanni (Sev), Bathypterois ventralis (Bve), Nezumia convergens (Nco), Coelorinchus canus (Cca), Trichiurus lepturus (Tle), Venefica tentaculata (Vte), Scopelengys tristis (Str), Nezumia liolepis (Nli), Baldwinella eos (Beo), Hippoglossina bollmani (Hbo), Monolene dubiosa (Mdu) and Nebris occidentalis (Noc)
DISCUSIÓN
La tendencia asintótica de las dos curvas a partir de 20 sitios de muestreo observado en la Figura 2 evidencia la robustez del método de recolección. Sin embargo, el estudio de patrones regionales de riqueza de especies, a través de ensamblajes, según Clauson‐Kaas et al. (2017) requiere muestreos largos y estandarizados, por lo cual es recomendable continuar con la recolección de datos, similar a la efectuada en esta oportunidad, en aras de aumentar el conocimiento de la dinámica ecológica y su interacción con el ambiente.
Entre las especies más abundantes de peces óseos (Cuadro 1), destacan 3 de aguas profundas de poco valor comercial: D. filamentosa, la cual ha sido reportada como una de las dominantes en otros estudios (Kameya et al. 2006); B. atricolor y B. ventralis, ambas pertenecientes a la familia Ipnopidae, reportadas previamente por Cruz-Acevedo et al. (2017), quienes estudiaron su distribución en el Pacífico Central junto con otros miembros del género Bathypterois, y H. signifer, que forma parte de la fauna acompañante en la pesca de arrastre de camarón en la costa pacífica de Colombia, pero que no representa una especie objetivo (Puentes et al. 2007).
Etmopterus benchleyi es la especie del grupo de los condrictios que resultó más abundante (905.5-1 469.5 m). Vásquez et al. (2015) la reportaron por primera vez como una nueva especie de tiburón linterna en el Pacífico centroamericano. Los especímenes analizados en dicho estudio son los mismos del presente trabajo. Su identificación fue realizada en el Instituto Smithsonian en Washington, Estados Unidos, donde permanecen como parte de la colección de peces del Museo Nacional de Historia Natural de tal Instituto.
Adicionalmente, en esta investigación, se encontraron especies, más que todo, de peces óseos que figuran como objetivo de muchas de las pesquerías comerciales desarrolladas alrededor del mundo (Cuadro 1). En este sentido, especies de las familias Trichiuridae, Oreosomatidae, Bericidae y Trachichthyidae, esta última con la presencia de Hoplostethus mento y H. atlanticus, son importantes en las pesquerías mundiales de profundidad (Norse et al. 2012).
Peprilus medius es una especie de alto interés comercial en pesquerías costeras en el golfo de California, México (Maldonado-Amparo et al. 2017) y fue, junto con su congénero P. snyderi y M. angustinanus, importante contribuidora de la biomasa total en el presente estudio. En el nivel de familias, Macrouridae (10), Sciaenidae (8) y Serranidae (8) destacan en cuanto a diversidad de especies, todas con representantes conocidos de relevancia ecológica y económica. Estos resultados complementan los obtenidos en otras investigaciones realizadas en el área (Mora & Robertson, 2005; Dominici-Arosemena & Wolff, 2006; Puentes et al. 2007; Rodríguez-Romero et al. 2008; Friedlander et al. 2012 y Robertson et al. 2017). Como era de esperar, las mayores biomasas se obtuvieron en los estratos más someros. Al aumentar la profundidad, las condiciones ambientales son menos propicias para el desarrollo de muchas especies, como lo evidenciaron Acevedo-Cervantes et al. (2009). Otro factor importante en estos ambientes demersales, que podría limitar las biomasas de algunas especies, es la disponibilidad de alimento, la cual disminuye conforme aumenta la profundidad (Carney, 2005).
Las zonas de mayor equidad (J’) y diversidad (H’) (Fig. 3) se localizaron frente a la costa de Nicaragua, frente al golfo de Nicoya en Costa Rica y en el golfo de Chiriquí en Panamá. Todas estas regiones se encuentran fuertemente influenciadas por los afloramientos estacionales localizados en el golfo de Panamá y en el golfo de Papagayo, los cuales propician una alta diversidad en el nivel costero (Robertson & Cramer, 2009). Los resultados obtenidos sugieren que la riqueza de especies no varía considerablemente en la región del istmo, coincidiendo con otros estudios biogeográficos en la misma zona tropical costera (Mora & Robertson, 2005; Robertson & Cramer, 2009). Esta característica ha sido reportada como típica de las áreas ubicadas dentro de la Gran Provincia Panámica (Dominici-Arosemena & Wolff, 2006; Spalding et al. 2012).
La profundidad es un factor que posee una influencia importante en las comunidades de peces demersales (Powell et al. 2003; Carney, 2005; Páramo et al. 2012). En este trabajo, se identificaron 3 ensamblajes relacionados con el gradiente vertical batimétrico. El primero de ellos está representado por pocas especies, presentes entre los 174 y 409 m de profundidad cerca de Panamá, y compuesto, principalmente, por 2 grupos funcionales: las especies costeras de fondos blandos y las oceánicas. Estos resultados son muy similares a los obtenidos por Robertson & Cramer (2009). Otro ensamblaje se determinó a profundidades entre los 105 y 1450 m, coincidiendo con la zona de mayor diversidad, y está representado por la mayoría de las especies ubicadas también en Panamá. Finalmente, el último ensamblaje incluye la zona muestreada entre Costa Rica y Guatemala, constituido, primordialmente, por peces de naturaleza oceánica.
Adicionalmente, en la columna de agua, los organismos también pueden ser segregados en relación con variables físicas como la temperatura y la salinidad, las cuales influyen en la biogeografía y riqueza de las especies (Powell et al. 2003; León-Chávez et al. 2010). La asociación de especies con dichas variables se visualiza en el CCA (Fig. 5). Estos organismos demersales se agrupan influenciados por la temperatura, en primer lugar, y luego por la salinidad. M. dubiosa se aleja un poco de los patrones establecidos para estas 2 variables. Según Carney (2005), la temperatura del agua es el factor que mayor influencia tiene, cuando se buscan las causas de la distribución de los organismos en la profundidad, principalmente, debido a su alta importancia sobre los procesos fisiológicos de ellos. Conforme aumenta la profundidad en la columna de agua, los valores de temperatura de esta disminuyen, mientras que los de salinidad aumentan (Cuadro 2).
El análisis realizado en el presente trabajo aborda el tema de la investigación de peces demersales desde una perspectiva nueva para el Pacífico centroamericano. En ella, se aprovecha un conjunto de datos para documentar sus patrones de abundancia, biomasa, estructura e interacción con el entorno oceanográfico de la citada región. En el caso de los ensamblajes, contar con una línea base es fundamental para evaluar las posibles variaciones de las poblaciones, en respuesta a las características hidrográficas presentes en la columna de agua (Clark et al. 2010), al clima, a la eutrofización y a otros factores antropogénicos (Magurran & Henderson, 2010; Paller, 2018).
REFERENCIAS
Acevedo-Cervantes, A., López-Martínez, J., Herrera-Valdivia, E. & Rodríguez-Romero, J. (2009). Análisis de la abundancia, dominancia y diversidad de la comunidad de peces demersales de profundidad de 90 a 540 metros en el Golfo de California, México. Interciencia, 34(9), 660-665.
Aguilar-Palomino, B., Mariscal-Romero, J., González-Sanson, G. & Rodríguez-Ibarra, L. E. (1996). Ictiofauna demersal de fondos blandos de la plataforma continental de Jalisco y Colima, México, en la primavera de 1995. Cien Mar., 22(4), 469-481.
Amador, J. A. (2008). The intra Americas sea low level jet. An. NY. Acad. Scien., 1146(1), 153-188.
Amador, J. A., Rivera, E. R., Durán, Q. A. M., Mora, G., Sáenz, F., Calderón, B. & Mora, N. (2016). The easternmost tropical Pacific. Part I: A climate review. Rev. Biol. Trop., 64 (1), 1-22. https://doi.org/10.15517/rbt.v64i1.23407
Arana, P., Álvarez, P. J. A. & Pezzuto, P. R. (2009). Deep-sea fisheries off Latin America: an introduction. Lat. Am. J. Aquat. Res., 37(3), 281-284.
Barange, M., Bahri, T., Beveridge, M., Cochrane, K., Funge-Smith, S. & Poulain, F. (2018). Impacts of climate change on fisheries and aquaculture - Synthesis of current knowledge, adaptation and mitigation options. Fisheries and Aquaculture Technical Paper. No. 627. Italy: FAO.
Benavides, M. R. & Campos, C. F. (2019). Abundance, biomass and distribution of demersal fish of the Caribbean Sea of Central América. Uniciencia, 33(1), 1-17. https://doi.org/10.15359/ru.33-1.1
Bianchi, G. (1991). Demersal assemblages of the continental shelf and slope edge between the Gulf of Tehuantepec (Mexico) and the Gulf of Papagayo (Costa Rica). Mar. Ecol. Prog. Ser., 73, 121-140. https://doi.org/10.3354/meps073121
Carney, R. (2005). Zonation of deep biota on continental margins. Oceanogr. Mar. Biol., 43, 211-78. https://doi.org/10.1201/9781420037449.ch6
Carpenter, K. E. & Niem, V. H. (1999a). FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. Volume 3. Batoid fishes, chimaeras and bony fishes part 1 (Elopidae to Linophrynidae) (pp. 1397-2068). Italy: FAO.
Carpenter, K. E. & Niem, V. H. (1999b). FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. Volume 4. Bony fishes part 2 (Mugilidae to Carangidae) (pp. 2069-2790). Italy: FAO.
Carpenter, K. E. & Niem, V. H. (2001a). FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. Volume 5. Bony fishes part 3 (Menidae to Pomacentridae) (pp. 2791-3380). Italy: FAO.
Carpenter, K. E. & Niem, V. H. (2001b). FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. Volume 6. Bony fishes part 4 (Labridae to Latimeriidae), estuarine crocodiles, sea turtles, sea snakes and marine mammals (pp. 3381-4218). Italy: FAO.
Clark, M. R., Althaus, F., Williams, A., Niklitschek, E., Menezes, G. M., Hareide, N. R., Sutton, P. & O’Donnell, C. (2010). Are deep-sea demersal fish assemblages globally homogenous? Insights from seamounts. Mar. Ecol., 31(1), 39-51. https://doi.org/10.1111/j.1439-0485.2010.00384.x
Clarke, T. M., Espinoza, M., Ahrens, R. & Wehrtmann, I. S. (2016). Elasmobranch by catch associated with the shrimp trawl fishery off the Pacific coast of Costa Rica, Central America. Fish. Bull., 114(1), 1-17. https://doi.org/10.7755/FB.114.1.1
Clauson-Kaas, S., Richardson, K., Rahbek, C. & Holt, B. G. (2017). Species-specific environmental preferences associated with a hump-shaped diversity/temperature relationship across tropical marine fish assemblages. J. Biog., 44(10), 2343-2353. https://doi.org/10.1111/jbi.13044
Cruz-Acevedo, E., Betancourt-Lozano, M. & Aguirre-Villaseñor, H. (2017). Distribution of the deep-sea genus Bathypterois (Pisces: Ipnopidae) in the Eastern Central Pacific. Rev. Biol. Trop., 65(1), 89-101. https://doi.org/10.15517/rbt.v65i1.23726
Dominici-Arosemena, A. & Wolff, M. (2006). Reef fish community structure in the Tropical Eastern Pacific (Panamá): living on a relatively stable rocky reef environment. Helgoland Mar Res., 60(4), 287. https://doi.org/10.1007/s10152-006-0045-4
FAO. (2018). The State of World Fisheries and Aquaculture 2018 - Meeting the sustainable development goals. Italy: FAO.
Fricke, R., Eschmeyer, W. N. & Van der Laan, R. (2017). Eschmeyer’s catalog of fishes: genera, species, references. http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp
Friedlander, A. M., Zgliczynski, B. J., Ballesteros, E., Aburto-Oropeza, O., Bolaños, A. & Sala, E. (2012). The shallow-water fish assemblage of Isla del Coco National Park, Costa Rica: structure and patterns in an isolated, predator-dominated ecosystem. Rev. Biol. Trop., 60, 321-338.
Kameya, A., Romero, M. & Zacarías, S. (2006). Peruvian deep ocean potential resources: fishes and shrimps. Deep-sea 2003: Conference on the Governance and Management of Deep-sea Fisheries. Part 2: Conference poster papers and workshop papers. FAO Fisheries Proceedings., 3(2), 40-41.
Kikuchi, K. & Wang, B. (2008). Diurnal precipitation regimes in the global tropics. J. Clim., 21(11), 2680-2696.
Lavín, M. F., Fiedler, P. C., Amador, J. A., Ballance, L. T., Farber-Lorda, J. & Mestas-Núñez, A. M. (2006). A review of eastern tropical Pacific oceanography: Summary. Prog Oceanogr., 69, 391-398. https://doi.org/10.1016/j.pocean.2006.03.005
León-Chávez, C. A., Sánchez-Velasco, L., Beier, E., Lavín, M. F., Godínez, V. M. & Färber-Lorda, J. (2010). Larval fish assemblages and circulation in the Eastern Tropical Pacific in Autumn and Winter. J. Plankton. Res., 32(4), 397-410. https://doi.org/10.1093/plankt/fbp138
López, E. A. (2016). Cambio climático y recursos Marinos. Rev. Cien. Tec., 18, 3-12.
Magurran, A. E. & Henderson, P. A. (2010). Temporal turnover and the maintenance of diversity in ecological assemblages. Philosophical Transactions of the Royal Society of London. Biol Sci., 365(1558), 3611-3620.
Maldonado, T., Alfaro, E. J. & Hidalgo, H. G. (2018). A review of the main drivers and variability of Central America’s Climate and seasonal forecast systems. Rev. Biol. Trop., 66(1), 153-175. https://doi.org/10.4067/S0717-95022017000100011
Maldonado-Amparo, M., Sánchez-Cárdenas, R., Salcido-Guevara, L. A. & Ramírez-Pérez, J. S. (2017). Gonadal Development of Peprilus medius (Peters, 1869) (Perciformes: Stromateidae) from Southeast of the Gulf of California, Mexico. Int. J. Morphol., 35(1), 56-61.
Mora, C. & Robertson, D. R. (2005). Causes of latitudinal gradients in species richness: a test with fishes of the Tropical Eastern Pacific. Ecol., 86(7), 1771-1782.
Morato, T., Cheung, W. W. L. & Pitcher, T. J. (2006). Vulnerability of sea mount fish to fishing: fuzzy analysis of life history attributes. J. Fish. Biol., 68, 209-221. https://doi.org/10.1111/j.0022-1112.2006.00894.x
Norse, E. A., Brooke, S., Cheung, W. W., Clark, M. R., Ekeland, I., Froese, R., Gjerde, K., Haedirch, R., Heppell, S., Morato, T., Morgan, L., Pauly, D. & Morgan, L. E. (2012). Sustainability of deep-sea fisheries. Mar. Policy., 36(2), 307-320. https://doi.org/10.1016/j.marpol.2011.06.008
Paller, M. (2018). Estimating Fish Species Richness across Multiple Watersheds. Diversity, 10(2), 42. https://doi.org/10.3390/d10020042
Páramo, J., Wolff, M. & Saint-Paul, U. (2012). Deep-sea fish assemblages in the Colombian Caribbean Sea. Fish Res., 125-126, 87-98. https://doi.org/10.1016/j.fishres.2012.02.011
Powell, M. S., Haedrich, L. R. & McEachran, D. J. (2003). The deepsea demersal fish fauna of the northern Gulf of Mexico. J. Norhw. Atl. Fish. Sci., 31, 19-33. https://doi.org/10.2960/J.v31.a2
Puentes, V., Madrid, N. & Zapata, L. A. (2007). Catch composition of the deep sea shrimp fishery (Solenocera agassizi Faxon, 1893; Farfantepenaeus californiensis Holmes, 1900 and Farfantepenaeus brevirostris Kingsley, 1878) in the Colombian Pacific Ocean. Gayana., 71(1), 84-95. https://doi.org/10.4067/S0717-65382007000100009
Ramírez-Llodra, E., Tyler, P. A., Baker, M. C., Bergstad, O. A., Clark, M. R., Escobar, E. & Van Dover, C. L. (2011). Man and the last great wilderness: human impact on the deep sea. PLoS One, 6(8), e22588. https://doi.org/10.1371/journal.pone.0022588
R Core Team. (2018). R: A Language and Environment for Statistical Computing. Austria: R Foundation for Statistical Computing.
Robertson, D. R. & Cramer, K. L. (2009). Shore fishes and biogeographic subdivisions of the Tropical Eastern Pacific. Mar. Ecol. Prog. Ser., 380, 1-17. https://doi.org/10.3354/meps07925
Robertson, D. R., Angulo, A., Baldwin, C. C., Pitassy, D., Driskell, A., Weigt, L. & Navarro, I. J. (2017). Deep-water bony fishes collected by the B/O Miguel Oliver on the shelf edge of Pacific Central America: an annotated, illustrated and DNA-barcoded checklist. Zootaxa., 4348(1), 1-125.
Rojas, P. A. & Zapata, P. L. A. (2006). Peces demersales del Parque Nacional Natural Gorgona y su área de influencia, Pacífico colombiano. Biota Colombiana., 7(2), 211-244.
Rodríguez-Romero, J., Palacios-Salgado, D. S., López-Martínez, J., Hernández-Vázquez, S. & Ponce-Díaz, G. (2008). Composición taxonómica y relaciones zoogeográficas de los peces demersales de la costa occidental de Baja California Sur, México. Rev. Biol. Trop., 56(4), 1765-1783.
Sasai, Y., Richards, K. J., Ishida, A. & Sasaki, H. (2012). Spatial and temporal variabilities of the chlorophyll distribution in the northeastern tropical Pacific: The impact of physical processes on seasonal and inter annual time scales. J. Mar. Syst., 96, 24-31.
Sherman, K. & Hempel, G. (2008). The UNEP Large Marine Ecosistem Report: A perspective on changing conditions in LMEs of the world’s Regional Seas. UNEP Regional Seas Report and Studies No. 182. Kenya: United Nations Environment Programme.
Spalding, M. D., Agostini, V. N., Rice, J. & Grant, S. M. (2012). Pelagic provinces of the world: a biogeographic classification of the world’s surface pelagic waters. Ocean Coast. Manage., 60, 19-30.
Surfer® 13. (2013). Surfer® Contouring and 3D Surface Mapping for Scientists and Engineers, version 13 www.GoldenSoftware.com. EE. UU.: Golden Software, Inc.
Trasviña, A. & Barton, E. D. (2008). Summer circulation in the Mexican tropical Pacific. Deep Sea Res., 55(5), 587-607.
Ugland, K. I., Gray, J. S. & Ellingsen, K. (2003). The species-accumulation curve of estimation of species richness. J. Anim. Ecol., 72, 888-897. https://doi.org/10.1046/j.1365-2656.2003.00748.x
Vásquez, V., Ebert, D. & Long, D. (2015). Etmopterus benchleyi n. sp., a new lanternshark (Squaliformes: Etmop-teridae) from the central eastern Pacific Ocean. J. Ocean Scie. Found., 43, 43-55.
Watson, R. A. & Morato, T. (2013). Fishing down the deep: Accounting for within-species changes in depth of fishing. Fish. Res., 140, 63-65. https://doi.org/10.1016/j.fishres.2012.12.004
Wehrtmann, I. S. & Nielsen, M. V. (2009). The deepwater fishery along the Pacific coast of Costa Rica, Central America. Lat. Am. J. Aquat. Res., 37(3), 543-554. https://doi.org/10.3856/vol37-issue3-fulltext-19
Wehrtmann, I. S., Arana, P. M., Barriga, E., Gracia, A. & Pezzuto, P. R. (2017). Deep-water shrimp fisheries in Latin America: a review. Lat. Am. J. Aquat. Res., 40(3), 497-535. https://doi.org/103856/vol40-issue3-fulltext-2
Willett, C. S., Leben, R. R. & Lavín, M. F. (2006). Eddies and tropical instability waves in the eastern tropical Pacific: A review. Prog. Oceanogr., 69(2-4), 218-238. https://doi.org/10.1016/j.pocean.2006.03.010
Zapata, F. A. & Robertson, D. R. (2007). How many species of shore fishes are there in the Tropical Eastern Pacific? J. Biogeogr., 34(1), 38-51. https://doi.org/10.1111/j.1365-2699.2006.01586.x
1 Servicio Regional de Información Oceanográfica (SERIO). Universidad Nacional, 86-3000, Heredia, Costa Rica; rosario.benavides.morera@una.cr* ORCID: https://orcid.org/0000-0002-8570-8280, alocc13@gmail.com ORCID: https://orcid.org/0000-0002-8570-8280, mauro.vargas.hernandez@una.cr ORCID: https://orcid.org/0000-0002-7014-7054




