Rev. Mar. Cost. ISSN 1659-455X. Vol. 3: 139-152, Diciembre 2011.
DOI: https://doi.org/10.15359/revmar.3.11
DIVERSIDAD Y ABUNDANCIA DE LAS ESPONJAS
DE LOS BAJOS DE SANCHO PARDO,
ARCHIPIÉLAGO DE LOS COLORADOS, CUBA
DIVERSITY AND ABUNDANCE OF SPONGES IN
BAJOS DE SANCHO PARDO, LOS COLORADOS ARCHIPELAGO, CUBA
Daril de la Nuez Hernández1*, Linnet Busutil 2 y Alejandro Pérez-Angulo1
1 Acuario Nacional de Cuba, Ave. 1ra. y 60, Playa, CP 11300, La Habana, Cuba.
2 Instituto de Oceanología, Ave. 1ra., No. 18406, Flores, Playa, CP 11600, La Habana, Cuba. *darildelanuez@gmail.com
Recibido 27-IV-2011
Aceptado 22-IX-2011
RESUMEN
Se establecieron 12 estaciones de muestreo en perfiles batimétricos (5, 10 y 15 m) de cinco sitios ubicados en los Bajos de Sancho Pardo, Archipiélago de Los Colorados, región noroccidental de Cuba. Se empleó el marco cuadrado de 1 m de lado como unidad de muestreo, el cual se colocó aleatoriamente en 30 posiciones por estación. Fueron identificadas 50 especies de esponjas de la clase Demospongiae, distribuidas en 33 géneros, 10 órdenes y 22 familias. En las estaciones más someras predominó la especie Cliona aprica, mientras que en las más profundas lo hicieron Aplysina cauliformis, A. fistularis forma insularis e Ircinia felix. La riqueza de especies fue mayor en las estaciones más profundas. El índice de contaminación, calculado a partir de las abundancias de las esponjas indicadoras de este factor, no fue alto. La densidad de esponjas mostró diferencias significativas entre estaciones, pero no fue particularmente alta en la región, al parecer debido al estrés provocado por el fuerte oleaje durante los frentes fríos invernales y los frecuentes e intensos ciclones que afectan a esa región.
Palabras claves: Comunidades de esponjas, diversidad, abundancia, Los Colorados, Cuba.
ABSTRACT
Twelve sampling stations were established with bathymetric profiles (5, 10 and 15 m) in five locations in Bajos de Sancho Pardo, Los Colorados Archipelago, north-western region of Cuba. A 1x1m square quadrant was used as a sampling unit, with 30 quadrants being sampled per station. Fifty species of sponges were identified belonging to class Demospongiae, distributed in 33 genera, 10 orders and 22 families. In the shallowest stations the prevailing species was Cliona aprica, while Aplysina cauliformis, A. fistularis f. insularis and Ircinia felix prevailed in the deeper stations. Species richness tended to increase with depth. The contamination index, which was calculated based on the abundance of sponges indicating this factor, was not high. Sponge density showed significant differences between stations; however, it was not particularly high in the region maybe due to the stress induced by strong waves during winter cold fronts and frequent, intense cyclones that affect the region.
Keywords: Sponge communities, diversity, abundance, Los Colorados, Cuba.
INTRODUCCIÓN
Las esponjas poseen propiedades biológicas y ecológicas que las califican como entidades fundamentales en los arrecifes: adaptaciones para una competencia exitosa por el espacio; gran diversidad de especies y abundancia; participación en la producción primaria y en la nitrificación mediante asociaciones simbióticas; capacidad de impactar la estructura de carbonato del arrecife mediante procesos de bioerosión y calcificación, así como capacidad para modificar la columna de agua filtrando y exhalando (Wulff, 2001). Además, se han demostrado relaciones estrechas entre las esponjas y diferentes grupos de organismos como equinodermos (Bejarano et al. 2004; Wulff, 2006), cnidarios (McLean & Yoshioka, 2007; Swain & Wulff, 2007), moluscos (Knowlton & Highsmith, 2005), crustáceos (Saito et al. 2002) y muchas bacterias y algas (Lee et al. 2001; Tronchin et al. 2006), entre otros.
Alcolado (2002) refiere que en aguas cubanas han sido reconocidas 280 especies de esponjas de las aproximadamente 500 especies válidas encontradas en el Gran Caribe, y que al estar moderadamente inventariadas, es posible que aún queden muchas por registrar.
Su condición de animales sésiles, le brinda a este grupo grandes posibilidades de empleo como indicadores del comportamiento temporal de los factores ambientales que afectan a los fondos donde habitan (Alcolado, 1978; 1979). La alta conexidad sistema-ambiente de estos organismos hace que sea factible la interpretación del ambiente mediante el estudio de la estructura ecológica de sus comunidades (Alcolado, 2007). No obstante, y dada la complejidad del ambiente, en ocasiones es muy difícil diferenciar, si las condiciones no favorables para el desarrollo de las comunidades de esponjas están dadas por fenómenos naturales o por el efecto de las actividades humanas (Padilla et al. 1992). En Cuba, las esponjas han sido frecuentemente incluidas en estudios evaluativos de la flora y fauna bentónicas (De la Guardia & González-Sansón, 1997a, b; De la Guardia et al. 2006; González-Díaz et al. 2010), así como empleadas como indicadoras de condiciones ambientales específicas y de contaminación (Alcolado & Herrera-Moreno, 1987; Alcolado, 1992; 2007). También se han evaluado la estructura y la composición de sus comunidades (Alcolado, 1979; 1989; 1999; Caballero et al. 2009), sin embargo, las del extremo noroccidental de Cuba han sido muy poco estudiadas.
En el presente trabajo se estudian la diversidad y la abundancia de las comunidades de esponjas en diferentes sitios y profundidades de los Bajos de Sancho Pardo, Archipiélago de Los Colorados, el más occidental de Cuba y área de frecuente y creciente impacto de huracanes en los últimos años.
En el contexto del cambio climático y sus posibles consecuencias, los huracanes constituyen una amenaza para el grupo. Aunque los efectos son diferentes según las características morfológicas de las especies en cuestión, y aun cuando la fragmentación de los organismos puede favorecer la multiplicación y la renovación de las especies, el aumento en la incidencia, persistencia e intensidad de los huracanes impediría la recuperación de estas comunidades. Otra consecuencia perjudicial sería la resuspensión de sedimentos causada por dichos fenómenos, lo que provoca la tupición de los poros inhalantes de las esponjas, conduce a un mal funcionamiento y termina con la muerte (Alcolado, 1986). Además, los desplazamientos horizontales de sedimentos del fondo provocarían el enterramiento de los individuos y también causarían mortalidad.
El conocimiento de las comunidades bentónicas del área noroccidental de Cuba, y en particular de las esponjas, resulta esencial para comprender, en sucesivos muestreos, el comportamiento y la respuesta de estos ecosistemas ante condiciones ambientales cambiantes.
MATERIALES Y MÉTODOS
Descripción de la zona de estudio
El estudio se realizó en la zona conocida como los Bajos de Sancho Pardo, perteneciente al Archipiélago de Los Colorados y localizada en la región noroccidental de Cuba (Fig. 1).
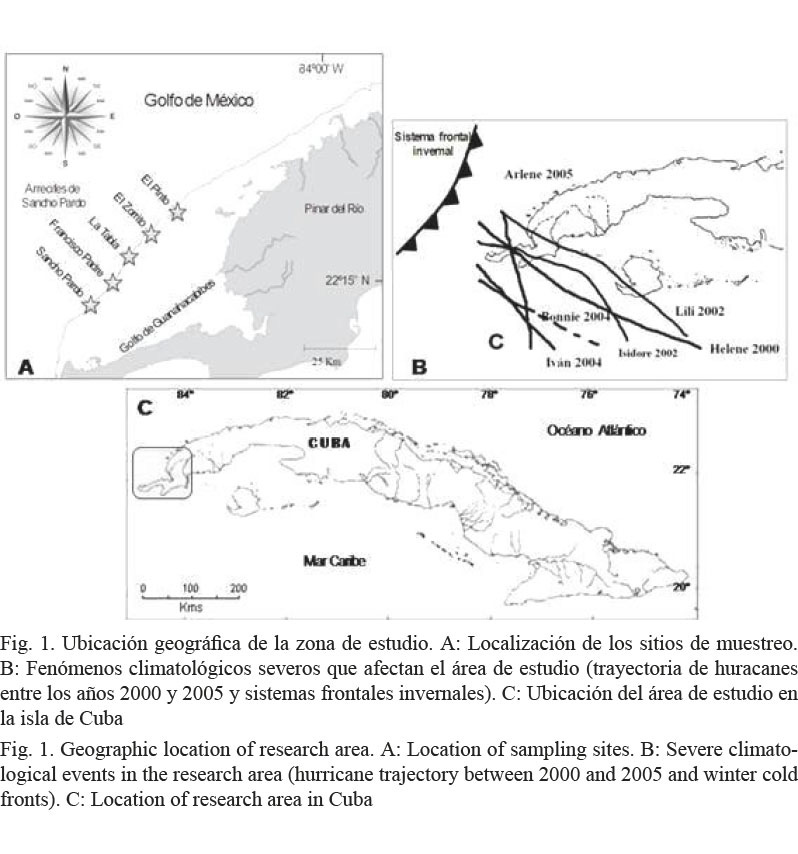
Los vientos predominantes la mayor parte del año son los alisios del nordeste, pero en los meses invernales esta zona sufre el impacto frecuente de los frentes fríos, acompañados a menudo de fuertes marejadas y vientos de región norte y nordeste. No existen signos evidentes de contaminación (González-Sansón et al. 2009) y la eutrofización es baja (Luis-Riera, 1983), dada la lejanía de tierra firme y de las zonas habitadas. Sin embargo, utilizando a las esponjas como bioindicadores ambientales, se podría descartar definitivamente la existencia de alguna fuente de contaminación, dado que no existen datos químicos o microbiológicos actualizados del área estudiada que corroboren su situación ambiental. Esto es posible porque la condición sésil de este grupo de organismos implica su adaptación al medio en que habitan, por lo que las esponjas reflejan en su estructura comunitaria, las condiciones promedio del ambiente. Es importante conocer con certeza el estado ambiental de esta área, para poder estudiar, mediante sucesivos muestreos, la evolución y respuesta de estas comunidades ante condiciones ambientales potencialmente cambiantes.
La zona se caracteriza por la presencia de áreas conocidas como “bajos”, con profundidades entre 1 y 3 m, en algunos de los cuales se desarrollan crestas arrecifales a manera de parches.
Las zonas traseras de los arrecifes se encuentran localizadas al sur y oeste de los bajos, con profundidades de entre 4 y 5 m. Estas áreas se hallan más resguardadas del impacto directo del oleaje y predominan los “arrecifes de cabezos”. El sustrato es fundamentalmente rocoso con parches de arena.
A partir de los 8 m y hasta los 20 m aproximadamente, se encuentran los arrecifes frontales. El fondo en estos sitios presentó una mayor complejidad en el relieve, con presencia de canales y camellones (hasta 15 m de longitud, 2 a 5 m de ancho y 1 m de alto). En estos arrecifes frontales fue notable el desarrollo de las algas de los géneros Dictyota, Lobophora, Sargassum y Microdictyon, mientras que los erizos negros Diadema antillarum fueron escasos.
Metodología de muestreo y procesamiento de datos
Los datos se tomaron en agosto del 2010 mediante buceo autónomo. Los sitios de muestreo fueron, de oeste a este: Sancho Pardo (SP), Francisco Padre (FP), La Tabla (LT), El Zorrito (EZ) y El Pinto (EP), y se realizaron entre dos y tres estaciones por cada sitio (Cuadro 1). Cada estación presentó una profundidad fijada de 5, 10 o 15 m a todo lo largo. Se empleó el marco cuadrado de 1 m de lado como unidad de muestreo. Se colocó aleatoriamente en 30 posiciones por estación, para lo cual, previo al muestreo, se determinó al azar la distancia a la que se colocaría el marco (entre 1 y 3 m) a partir del último marco colocado. Las esponjas se cuantificaron e identificaron in situ para determinar la densidad (individuos/m2) y las especies predominantes en porcentaje de abundancia en número. Para las identificaciones se utilizaron las descripciones de Alcolado (2002), Hooper & Van Soest (2002) y Zea et al. (2009). A partir de las esponjas identificadas se confeccionó una lista de especies, cuya clasificación taxonómica se basó en los criterios de Alcolado (2002).
Se calculó la Riqueza de especies R1 de Margalef (1951) en el programa Primer 5.0 y se determinó el Índice de Contaminación (IC) modificado de Herrera-Moreno & Alcolado (1985), que consiste en la sumatoria de los porcentajes de abundancia relativa de las especies de esponjas indicadoras de contaminación: Clathria venosa, Cliona delitrix e Iotrochota arenosa. Dicho criterio se basó en la relación demostrada de estas especies con la contaminación urbana, según los resultados de Alcolado & Herrera-Moreno (1987), Marcos (2005), Alcolado (2007), Rose & Risk (1985), Ward-Paige et al. (2005) y Chaves-Fonnegra et al. (2007). En la mayoría de estos estudios se confirmó, mediante pruebas químicas y microbiológicas, la presencia de contaminación, lo cual permitió la validación de estas especies como bioindicadoras de dicho factor.
El Índice de Contaminación (IC) es una opción económica y fácil de utilizar en las evaluaciones de los ecosistemas arrecifales. Permite prescindir de los reactivos y equipamientos costosos que tradicionalmente han sido usados en los análisis de la calidad del agua. Además, brinda una información acumulada de la situación ambiental, a diferencia de otros indicadores que reflejan estados instantáneos y, que por ello, exigen series continuas de datos con un mayor esfuerzo de muestreo para obtener resultados confiables.
Los datos obtenidos por estación no cumplieron con la normalidad ni la homogeneidad de varianza, aun con transformaciones, por lo que se compararon mediante el análisis de varianza no paramétrico Kruskal-Wallis. Para determinar entre cuáles estaciones se establecían las diferencias significativas se realizó una prueba Dunn. Estos cálculos se llevaron a cabo mediante los programas Statistica 6.0 y GraphPad InStat 3. Las diferencias estadísticas fueron consideradas con un nivel de significación del 95% (α = 0.05).
RESULTADOS
Fueron identificadas 50 especies de esponjas (solo una especie no pudo ser identificada hasta el nivel específico) (Cuadro 2), pertenecientes a una clase, 10 órdenes, 22 familias y 33 géneros.

Las especies más abundantes fueron: A. cauliformis, A. fistularis f. insularis, I. felix y C. aprica, representando estas cuatro el 60% del total de individuos contados. I. felix fue la única especie encontrada en todas las estaciones, aunque el resto apareció en casi todas (Fig. 2).
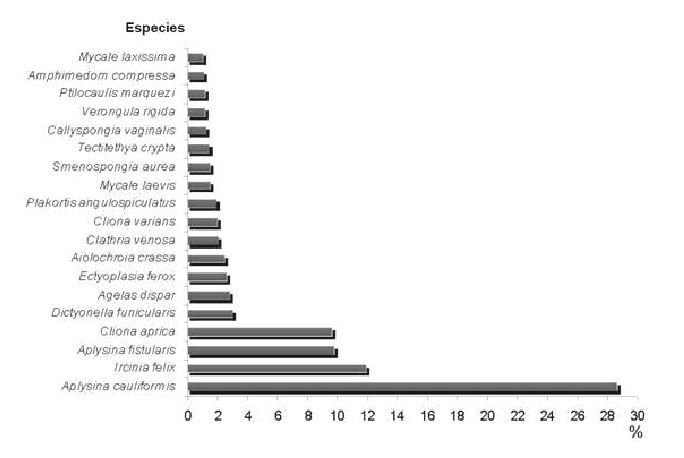
Predominaron los individuos de pequeño tamaño, a excepción de algunas especies incrustantes como C. aprica y C. varians, que en ocasiones sí alcanzaron grandes dimensiones, sobre todo en las estaciones de menor profundidad.
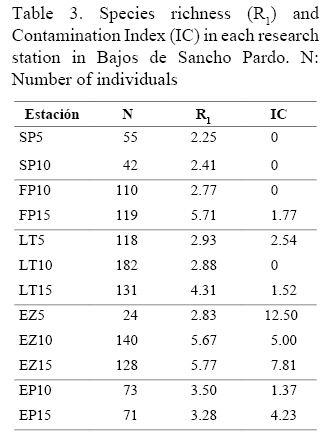
En las estaciones más someras de La Tabla y Sancho Pardo (LT5 y SP5), la especie dominante fue C. aprica, representando el 44% y 65.5%, respectivamente, del total de individuos contados. A la misma profundidad del sitio El Zorrito (EZ5), el número de individuos fue extremadamente bajo y ninguna especie se destacó por su abundancia muy por encima de las demás.
En las estaciones más profundas (10 y 15 m), el predominio recayó en A. cauliformis, A. fistularis f. insularis e I. felix, aunque en El Zorrito (EZ10 y EZ15) también se destacó A. dispar.
El Índice de Contaminación (IC) fue bajo y los mayores valores correspondieron a las estaciones del sitio El Zorrito (EZ5, EZ10 y EZ15; Cuadro 3).
Hubo diferencias significativas en la densidad de esponjas entre las estaciones (H(11, 360) = 121.3418; P < 0.05). Los valores variaron entre 0.8 y 6.1 individuos/m2 y los menores correspondieron a las dos estaciones de Sancho Pardo (SP5 y SP10) y a la estación más somera de El Zorrito (EZ5; Fig. 3).
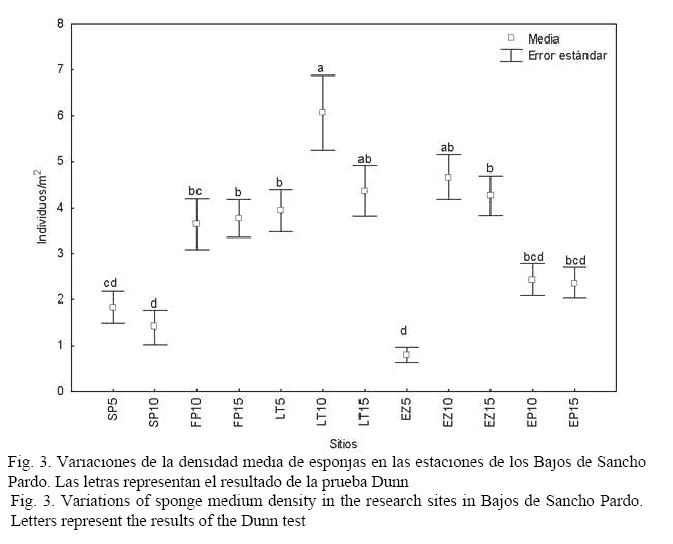
DISCUSIÓN
Es común que con el aumento de la profundidad existan condiciones más propicias para el desarrollo de las comunidades de esponjas, lo cual, según Alcolado (1999), puede darse por la disminución de la turbulencia, una menor intensidad luminosa, menor frecuencia de resuspensión de los sedimentos del fondo y mayor complejidad estructural del sustrato (lo cual facilita el escurrimiento de sedimentos en las porciones salientes y verticales, y diversifica la intensidad de la luz incidente).
En nuestro estudio, al aumentar la profundidad, generalmente se observa un incremento de la riqueza de especies, encontrándose, por tanto, los mayores valores en las estaciones situadas a 15 m. Alcolado & Herrera-Moreno (1987) y Caballero et al. (2009) también registran una tendencia al incremento de la riqueza de especies con la profundidad en las comunidades de esponjas del Rincón de Guanabo y Bahía de Cochinos, respectivamente. Similar resultado obtuvieron González-Díaz (1999) y Díaz & Rützler (2001).
En las estaciones más profundas, la dominancia de especies es menos marcada, aunque se destacan en la mayoría de los casos por su abundancia A. cauliformis y A. fistularis f. insularis. La primera, según Alcolado (2007), aparece asociada a sitios eventualmente sometidos a fuerte oleaje y sedimentación, por lo que era de esperar su dominancia en los arrecifes frontales de esta zona sometida a fuertes frentes fríos y ciclones. Por otro lado, su morfología ramosa, flexible y elástica, es similar a la de A. fulva, características que, según Wulff (1995), son ventajosas para esta especie ante fenómenos extremos. Wulff (2006) plantea que, por lo general, las esponjas con base pequeña sufren mayor daño ante estos fenómenos y las que menos sufren son las especies incrustantes. A. fistularis, según Alcolado & Herrera-Moreno (1987) y Alcolado (2007), es una especie que habita en lugares limpios, y su forma insularis, en particular, resiste la abrasión y resuspensión de sedimentos arenosos; condiciones todas presentes en el área estudiada.
La estación EP10 se caracterizó por presentar una capa de sedimentos arenosos cubriendo toda el área, así como una particular abundancia de la especie Tectitethya crypta, la cual, según Alcolado & Gotera (1985), es común en ambientes sometidos a estrés por sedimentación.
La menor riqueza de especies observadas en SP10, en relación con el resto de las estaciones situadas a 10 m, podría deberse a la presencia de un tapete de algas bastante denso, dominado por los géneros Dictyota y Lobophora, que debió estar disminuyendo la disponibilidad de sustrato para el asentamiento de los reclutas. Quizás, la ausencia de herbívoros, como el erizo Diadema antillarum y de peces loros y barberos, ha propiciado este sobrecrecimiento del fitobentos, dado que es poco probable algún efecto de eutrofización por encontrarse esta área bastante alejada de tierra firme y de asentamientos urbanos.
La baja riqueza de especies de la estación SP5, la más baja del área, podría estar dada por la intensa abrasión que ejerce el oleaje sobre el sustrato, así como la mayor sedimentación y el exceso de iluminación. Este sitio es el único de los muestreados a 5 m de profundidad que se corresponde con el arrecife frontal, por lo que solo especies oportunistas, adaptadas a vivir en ambientes fuertemente influenciados por el oleaje y la sedimentación, pueden establecerse y dominar, en este caso la especie perforante C. aprica. Esta especie, según Alcolado (1989; 1992; 1999) y De la Guardia & González-Sansón (1997a), se observa a menudo en las zonas de embate de los arrecifes de Cuba, donde existe fuerte agitación y frecuente incidencia de ciclones tropicales. Además, abunda en sustratos rocosos y sobre fragmentos de corales muertos y vivos de las especies A. palmata y A. cervicornis, entre otros (Buznego & Alcolado, 1987), encontrándose entre las especies de esponjas incrustantes-excavadoras que se han incrementado recientemente en el Caribe, causando mortalidad en los tejidos de coral (López-Victoria & Zea, 2004; 2005).
En el caso de LT5 se observa, además, un incremento en el número de individuos de I. felix con respecto a las demás estaciones situadas a igual profundidad. Esta especie fue dominante a la misma profundidad (5 m) en una de las estaciones analizadas en el arrecife de Playa Baracoa (Alcolado, 1989). En EZ5, el número de esponjas fue muy bajo y no hubo ninguna especie que se destacara por su abundancia, debido a que el sustrato era mayormente arenoso, lo que no favorece la fijación de este grupo.
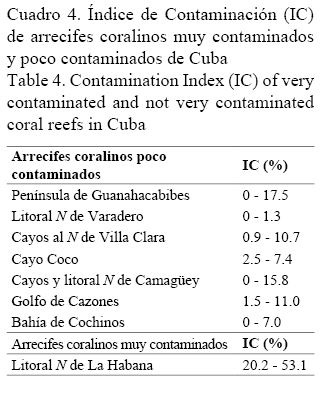
Los bajos valores encontrados del Índice de Contaminación (IC) confirman que este factor no es importante en el área, lo que era de esperarse por encontrarse alejada de los asentamientos poblacionales o de cualquier otra fuente potencial de contaminación. Datos inéditos de los autores demuestran la correspondencia entre dicho índice y el grado de contaminación de los arrecifes coralinos, lo que permite su aplicación como un indicador confiable en el diagnóstico ambiental de los ecosistemas arrecifales (Cuadro 4).
Las bajas densidades encontradas se deben a la ubicación geográfica del área de estudio, la cual es impactada cada año por los sistemas frontales de componente norte que con diferente grado de intensidad inciden durante el período invernal, provocando vientos y marejadas fuertes que necesariamente deben condicionar la estructura de las comunidades de esponjas. Por otro lado, en los últimos 15 años se han incrementado significativamente el número y la intensidad de los ciclones tropicales que afectan el occidente de Cuba, potenciando el efecto abrasivo sobre el lecho oceánico más somero. Este estudio se realizó después del paso por la zona de dos huracanes de moderada intensidad, con un intervalo de tiempo muy pequeño entre ellos.
Nuestros resultados coinciden con los encontrados en Cayo Levisa (Archipiélago de Los Colorados) por De la Guardia et al. (2006), quienes plantean que de los grupos bentónicos estudiados (algas, esponjas, gorgóneas y corales), las esponjas fueron las menos abundantes, con densidades medias para los biotopos de camellones y veriles de 4.13 individuos/10 m, mientras que en los biotopos de crestas (1-3 m) y cabezos (4-8 m), los valores fueron aún menores.
Según Caballero et al. (2009), el sitio más expuesto de los trabajados en Bahía de Cochinos presentó la menor densidad de esponjas del estudio, posiblemente atribuida al paso de un huracán de gran intensidad en el 2001. Por otro lado, Salazar-Vallejo (2002) detectó cambios de importancia en la biomasa y densidad, mayormente de especies blandas y en digitadas erectas que se rompen desde la base tras el paso de los huracanes.
CONCLUSIONES
- La región de los Bajos de Sancho Pardo muestra una elevada riqueza de especies de esponjas. La dominancia en la mayoría de las estaciones de especies resistentes a la resuspensión de sedimentos y al oleaje, así como el tamaño pequeño de la mayoría de los individuos, permiten deducir que la dinámica de estas comunidades se encuentra muy influenciada por las características climatológicas del área, regularmente impactada por vientos fuertes del norte y noroeste que provocan los frentes fríos, y un particular incremento de fenómenos imprevisibles y estocásticos, como los huracanes de gran intensidad que afectan la región.
- La abundancia de macroalgas en algunas estaciones de arrecife frontal, al parecer como consecuencia de un bajo nivel de herbivorismo, podría condicionar la baja densidad de esponjas en profundidades en las que se esperaría un mayor número de individuos, dado el aumento de la favorabilidad ambiental que esta propicia en cuanto a menor iluminación y menor efecto mecánico.
- Los bajos valores del Índice de Contaminación encontrados descartan la influencia de este factor en la región y reafirman la utilidad de este indicador en evaluaciones de arrecifes coralinos.
AGRADECIMIENTOS
Agradecemos al Acuario Nacional de Cuba por su imprescindible apoyo para la realización del presente trabajo, a la tripulación de la embarcación Aries por su ayuda en los muestreos, a Yuliet Piloto por su constante apoyo y al Dr. Pedro M. Alcolado por la revisión crítica del documento y sus valiosas recomendaciones.
BIBLIOGRAFÍA
Alcolado, P. M. (1978). Ecological structure of the sponge fauna in a reef profile of Cuba. Biologie des spongiaires, 291, 297-302.
Alcolado, P. M. (1979). Estructura ecológica de la comunidad de esponjas en un perfil costero de Cuba. Cien. Biol., 3, 105-127.
Alcolado, P. M. (1986). Las esponjas. La Habana: Editorial Científico-Técnica.
Alcolado, P. M. (1989). Estructura ecológica de la comunidad de esponjas del arrecife de Rincón de Guanabo. Rep. Invest. Inst. Ocean., 10, 1-16.
Alcolado, P. M. (1992). Sobre la interpretación del ambiente marino mediante el empleo de los índices de diversidad y equitatividad. Cienc. Biol., 24, 124-127.
Alcolado, P. M. (1999). Comunidades de esponjas de los arrecifes del Archipiélago Sabana-Camagüey. Bol. Invest. Mar. Cost., 28, 95-124.
Alcolado, P. M. (2002). Catálogo de las esponjas de Cuba. Avicennia, 15, 53-72.
Alcolado, P. M. (2007). Reading the code of coral reef sponge community composition and structure for environmental biomonitoring: some experiences from Cuba. En M. R. Custódio, G. Lôbo-Hajdu, E. Hajdu & G. Muricy (Eds.), Porifera research-biodiversity, innovation and sustainability (pp. 3-10). Río de Janeiro, Brazil: IMOS Gráfica e Editora.
Alcolado, P. M. & Gotera, G. G. (1985). Estructura de las comunidades de esponjas en arrecifes cubanos. Ponencia presentada en el Simposio de Ciencias del Mar y VII Jornada Científica del Instituto de Oceanología XX Aniversario. 1, 11-15. La Habana, Cuba.
Alcolado, P. M. & Herrera-Moreno, A. (1987). Efectos de la contaminación sobre las comunidades de esponjas en el litoral de La Habana, Cuba. Rep. Invest. Inst. Ocean., 68, 1-17.
Bejarano, S. Ch., Zea, S. & Díaz, J. M. (2004). Esponjas y otros microhábitats de ofiuros (Ophiuroidea: Echinodermata) en ambientes arrecifales del archipiélago de San Bernardo (Caribe colombiano). Bol. Invest. Mar. Cost., 33(1), 29-47.
Buznego, M. & Alcolado, P. M. (1987). Frecuencia de ataques de esponjas perforadoras sobre algunos corales escleractinios y otros sustratos marinos en Cuba. Rep. Invest. Inst. Ocean., 59, 1-18.
Caballero, H., Busutil, L., García, Y. & Alcolado, P. M. (2009). Variación espacial en comunidades de esponjas de la costa oriental de Bahía de Cochinos, Cuba. Rev. Mar. Cost., 1, 95-109.
Chaves-Fonnegra, A., Zea, S. & Gómez, M. L. (2007). Abundancia de la esponja excavadora Cliona delitrix en relación con descargas de aguas servidas en la Isla de San Andrés, Caribe suroccidental, Colombia. Bol. Invest. Mar. Cost., 36, 63-78.
De la Guardia, E. & González-Sansón, G. (1997a). Asociaciones de esponjas, gorgonias y corales de un arrecife en la costa noroccidental de Cuba. I: Distribución espacial de biotopos. Rev. Invest. Mar., 18(3), 198-207.
De la Guardia, E. & González-Sansón, G. (1997b). Asociaciones de esponjas, gorgonias y corales de un arrecife en la costa noroccidental de Cuba. II: Variaciones espaciales del cubrimiento y la densidad. Rev. Invest. Mar., 18(3), 208-215.
De la Guardia, E., González-Díaz, P., Valdivia, A. & González, O. (2006). Estructura y salud de la comunidad de corales en arrecifes de la zona de buceo de Cayo Levisa, Archipiélago de Los Colorados, Cuba. Rev. Invest. Mar., 27(3), 197-208.
Díaz, M. C. & Rützler, K. (2001). Sponges: An essential component of Caribbean Coral Reef. Bull. Mar. Sci., 69(2), 535-546.
González-Díaz, P. (1999). Comunidades de esponjas, corales y gorgonias en un arrecife coralino costero de Ciudad de La Habana. Tesis de diploma no publicada, Universidad de La Habana, La Habana.
González-Díaz, P., González-Sansón, G., Álvarez, S. & Perera, O. (2010). High spatial variability of coral, sponges and gorgonian assemblages in a well preserved reef. Rev. Biol. Trop., 58(2), 621-634.
González-Sansón, G., Aguilar, C. I., Hernández, I., Cabrera, Y. & Curry, A. (2009). The influence of habitat and fishing on reef fish assemblages in Cuba. Gulf Carib. Res., 21, 13-21.
Herrera-Moreno, A. & Alcolado, P. M. (1985). Monitoreo de la contaminación mediante el análisis de la estructura comunitaria de los gorgonáceos. Ponencia presentada en el Simposio de Ciencias del Mar y VII Jornada Científica del Instituto de Oceanología XX Aniversario. 2, 253-257. La Habana, Cuba.
Hooper, J. N. A. & Van Soest, R. W. M. (2002). Systema Porifera, a guide to the Classification of sponges. (Vol. I). New York, EE.UU.: Kluwer academic/Plenum Publishers.
Knowlton, A. L. & Highsmith, R. C. (2005). Nudibranch-sponge feeding dynamics: Benefits of symbiont-containing sponge to Archidoris montereyensis (Cooper, 1862) and recovery of nudibranch feeding scars by Halichondria panicea (Pallas, 1766). J. Exp. Mar. Biol. Ecol., 327(1), 36-46.
Lee, Y. K., Lee, J-H. & Lee, H. K. (2001). Microbial Symbiosis in Marine Sponges. J. Microbiol., 39(4), 254-264.
López-Victoria, M. & Zea, S. (2004). Storm-mediated coral colonization by an excavating Caribbean sponge. Clim. Res., 26(3), 251-256.
López-Victoria, M. & Zea, S. (2005). Current trends of space occupation by encrusting excavation sponges on Colombian coral reefs. Mar. Ecol., 26(1), 33-41.
Luis-Riera, M. (1983). Estudios hidrológicos de la plataforma noroccidental de Cuba (zona c). Rep. Invest. Inst. Ocean., 13, 1-33.
Marcos, Z. (2005). Comunidades de esponjas como indicadoras ambientales del arrecife del Reparto Flores, Ciudad de La Habana, Cuba. Tesis presentada de Maestría no publicada, Instituto de Oceanología, Cuba.
Margalef, R. (1951). Diversidad de especies en las comunidades naturales. Publ. Inst. Biol. Apl. Barcelona, 9, 5-27.
McLean, E. L. & Yoshioka, P. M. (2007). Associations and interactions between gorgonians and sponges. En M. R. Custódio, G. Lôbo-Hajdu, E. Hajdu & G. Muricy (Eds.), Porifera research- biodiversity, innovation and sustainability (pp. 443-448). Río de Janeiro, Brazil: IMOS Gráfica e Editora.
Padilla, C., Gutiérrez, D., Lana, M. & García, C. (1992). Coral reef of the biosphere. Reserve of Sian Ka’an, Quintana Roo, México. Proc. 7mo. Coral Reef Symp. Guam., 2, 986-992.
Rose, C. S. & Risk, M. G. (1985). Increase in Cliona delitrix infestation of Montastrea cavernosa heads on an organically polluted portion of the Grand Cayman fringing reef. Mar. Ecol., 6(4), 345-363.
Saito, T., Uchida, I. & Takeda, M. (2002). Skeletal growth of the deep-sea hexactinellid sponge Euplectella oweni, and host selection by the symbiotic shrimp Spongicola japonica (Crustacea: Decapoda: Spongicolidae). J. Zool., 258(4), 521-529.
Salazar-Vallejo, S. (2002). Huracanes y biodiversidad costera tropical. Rev. Biol. Trop., 50(2), 415-428.
Swain, T. D. & Wulff, J. L. (2007). Diversity and specificity of Caribbean sponge-zoanthid symbioses: A foundation for understanding the adaptive significance of symbioses and generating hypotheses about higher-order systematics. J. Biol. Linn. Soc., 92(4), 695-711.
Tronchin, E., Samaai, T., Anderson, R. J. & Bolton, J. J. (2006). Sponge–seaweed associations in species of Ptilophora (Gelidiaceae, Rhodophyta). Phycol. Res., 54(2), 140-148.
Ward-Paige, C. A., Risk, M. J., Sherwood, O. A. & Jaap, W. C. (2005). Clionid sponge surveys on the Florida Reef Tract suggest land-based nutrient inputs. Mar. Pollut Bull., 51(5, 7), 570-579.
Wulff, J. L. (1995). Effects of a hurricane on survival and orientation of large, erect coral reef sponges. Coral Reefs, 14, 55-61.
Wulff, J. L. (2001). Assessing and monitoring coral reef sponges: Why and how? Bull. Mar. Scien., 69, 831-846.
Wulff, J. L. (2006). Sponge systematics by starfish: Predators distinguish cryptic sympatric species of Caribbean fire sponges, Tedania ignis and Tedania klausi n. sp. (Demospongiae, Poecilosclerida). Biol. Bull., 211, 83-94.
Zea, S., Henkel, T. P. & Pawlik, J. R. (2009). The Sponge Guide: a picture guide to Caribbean sponges. NSF Biological Oceanography Program grants. Wilmington, NC, EE.UU.