Rev. Mar. Cost. ISSN 1659-455X. Vol. 3: 153-169, Diciembre 2011.
DOI: https://doi.org/10.15359/revmar.3.12
ESTRUCTURA DE LAS ASOCIACIONES DE PECES EN LOS ARRECIFES CORALINOS DEL PARQUE
NACIONAL GUANAHACABIBES, CUBA
STRUCTURE OF THE ASSOCIATIONS OF FISH IN THE CORAL REEF IN THE GUANAHACABIBES
NATIONAL PARK, CUBA
Dorka Cobián Rojas1*, Rodolfo Claro Madruga2, Pedro Pablo Chevalier Monteagudo3,
Susana Perera Valderrama4 y Hansel Caballero Aragón3
1 Parque Nacional Guanahacabibes, Centro de Investigaciones y Servicios Ambientales (ECOVIDA), Ministerio de Ciencia, Tecnología y Medio Ambiente (CITMA). La Bajada, Código Postal 22 100, Pinar del Río, Cuba. *dorkacobian@gmail.com
2 Instituto de Oceanología (CITMA). Ave. 1ª, 18406, Playa, Ciudad de La Habana, Cuba.
3 Acuario Nacional de Cuba (CITMA). 1ra. y 60, Miramar, Playa, Ciudad de La Habana, Cuba.
4 Centro Nacional de Áreas Protegidas (CITMA), Ciudad de La Habana, Cuba.
Recibido 28-IV-2011
Aceptado 22-IX-2011
RESUMEN
Para la ejecución del plan de manejo del Parque Nacional Guanahacabibes es necesario establecer una línea base sobre la diversidad y estructura de las asociaciones de peces, así como sus posibles cambios como consecuencia de las variaciones espaciales y temporales. Se realizaron censos visuales de todas las especies en períodos lluvioso y poco lluvioso de los años 2007-2008, en sus principales zonas del arrecife. Se evaluaron 15 estaciones, mediante 6 tramos de 50 x 2 m. Entre los períodos lluvioso y poco lluvioso no se observaron diferencias significativas en los principales indicadores de la estructura de las asociaciones (diversidad de especies, densidad, biomasa, tallas y categorías tróficas), pocas especies mostraron diferencias en su abundancia como consecuencia de su movilidad y distribución. La densidad y biomasa de peces mostraron correlación positiva con la complejidad del sustrato. Los valores más altos se observaron en los camellones de la pendiente arrecifal, que presentaron umbrales excepcionalmente altos y de complejo relieve. La estructura trófica estuvo dominada por carnívoros, sobre todo los ictiobentófagos (38% de la biomasa total), pero los herbívoros presentaron una alta proporción (25%), indicador de condiciones favorables, aunque la proporción de omnívoros fue más alta que en otras regiones. Se registraron 201 especies en toda el área, cifra superior a la conocida en otros arrecifes de Cuba. Hubo predominio de peces de pequeña talla y poca abundancia de peces de mediana y gran talla en la zona de pesca de subsistencia diseñada para la comunidad local, esto podría estar dado por la pesca furtiva.
Palabras claves: Asociaciones de peces, diversidad, arrecifes coralinos, Guanahacabibes.
ABSTRACT
In order to execute the management plan for the Guanahacabibes National Park it is necessary to establish a guideline on the diversity and structure of the associations of fish, as well as their possible changes as a result of temporary and spatial variations. Visual censuses were conducted of all the species during the rainy and dry seasons of years 2007 and 2008 in the main reef areas. A total of 15 stations were evaluated by means of 6 transepts of 50 x 2 m. No significant differences were observed in the main indicators of the structure of the associations (diversity of species, density, biomass, sizes and trophic categories) between the rainy and dry seasons. Few species showed differences in their abundance as a result of their mobility and distribution. Fish density and biomass showed a positive correlation with the complexity of the substrate. The highest values were observed in the ridges on the reef slope, which show exceptionally high sills and complex relief. Although the trophic structure was dominated by carnivores, mainly the ictiobenthophagous (38% of total biomass), herbivores presented a high proportion (25%), which is an indicator of favourable conditions; however, the proportion of omnivores here was higher than in other regions. A total of 201 species were recorded in the entire area, an amount higher than in any other reef in Cuba. The subsistence fishing area established for the local community included predominantly small fish and little abundance of medium and big fish, which could be due to illegal fishing.
Keywords: Associations of fish, diversity, coral reefs, Guanahacabibes.
INTRODUCCIÓN
En las Áreas Marinas Protegidas (AMPs), las asociaciones de peces se encuentran protegidas de la sobrepesca, se garantiza la estructura por tallas y edades de las poblaciones explotadas y se resguarda la estructura física de los hábitats, minimizando los daños que ocasionan las artes de pesca y otros impactos antrópicos. Se conservan, además, los sitios de desove y cría, favoreciendo la reposición de las poblaciones y el suministro de larvas a zonas de pesca fuertemente explotadas fuera del área protegida (Gell y Roberts, 2002; Perera-Valderrama et al. 2005).
El Parque Nacional Guanahacabibes fue declarado en diciembre del 2001 por sus altos niveles de diversidad biológica, este constituye la zona núcleo de la Reserva de Biosfera Península de Guanahacabibes. El área marina está incluida dentro de una Zona Bajo Régimen Especial de Uso y Protección de la resolución 40/2003 del extinto Ministerio de la Industria Pesquera, en la cual se prohíben la pesca comercial, la pesca deportiva y la pesca submarina.
Entre los usos de la zona marina se encuentran las actividades de buceo contemplativo realizadas por el Centro Internacional María la Gorda, el cual cuenta con altas potencialidades para incrementar su actividad náutica, lo que podría provocar alteraciones en las asociaciones de peces. Otro uso es la pesca con cordel y anzuelo por las comunidades locales en el sector La Bajada-Uvero Quemado. Esta actividad es más intensa durante los períodos de reproducción del pargo criollo (Lutjanus analis). Sin embargo, en menor medida se realiza de forma ilícita la pesca submarina, lo cual afecta la composición y estructura de las asociaciones de peces (Claro y Cantelar, 2003).
A pesar de la importancia de la región, desde el punto de vista económico y conservacionista, las investigaciones realizadas en el área marina son aisladas y dispersas, por lo que no existen inventarios adecuados sobre su fauna y flora marinas. Para garantizar la conservación y un manejo sostenible de los arrecifes coralinos del parque, y en particular de la ictiofauna asociada a estos, es necesario conocer su estructura y composición, y establecer una línea base que permita evaluar periódicamente los impactos provocados por la pesca, el turismo y los probables efectos del cambio climático; además de analizar otros factores que puedan provocar variabilidad en la estructura de las asociaciones, como las variaciones temporales y la complejidad estructural del sustrato.
MATERIALES Y MÉTODOS
El Parque Nacional Guanahacabibes se ubica en la porción más occidental del Municipio Sandino, donde ocupa un área total de 39 830 ha. El área marina abarca la porción sur de la Península de Guanahacabibes, con una extensión de 15 950 hectáreas.

Durante los meses de junio (lluvioso) del 2007 y febrero (poco lluvioso) del 2008 se realizaron censos visuales por tres observadores en 15 estaciones, ubicadas a lo largo de la costa sur de la península, en el horario de las nueve y doce de la mañana (Fig. 1). Se realizaron muestreos en cuatro biotopos característicos: I- camellones y canales; II- camellones de la pendiente arrecifal; III- cabezos y parches coralinos; IV- veril (Cuadro 1, Fig. 2).

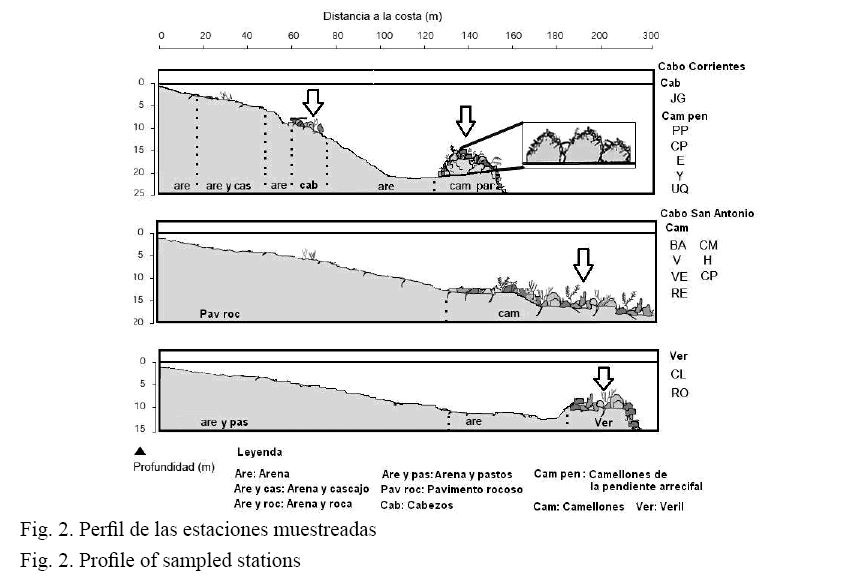
Durante los dos períodos, en cada estación se realizaron censos visuales en 6 tramos lineales de 50 m de largo por 2 de ancho (Brock, 1954), ocupando un área total de 600 m2, en los cuales se anotaron todas las especies presentes y su longitud estimada. Durante la natación de regreso a la costa, se realizaron censos visuales cualitativos, en los cuales se anotaron todas las especies para conformar la lista de especies de la región.
Se registraron el número de individuos de cada especie y su talla estimada. Cada especie se ubicó en el intervalo de clase correspondiente (<5 cm, 5-10 cm, 10-20 cm, pequeñas); (20-30 cm, 30-40 cm, medianas); (>40 cm, grandes). Con esos valores se calculó el peso total de los individuos, empleando para ello las relaciones largo-peso obtenidas en la literatura (Bohnsack y Harper, 1988; García-Arteaga et al. 1997). Se calculó el índice de heterogeneidad de Shannon H’ (Shannon y Weaver, 1949), y el índice de equitatividad J’ (Pielou, 1966), mediante la aplicación PRIMER 5.0. Para cada estación y zona del arrecife, en los 6 transectos, se obtuvieron el número de especies, los valores de densidad (individuos/m2) y la biomasa (g/m2) ± el error estándar (EE).
Se construyeron curvas de acumulación del número de especies por biotopo para las dos épocas del año, aleatorizando el número acumulado de especies contra el número de transectos muestreados en cada etapa, mediante el programa Biodiversity Professional V2.
Se adoptaron las categorías tróficas propuestas para cada especie por Sierra et al. (1994), con base en numerosos estudios sobre la alimentación de los peces del Caribe.
Se evaluó la complejidad del sustrato en todas las estaciones a través de las siguientes metodologías:
AGRRA (1999): Se realizaron 10 transectos de 10 m de largo en cada estación. En cada uno se escogieron 5 puntos equidistantes y se estimó 1 m de radio dentro del cual se midió la mayor depresión del sustrato y la mayor elevación del coral en cm por punto y se sumaron. Se promediaron los 5 valores de cada transecto.
Contorno de cinta (Sale y Douglas, 1984; Sale y Steel, 1986; Sale et al. 1994): Se colocó una cinta métrica de 10 m de largo bien estirada en un transecto paralelo a la costa, a la misma profundidad. Seguidamente con una cuerda de 1 m de largo se realizaron mediciones del contorno del fondo a todo lo largo de la cinta. Se estimó la relación entre el contorno del fondo y el largo de la cinta para calcular la rugosidad. Se hicieron 10 réplicas en cada estación.
Método semicuantitativo (modificación del método de Roberts et al. 1995 propuesto por Pina-Amargós, 2008): éste consistió en la clasificación visual del relieve del fondo por tres observadores según una escala de tres niveles (donde 1 = relieve poco complejo, con camellones de 1 a 2 m de altura sin grandes oquedades; y 3 = excepcionalmente complejo, con cobertura coralina alta y numerosas cuevas, fisuras y solapas). Después se calculó el valor promedio de los tres evaluadores para cada estación.
Los datos fueron comparados mediante estadística descriptiva (medias, error estándar). Los valores de densidad promedio fueron procesados mediante análisis de varianza (ANOVA) de clasificación simple, luego de comprobar la naturaleza de cada variable (premisas ANOVA). Para la comparación múltiple a posteriori de las medias se utilizó la prueba de Student-Newman-Keuls. Se verificó la homogeneidad de varianza y normalidad de los datos, siguiendo los criterios de Zar (1996) y Underwood (1997). Todas las diferencias fueron consideradas significativas para P < 0.05 y altamente significativas para P < 0.001, con intervalos de confianza al 95%. Los valores de biomasa promedio fueron procesados a través de la prueba no paramétrica de Kruskal-Wallis, debido a que los datos no se ajustaron a una distribución normal.
Para explorar las relaciones de similitud cuantitativa entre la ictiofauna registrada por biotopos y estaciones, se empleó el índice de similitud de Bray-Curtis.
Los datos de la complejidad del sustrato por estación fueron analizados mediante ANOVA de clasificación simple. Se calcularon los índices de correlación de Pearson y Spearman, en dependencia de la naturaleza de los datos, de la densidad y biomasa con la complejidad del sustrato, según los diferentes métodos de muestreo utilizados.
Todos los datos fueron procesados mediante los programas Statistica 6.0 (Statsoft, 2001), Primer 5.0 y Biodiversity Professional V2.
RESULTADOS
Durante los dos períodos muestreados (lluvioso y poco lluvioso) no se encontraron diferencias significativas en los valores de densidad (F = 1.2409; P > 0.05), ni en los de biomasa (F = 0.1642; P > 0.05). Los valores del índice de diversidad y el de equitatividad para ambas épocas del año también fueron similares (Cuadro 2). La composición por especies en ambas épocas analizadas fue muy similar, el 85% de las especies fueron comunes en los dos muestreos.
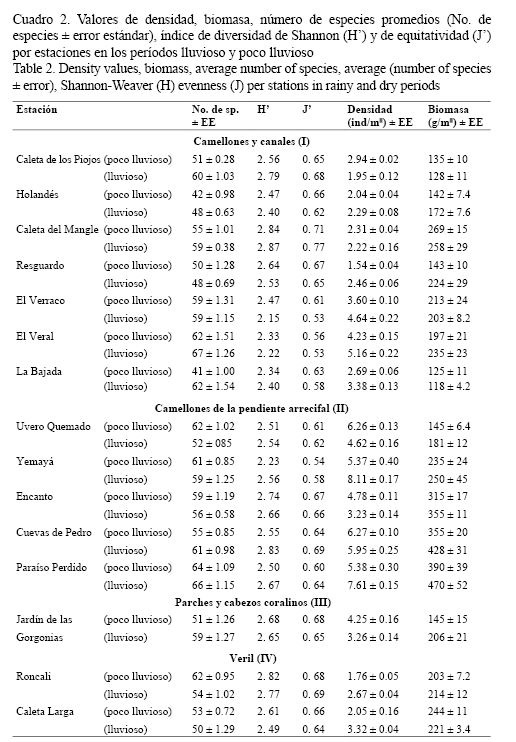
Solo se encontraron diferencias significativas entre las abundancias de las especies Haemulon flavolineatum (U = 3798.5; P < 0.05), Thalassoma bifasciatum (U = 2403.2; P < 0.05) y Halichoeres garnoti (U = 2406.1; P < 0.05). Por tanto, para evaluar la densidad, biomasa y diversidad, se unieron los datos obtenidos en los períodos 2007-2008 de ambas épocas climáticas, para obtener valores más representativos de las asociaciones de peces en cada biotopo.
Las curvas acumulativas de número de especies por unidad de muestreo en los cuatro biotopos analizados alcanzan una tendencia asintótica, evidenciando que el número de unidades de muestreo ofrece un estimado confiable de la riqueza de especies (Fig. 3).

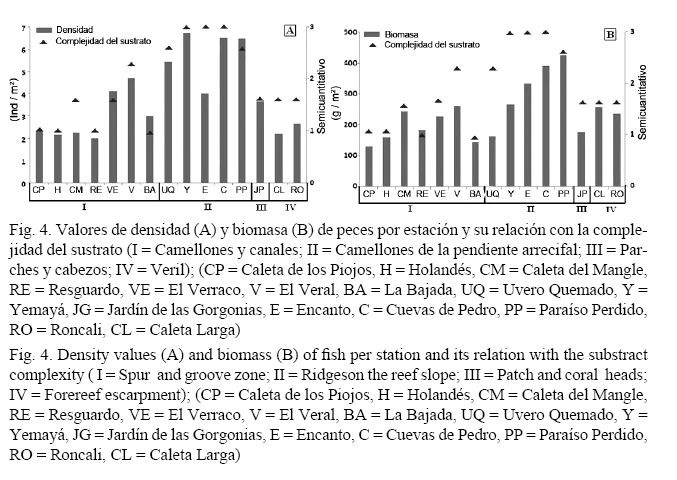
Los tres métodos utilizados para evaluar la complejidad del sustrato en las estaciones muestreadas presentaron tendencias similares. Se observaron diferencias significativas entre las estaciones por los tres métodos aplicados (AGRRA: F = 11.9851 y P < 0.001; Cinta: F = 6.8184 y P < 0.001 y Semicuantitativo: F = 10. 8928 y P < 0.001). Las estaciones con mayor complejidad del relieve fueron las de camellones de la pendiente arrecifal ubicadas en la región oriental (cercana a Cabo Corrientes).
Con los tres métodos utilizados se encontró correlación positiva entre la complejidad estructural del sustrato y la densidad y biomasa de peces. El mayor valor de correlación se obtuvo con el método semicuantitativo (Cuadro 3). Utilizando los datos originales de Perera (2010), obtenidos en las mismas estaciones de muestreo, se encontró correlación positiva entre el cubrimiento de coral vivo y la densidad de peces (r = 0.5548), aunque no tan alta como en los otros métodos.

Utilizando el método semicuantitativo, se observó una correlación particularmente alta con los valores de densidad (r = 0.8451) y biomasa (r = 0.7934) de las especies de mediana y gran talla (L. analis, Lutjanus jocu, Lutjanus cyanopterus, Lutjanus griseus, Epinephelus striatus, Lachnolaimus maximus, Mycteroperca bonaci, Mycteroperca tigris, Mycteroperca venenosa, Sphyraena barracuda, Caranx latus, Scomberomorus regalis y Scomberomorus maculatus), que se encuentran entre las más apreciadas por la pesca submarina y comercial.
La figura 4 muestra los valores de densidad y biomasa de peces por estación y su relación con la complejidad del sustrato. En la mayoría de las estaciones donde la estructura del fondo fue más compleja e irregular se obtuvieron mayores valores.
Los valores de densidad mostraron diferencias significativas entre las estaciones (F = 7.2970; P < 0.001). Los valores más altos se observaron en las estaciones situadas en la región oriental, superiores a 5 ind/m2 (Fig. 5A). En la mayoría de las estaciones ubicadas hacia la zona más occidental de la región, las densidades fueron menores (las más bajas, en las estaciones Roncali y Resguardo).
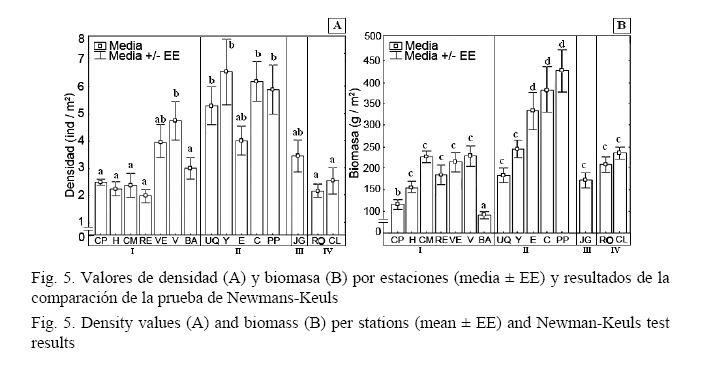
La biomasa de peces también mostró diferencias significativas (F = 6.2786; P < 0.001), los valores más altos correspondieron a las estaciones Encanto, Cuevas de Pedro y Paraíso Perdido, mientras que los más bajos correspondieron a La Bajada y Caleta de los Piojos. El resto no presentó diferencias significativas entre ellas (Fig. 5B).
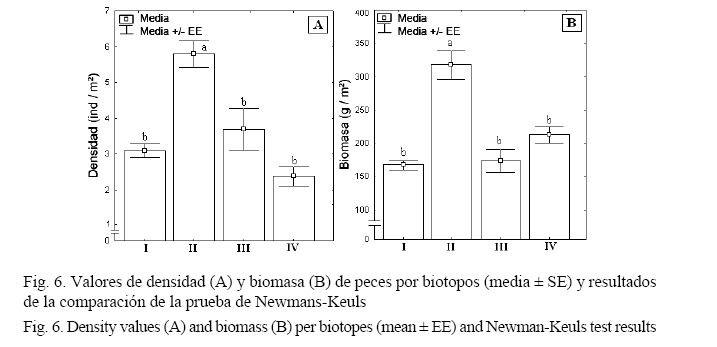
Los valores de densidad por biotopos presentaron diferencias significativas (F = 21.4864; P < 0.001), al igual que la biomasa (F = 8.8834; P < 0.001). En los camellones de la pendiente arrecifal se encontró mayor densidad (5.79 ± 0.38 ind/m2) y biomasa (312 ± 25 g/m2) de peces que en el resto de los biotopos (Fig. 6).
En los muestreos realizados en el período 2007-2008 (15 estaciones, 180 transectos) se registraron 153 especies. En los dos inventarios cuantitativos realizados en el área se contabilizaron 160 especies, y en los cualitativos 41, por lo que la cifra de especies registradas en toda la zona suma 201 especies de peces de 101 géneros y 50 familias.
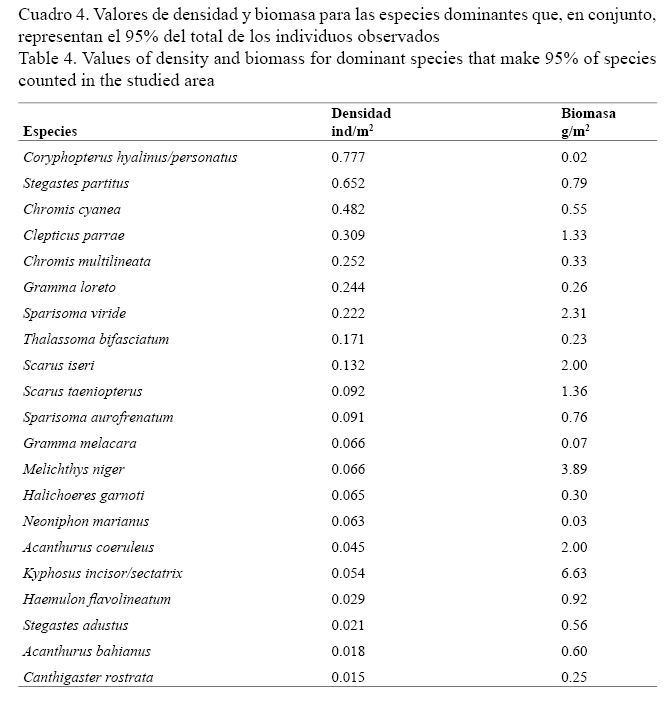
Coryphopterus hyalinus/personatus y Stegastes partitus fueron las especies que aportaron el mayor promedio de densidad (0.78 ind/m2 y 0.65 ind/m2, respectivamente), mientras que la mayor biomasa correspondió a Kyphosus incisor/sectatrix (6.63 g/m2) y Melichthys niger (3.89 g/m2) (Cuadro 4).
El análisis de conglomerados (Fig. 7A), empleando el índice de similitud de Bray-Curtis, con las densidades estandarizadas por especies, muestra dos grupos bien definidos: uno representado por la ictiocenosis del área de Cabo Corrientes y las estaciones de El Veral y El Verraco, y otro para la región costera desde La Bajada hasta el Cabo de San Antonio. La estación Jardín de las Gorgonias, ubicada en Cabo Corrientes, presentó mayor afinidad con las del segundo grupo.

Se ordenaron los biotopos por un análisis similar al anterior, diferenciándose dos grupos: uno representado por las especies de los cabezos y parches coralinos (III) con las del veril (IV), y otro representado por las especies de camellones de menor (I) y mayor desarrollo coralino (II), las cuales presentaron una mayor afinidad entre ellas (Fig. 7B).
En todas las estaciones predominaron los peces de tallas pequeñas (entre 5 y 20 cm de largo). Sin embargo, en la región oriental, se observaron con mayor frecuencia individuos de tallas mayores a los 40 cm, pertenecientes a las familias Serranidae y Lutjanidae. Entre los principales herbívoros (familias Acanthuridae y Scaridae) se observó un predominio de individuos de 10-30 cm.
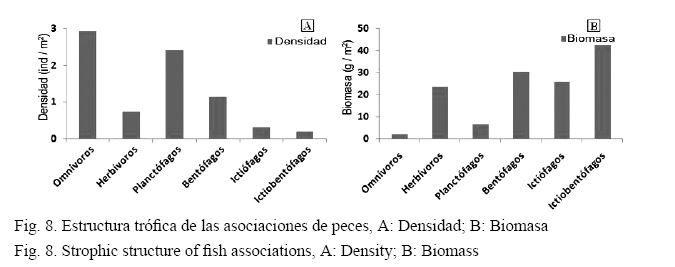
Los planctófagos y los omnívoros presentaron los valores más altos de densidad y estuvieron presentes en todas las estaciones (Fig. 8A); en cambio, la biomasa más alta se observó en los depredadores de peces e invertebrados. El grupo de los herbívoros presentó valores de biomasa relativamente altos (Fig. 8B).
DISCUSIÓN
No se encontraron diferencias significativas y regulares en los valores de densidad, biomasa y número de especies entre las épocas poco lluviosa y lluviosa. Lo anterior puede estar asociado a la ausencia de marcadas influencias terrígenas durante el ciclo anual (aguas fluviales, sedimentos, contaminantes, etc.) y el área no parece estar sometida a cambios regulares que justifiquen la existencia de diferencias estacionales en los mencionados indicadores. Chittaro y Sale (2003), en un estudio realizado en Australia, tampoco encontraron variaciones estacionales significativas en la estructura de las comunidades de peces. Por otra parte, la mayoría de las especies arrecifales tienen longevidad mayor que un año, y las de ciclos de vida largos poseen períodos de reproducción y reclutamiento prolongados, por lo cual es poco probable la existencia de diferencias estacionales reales en el número de individuos y en la diversidad de especies en estos ambientes insulares.
Se registraron 58 especies que no habían sido observadas en inventarios anteriores (Claro y Cantelar, 2003; Valdivia et al. 2004; Cobián y Chevalier, 2009), lo cual eleva a 201 el número de especies en la zona. Una característica distintiva de los arrecifes de esta región es su alta riqueza de especies de peces en las pendientes arrecifales, en comparación con la observada en otras regiones de Cuba y del Caribe.
Tal diversidad de especies no parece ser solo consecuencia de la protección del parque, sino que resulta principalmente de las prístinas condiciones de los arrecifes del área ubicados en las zonas de conservación estricta, poco afectados por impactos antrópicos y naturales y por un relieve mucho más accidentado. No obstante, los valores del índice de heterogeneidad de Shannon muestran valores relativamente bajos en cada estación, lo cual se debe a la alta proporción de individuos de unas pocas especies muy abundantes.
Los biotopos con gran complejidad del relieve y alto cubrimiento de coral vivo ofrecen mayor cantidad de refugios para los peces, favoreciendo la presencia de mayor número de individuos por unidad de área. Las diferencias encontradas en la densidad y biomasa de los peces entre los cuatro biotopos estudiados responden, básicamente, a la estructura del fondo, coincidente con los resultados de otros autores en Cuba (Aguilar y González-Sansón, 2000; 2002; González-Sansón y Aguilar, 2000) y en otras regiones tropicales (Hilomen y Gómez, 1988; Grigg, 1994; Chabanet et al. 1997; Zapata y Morales, 1997).
El análisis de agrupamiento por especies mostró que la mayor riqueza, densidad y biomasa de peces, se observó en el biotopo de camellones de la pendiente arrecifal, donde se encontró la mayor complejidad del relieve. En los camellones y canales, ubicados en el centro del área, la riqueza también fue alta y mucho menor en los cabezos y los veriles, localizados principalmente en la parte más occidental, donde la complejidad estructural es menor.
Según González-Ferrer et al. (2007), la zona de los camellones de la pendiente arrecifal presenta umbrales que pueden alcanzar de 5 a 10 m de altura, lo cual no ha sido reportado en otros arrecifes de Cuba. Esto se debe a su ubicación en el interior de la Bahía, protegida de los frentes fríos y de los vientos del este y a su desarrollo sobre una terraza estrecha, profunda y de escarpe abrupto, donde no se aprecian fuentes contaminantes (Caballero et al. 2007). Perera (2010) encontró, para la zona de camellones de la pendiente arrecifal, un promedio de cubrimiento de coral vivo de 27.4%, mientras que para la región occidental fue del 13.1%. El conjunto de tales factores crea condiciones favorables para el continuo desarrollo de los corales pétreos y la compleja arquitectura, que justifican la elevada diversidad y abundancia de peces hallada en la región oriental.
La correlación más alta fue entre la complejidad del sustrato y la densidad y biomasa de las especies de mayor talla y más perseguidas por la pesca. Esto coincide con los resultados encontrados para Jardines de la Reina por Pina-Amargós (2008). Este método es especialmente recomendable para el estudio de peces de talla grande, ya que al realizar una estimación a escala mayor ofrece una idea general de la estructura del arrecife (Pina-Amargós, 2008). Por tanto, tiene más en cuenta la conducta de estas especies, las cuales en su mayoría utilizan los refugios para su protección y, otros como los meros los utilizan también como escondite para sorprender a sus presas (Valdez-Muñoz y Mochek, 2001). Los otros métodos, por tener una unidad de muestreo que estima a una escala más pequeña, dan una idea más puntual y quizás se puedan asociar con la conducta de peces territoriales.
En los camellones de la pendiente arrecifal se obtuvieron mayores valores de densidad y biomasa de peces que en los otros biotopos, tanto en los muestreos realizados en el período 2003-2004 (Cobián y Chevalier, 2009) como en el 2007-2008, a pesar de ser esta el área que recibe mayor impacto por las actividades antrópicas (actividades turísticas, pesca de subsistencia y pesca submarina furtiva).
La baja densidad y biomasa de peces en las estaciones de la porción occidental y de La Bajada al parecer son consecuencia de un relieve vertical poco acentuado y con pocos refugios para los peces y los invertebrados que les sirven de alimento, además de estar rodeados de extensos arenales o fondos rocosos con poca o ninguna vegetación.
El sector desde La Bajada hasta Uvero Quemado es una zona de pesca de subsistencia para la población local. Esta área es de fácil acceso para los pescadores furtivos, lo cual podría ser la causa de los más bajos valores de densidad y biomasa en este biotopo, por la extracción de las principales especies de interés para el consumo.
Los valores de densidad y biomasa promedios son superiores a los reportados por otros autores en biotopos similares, tanto en el Archipiélago Sabana-Camagüey (Claro y García-Arteaga, 1994; Claro et al. 2007) como en las pendientes del Golfo de Batabanó (Claro et al. 2001). No obstante, en estas dos zonas no existen umbrales tan altos que favorezcan la presencia de refugios; por otra parte, sus arrecifes están sometidos a una intensa pesca comercial y más expuestos a eventos naturales. Sin embargo, los valores de densidad y biomasa promedios fueron similares a los encontrados en las pendientes arrecifales del Archipiélago Jardines de la Reina, también protegido por resolución del Ministerio de la Industria Pesquera como Zona Bajo Régimen Especial de Uso y Protección desde 1997 y con categoría de manejo de Parque Nacional.
La proporción de peces de mediana talla (pargos, meros, jureles, etc.), aunque no tan alta como debe ocurrir en un área protegida, es también apreciable si se compara con otros arrecifes de Cuba y el Caribe (Claro et al. 1998; Lang, 2003). La ictiofauna, en general, aporta valiosos atractivos para el buceo contemplativo, lo cual le confiere a la región un alto valor estético.
Entre los herbívoros principales, pertenecientes a las familias Scaridae y Acanthuridae, predominaron las tallas medianas, usualmente mayores que los observados en otros ecosistemas de Cuba (Durán y Claro, 2009). Lo anterior constituye un factor favorable para evitar el sobrecrecimiento de las algas que actualmente afectan a muchos arrecifes del país (Alcolado et al. 2009; Durán y Claro, 2009) y de otras regiones del mundo (Gardner et al. 2003; Pandolfi et al. 2003; Mumby y Wabnitz, 2002).
No existen datos sobre la diversidad de peces en los arrecifes del parque con anterioridad al establecimiento del área protegida, por lo que no es posible evaluar los efectos de la protección en los años transcurridos desde su establecimiento. Los resultados obtenidos en este trabajo constituyen, por tanto, la línea base que permitirá evaluar los futuros cambios en la estructura de las asociaciones de peces en el área marina protegida. Las informaciones aportadas deben contribuir a perfeccionar el plan de manejo, mediante la adopción de regulaciones específicas acordes con las características de los diferentes hábitats y de sus asociaciones de peces.
BIBLIOGRAFÍA
AGRRA. (1999). Atlantic and Gulf Rapid Reef Assessment (AGRRA). Miami, Fl, EE.UU.: Mesoamerican Reef. System Wor-kshop.
Aguilar, C. & González-Sansón, G. (2000, noviembre). Variaciones en la composición de la ictiofauna en sistemas arrecifales del litoral norte de Ciudad de La Habana. Ponencia presentada en el V Congreso de Ciencias del Mar, Cuba.
Aguilar, C. & González-Sansón, G. (2002). Ecología de la ictiofauna costera en la zona adyacente a la desembocadura del río Almendares (La Habana, Cuba): 1. Distribución espacial de la abundancia y la diversidad. Rev. Inv. Mar., 23(1), 3-14.
Alcolado, P. M., Hernández-Muñoz, D., Caballero, H., Busutil, L., Perera, S. & Hidalgo, G. (2009). Efecto de un inusual periodo de altas frecuencias de huracanes sobre el bentos y arrecifes coralinos. Rev. Mar y Cos., 1, 73-94.
Bohnsack, J. A. & Harper, D. E. (1988). Length-weight relationships of selected marine reef fishes from the southeastern United States and the Caribbean. Miami, Fl, EE.UU.: NOAA Tech. Mem.
Brock, V. J. (1954). A preliminary report on a method of estimating reef fishes populations. J. Wildl. Manage., 18(3), 297-308.
Caballero, H., González-Ferrer, S., Cobián, D., Álvarez, S. & Alcolado, P. M. (2007). Evaluación AGRRA del bentos en diez sitios de buceo de “María la Gorda”, Bahía Corrientes, Cuba. Rev. Inv. Mar., 28(2), 131-138.
Chabanet, P., Ralambondrainy, H., Amanieu, M., Faure, G. & Galzin, R. (1997). Relationships between coral reef substrata and fish. Coral Reefs, 16(2), 93-102.
Chittaro, P. M. & Sale, P. F. (2003). Structure of patch-reef fish assemblages at St. Croix, US Virgin Islands, and One Tree Reef, Australia. Mar. Ecol. Prog. Ser., 249, 277- 287.
Claro, R. & García-Arteaga, J. P. (1994). Estructura de las comunidades de peces en los arrecifes del grupo insular Sabana-Camagüey, Cuba. Avicennia, 2, 83-107.
Claro, R., García-Arteaga, J. P., Bouchon, Y., Louis, M. & Bouchon, C. (1998). Características de la estructura de las comunidades de peces en los arrecifes de las Antillas Menores y Cuba. Avicennia, 8/9, 69-86.
Claro, R., Lindeman, K. C. & Parenti, L. R. (2001). Ecology of Marine Fishes of Cuba. Washington, D. C., EE.UU.: Smithsonian Institution Press.
Claro, R. & Cantelar, K. (2003). Rapid assessment of the coral communities of María La Gorda, Southeast Ensenada de Corrientes, Cuba (Part 2: reef fishes). Atoll. Res. Bull., 496, 278-293.
Claro, R., Cantelar, K., Pina-Amargós, F. & García-Arteaga, J. P. (2007). Cambios en las comunidades de peces de los arrecifes coralinos del Archipiélago Sabana-Camagüey, Cuba. Rev. Biol. Trop., 55(2), 537-547.
Cobián, D. & Chevalier Monteagudo, P. P. (2009). Evaluación de las asociaciones de peces de los arrecifes coralinos del Centro Internacional de Buceo María la Gorda, Parque Nacional Guanahacabibes, Cuba. Rev. Mar. y Cos., 1, 111-125.
Durán, A. & Claro, R. (2009). Actividad alimentaria de los peces herbívoros y su impacto en arrecifes con diferente nivel de degradación antrópica. Rev. Biol. Trop., 57(3), 687-697.
García-Arteaga, J. P., Claro, R. & Valle, S. (1997). Length-weight relationships of Cuban Marine fishes. NAGA, The ICLARM Quartely, 20(1), 38-42.
Gardner, T. A., Côté, I. M., Gill, J. A., Grant, A. & Watkinson, A. R. (2003). Long-term region-wide declines in Caribbean corals. Science, 301(5635), 958-960.
Gell, F. R. & Roberts, C. M. (2002). The fishery effects of marine reserves and fishery closure. Washington, D. C., EE.UU.: WWF-US.
González-Ferrer, S., Caballero, H., Alcolado, P. M., Jiménez, A., Martín, F. & Cobián, D. (2007). Diversidad de corales pétreos en once sitios de buceo recreativo de “María la Gorda”, Cuba. Rev. Inv. Mar., 28(2), 121-130.
González-Sansón, G. & Aguilar Betancourt, C. (2000). Influencia de la contaminación de la Bahía de La Habana (Cuba) sobre las asociaciones de peces, 2. Análisis multidimensional. Rev. Inv. Mar., 21(1-3), 71-80.
Grigg, R. W. (1994). Effects of sewage discharge, fishing pressure and habitat complexity on coral ecosystems and reef fishes in Hawaii. Mar. Ecol. Progr., 103, 25-34.
Hilomen, V. V. & Gómez, E. D. (1988). Distribution of fishes communities in some Philippine reefs. Proc. 6th. Internat. Coral Reef Symp., 3, 257-262.
Lang, J. C. (ed.). (2003). Status of Coral Reefs in the Western Atlantic: Results of initial surveys, Atlantic and Gulf Rapid Reef Assessment (AGRRA) Program. Washington, D. C., EE.UU.: Atoll Res. Bull., 496.
Mumby, P. J. & Wabnitz, C. C. C. (2002). Spatial patterns of aggression, territory size, and harem size in five sympatric Caribbean parrotfish species. Environ. Biol. Fish., 63(3), 265-279.
Pandolfi, J. M., Bradbury, R. H., Sala, E., Hughes, T. P., Bjorndal, K. A., Cooke, R. G., McArdle, D., McClenachan, L., Newman, M., Paredes, G., Warner, R. R. & Jackson, J. B. C. (2003). Global trajectories of the long-term decline of coral reef ecosystems. Science, 301(5635), 955-958.
Perera-Valderrama, S., Hernández-Ávila, A. & Melero, M. (2005). Áreas marinas protegidas. La biodiversidad marina en Cuba (CD-ROM). En R. Claro (Ed.), Manejo y conservación de la biodiversidad marina (pp. 18-23). La Habana, Cuba: Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente.
Perera, S. (2010). Influencia de la exposición a vientos generadores de oleaje sobre comunidades de corales pétreos del Parque Nacional Guanahacabibes, Cuba. Tesis de Maestría no publicada, Centro de Investigaciones Marinas, Universidad de La Habana, Cuba.
Pielou, E. C. (1966). The measurement of diversity in different types of biological collections. J. Theoret. Biol., 13, 13-144.
Pina-Amargós, F. (2008). Efectividad de la Reserva Marina de Jardines de la Reina en la conservación de la ictiofauna. Tesis de Doctorado no publicada, Centro de Investigaciones Marinas, Universidad de La Habana, Cuba.
Roberts, C. M., Quinn, N., Tucker, J. W. & Woodward, P. N. (1995). Introduction of hatchery-reared nassau grouper to a coral reef environment. J. No. Am. Manage, 15(1), 159-164.
Sale, P. F. & Douglas, W. A. (1984). Temporal variability in the community structure of fish on coral patch reefs and the relation of community structure to reef structure. Ecol., 65(2), 409-422.
Sale, P. F. & Steel, W. J. (1986). Random placement and the distribution of fishes among coral patch reefs. Mar. Ecol. Prog. Ser., 28, 165-174.
Sale, P. F., Guy, J. A. & Steel, W. J. (1994). Ecological structure of assemblages of coral-reef fishes on isolated patch reefs. Oecología., 98(1), 83-99.
Shannon, C. E. & Weaver, W. (1949). The mathematical theory of communication. Champaign, IL, EE.UU.: University of Illinois Press.
Sierra, L. M., Claro, R. & Popova, O. A. (1994). Alimentación y relaciones tróficas. En R. Claro (Ed.), Ecología de los peces marinos de Cuba (pp. 263-320). Instituto de Oceanología, Academia de Ciencias de Cuba y Centro de Investigaciones de Quintana Roo (CIQRO), México.
StatSoft, Inc. (2001). STATISTICA (data analysis software system), version 6. www.statsoft.com. Tulsa, OK.: StatSoft, Inc.
Underwood, A. J. (1997). Experiments in ecology. Their logical design and interpretation using analysis of variance. Cambridge, UK: Cambridge University Press, Cambridge.
Valdez-Muñoz, E. & Mochek, A. D. (2001). Behavior of Marine Fishes of the Cuban Shelf. En R. Claro, K. C. Lindeman & L. R. Parenti (Eds.), Ecology of the Marine Fishes of Cuba (pp. 1-20). Washington, D. C. EE.UU.: Smithsonian Institution Press.
Valdivia, A., de la Guardia E., Armenteros, M., González, P., Suárez, A. M., Aguilar, C. & González, G. (2004). Inventario de los componentes más comunes de la flora y la fauna de algunos arrecifes coralinos de la Península de Guanahacabibes, Pinar del Río, Cuba. Rev. Inv. Mar., 25(2), 113-121.
Zapata, F. A. & Morales, Y. A. (1997). Spatial and temporal patterns of fish diversity in a coral reef at Gorgona Island, Colombia. Proc. 8th. Int. Coral Reef Symp., 1, 1029-1034.
Zar, J. H. (1996). Biostatistical analysis. New Jersey, EE.UU.: Prentice Hall Inc.
