Rev. Mar. Cost. ISSN 1659-455X. Vol. 5: 87-105, Diciembre 2013.
La experiencia del cultivo comercial de camarones marinos en estanques de producción en Costa Rica
The experience of commercial cultivation of marine shrimp production ponds in Costa Rica
José A. Valverde-Moya1 y Jorge Alfaro-Montoya2*
1 Consultor en Acuicultura, jvalmo@yahoo.com
2 Escuela de Ciencias Biológicas, Universidad Nacional, Heredia, Costa Rica, jorge.alfaro.montoya@una.cr*
Recibido 20 III 2013
Aceptado 30 IV 2013
RESUMEN
El cultivo de camarones marinos en estanques de producción en Costa Rica ha estado restringido a una pequeña fracción del territorio (1 000 ha), siendo el sector del Pacífico Norte, a ambas márgenes del Golfo de Nicoya, uno de los más productivos. En los últimos 2 años se ha logrado implementar en estas fincas un Plan de Manejo, que ha permitido obtener de manera continua y predecible niveles adecuados de producción convencional de camarón. El presente estudio describe los resultados de un Plan de Manejo utilizando densidades de siembra de 10 camarones/m2 en tres ciclos cortos (90-120 días) y 15 camarones/m2 en un ciclo largo (180 días), durante los años 2011 y 2012, en 11 estanques de fincas ubicadas en Colorado de Abangares, Guanacaste. La sobrevivencia fue mejor en los ciclos del 2011 (75% y 80%) con respecto a los del 2012 (58% y 51%) y el peso promedio final fue inferior en los ciclos cortos (11-14 g) en relación con el peso promedio ponderado, tomando en cuenta las raleas, en el ciclo largo (cerca de 20 g). Debido a que no hubo compensación en el crecimiento y la biomasa en el último ciclo con la sobrevivencia más baja, la productividad decayó a 600 kg/ha después de haberse venido dando incrementos considerables (de 1 118 a 1 263 y 1 730 kg/ha) en los tres ciclos anteriores. Se discuten posibles factores causantes de la baja productividad en este ciclo realizado a finales del 2011 e inicios del 2012.
Palabras claves: Penaeidae, Litopenaeus vannamei, cultivo comercial, camarones, maricultura .
ABSTRACT
The culture of marine shrimp in earthen ponds in Costa Rica has been restricted to a small portion of the territory (1 000 ha), being the North Pacific region, at both margins of the Gulf of Nicoya, one of the most productive areas. During 2011-2012 these farms implemented a Management Plan that has allowed for continuously and predictably obtaining adequate levels of conventional shrimp production. The present study describes the results obtained with the Management Plan used at stocking densities of 10 shrimp/m2 in three short cycles (90-120 days) and 15 shrimp/m2 in one long cycle (180 days) during 2011 and 2012 in 11 ponds located in Colorado de Abangares, Guanacaste. Survival was better in the 2011 cycles (75% and 80%) as compared to the 2012 cycles (58% and 51%); the final average weight was lower for the short cycles (11-14 g) in relation to the long cycle (approximately 20 g). Because there was no compensation on growth and biomass in the last cycle with the lowest survival, productivity decreased to 600 kg/ha after having obtained remarkable increments (from 1 118 to 1 263 and 1 730 kg/ha) in the three previous cycles. The possible factors causing low productivity in this cycle at the end and at the beginning of the year are discussed in this paper.
Keywords: Penaeidae, Litopenaeus vannamei, commercial culture, shrimp, mariculture
INTRODUCCIÓN
Historia del cultivo comercial
Costa Rica siempre ha tenido un enorme potencial para la inversión en proyectos de acuicultura desde los inicios de la actividad (Naegel, 1980), pero la protección de zonas costeras y de manglares, así como los factores de riesgo, han hecho que se mantengan las mismas fincas y áreas de producción de camarones marinos en estanques desde inicios de los noventa, cuando se llegaba a unas 1 000 hectáreas (INCOPESCA, 2006). También ha faltado la investigación aplicada en estanques que ayude a resolver de manera más rápida los principales problemas que se han presentado (Shell, 1983). Los análisis estadísticos y su correcta interpretación han sido difíciles de obtener cuando se han realizado experimentos con un tratamiento por estanque, debido a la falta de suficiente cantidad de réplicas y métodos estadísticos adecuados (Riley & Darmi, 1995).
El desarrollo del cultivo comercial de camarones marinos en estanques de producción en Costa Rica ha estado muy relacionado con la evolución del cultivo en el continente americano, así como con la aparición y prevalencia de las principales enfermedades, sobre todo de tipo viral. Fue en la costa del Caribe de Honduras donde se hicieron los primeros intentos por cultivar camarones en estanques (Broom, 1973) y la primera empresa comercial fue Maricultura S.A., que se instaló en el poblado de Chomes, Costa Rica, a inicios de los setenta. A finales de esa década e inicios de los ochenta, algunos salineros a ambas márgenes del Golfo de Nicoya establecieron cultivos extensivos de subsistencia (Mena, 1987) y se instaló en el país Cosechas Marinas S.A., el primer laboratorio con un ciclo cerrado para la producción de poslarvas de la especie Litopenaeus vannamei.
Conforme se intensificaron y expandieron los cultivos de camarones marinos en Latinoamérica, fueron apareciendo enfermedades, sobre todo de tipo viral, tales como el virus de la necrosis infecciosa hypodermal y hematopoiética (IHHNV, por sus siglas en inglés) y el BP (Baculovirus penaei), tanto en los laboratorios como en las fincas de producción (Kalagayan et al. 1991). Posteriormente, apareció el Síndrome del Taura (Tang et al. 2000) y luego la Mancha Blanca, que ha ocasionado las mayores pérdidas económicas en el cultivo comercial de camarones marinos en estanques de producción (Hameed et al. 2001). La última enfermedad viral detectada ocurrió entre el 2009 y el 2010 correspondiendo a un nuevo virus que causaba un alargamiento, abultamiento y torcimiento lateral o dorsoventral de un segmento de la cola sin mostrar afectación en las tasas normales de crecimiento y sobrevivencia (Sakaew et al. 2008).
La investigación científica
El área de investigación científica que ha generado las mayores contribuciones nacionales es la biología reproductiva de camarones marinos por parte de Alfaro-Montoya y sus colaboradores. Sin embargo, ha existido insuficiencia comunicativa por parte de los programas de extensión para llevar los resultados de estas y otras investigaciones básicas a los productores, de modo que les ayude a resolver rápidamente los principales problemas que enfrentan.
Los avances logrados en biología reproductiva se resumen a continuación. En el 2004 se descubrió una de las más novedosas y eficientes técnicas de inducción que existen, basada en la inyección del neurotransmisor serotonina y el antagonista de la dopamina: espiperone (Alfaro et al. 2004). Estas inyecciones inducen la producción masiva de huevos sin los efectos negativos de la ablación ocular. También se desarrolló una técnica para implantar tejidos en el cuerpo de los camarones y así poder analizar el grado de viabilidad y el efecto inductor de los tejidos implantados (Alfaro et al. 2009). Contrario a los supuestos generalizados, los experimentos indican que los extractos e implantes de ganglios torácicos de hembras en maduración son poco efectivos para inducir la maduración ovárica en comparación con la inyección de serotonina sola o en combinación con el espiperone (Alfaro & Vega, 2010).
En el campo de la calidad reproductiva de los machos se descubrió la causa de dos de los problemas que afectan la sexualidad masculina: la melanización del sistema reproductor y el deterioro de espermatóforos (Alfaro-Montoya, 2010). Entre los aportes más recientes se descubrió que los espermatozoides maduran y se capacitan en el cuerpo de las hembras (Alfaro et al. 2007). Adicionalmente, se logró definir el rol de los neurotransmisores (serotonina y dopamina) sobre el mecanismo reproductivo masculino de tres especies de Litopenaeus (Alfaro-Montoya & Vega, 2011).
Además, se logró descubrir la localización de la glándula androgénica en varias especies de camarones (Alfaro-Montoya & Hernández, 2012), lo que permitirá disponer de una base anatómica precisa para la manipulación y el estudio de esta importante glándula que controla la masculinidad en los crustáceos. También se está investigando el papel de las prostaglandinas, cuya función en el control de la reproducción de estos animales marinos no ha sido establecida (Alfaro-Montoya, en prensa). Finalmente, se está desarrollando la tecnología de reversión sexual y producción de larvas 100% hembras, de mayor tasa de crecimiento, aplicando técnicas de manipulación sexual y biología molecular en L. vannamei.
El presente estudio fue desarrollado en las fincas del sector de Colorado de Abangares, ubicadas en la región del Pacífico Norte de Costa Rica en la margen este del Golfo de Nicoya. En estas fincas se han obtenido de manera continua y predecible en los últimos años, dos ciclos distintos de cultivo según la época lluviosa y seca que se presenta en la región. Ambos difieren en la densidad de siembra, la duración del cultivo, el manejo de las fincas y el tamaño del camarón de la cosecha. El objetivo de este estudio consistió en presentar la experiencia en el cultivo comercial de camarones marinos en estanques de producción en Costa Rica, con respecto al nivel de conocimiento que existe actualmente, y el establecimiento de un Plan de Manejo que ha permitido obtener de manera continua y predecible niveles adecuados de producción.
METODOLOGÍA
Plan de manejo comercial
Los dos ciclos distintos del cultivo convencional de camarones marinos en estanques de producción se realizaron en varias fincas ubicadas en el sector de Colorado de Abangares, en la región del Pacífico Norte de Costa Rica, en la margen este del Golfo de Nicoya. Ambas márgenes de la parte interna del Golfo de Nicoya se encuentran localizadas entre la desembocadura del Río Abangares en el sector noreste del Golfo (85° 4’ 40’’ W, 10° 8’ 40’’ N), la desembocadura del Río Tempisque (85° 00’ 42’’ W, 10° 11’ 17’’ N) y el estero de Jicaral en la parte sureste (85° 7’ 5’’ W, 9° 58’ 58’’ N).
Se sembraron 11 estanques con áreas que oscilaron desde 1.3 has hasta 5.8 has en 6 fincas de producción comercial en cada ciclo. En el ciclo corto se practicó una sola cosecha con camarón de 12 a 15 g promedio, mientras que en el largo se hicieron 3 cosechas selectivas o raleas a los 15, 20 y 25 g, extrayendo aproximadamente el 30% de la biomasa existente, hasta llegar a la cosecha final con camarón de 30 g en adelante. El ciclo corto se realizó en la época seca (marzo a mayo) y el largo se llevó a cabo en la época lluviosa (mayo a noviembre). De diciembre a febrero se practicó un vacío sanitario para el secado y mantenimiento de los estanques, así como para erradicar la posible presencia de enfermedades virales (Mancha Blanca).
La preparación de los estanques incluyó: la oxidación de sedimentos durante la época seca, el rastreado del fondo, la aplicación de carbonato de calcio o caliza a razón de 500 a 700 kg/ha y la eliminación de organismos no deseados en las charcas remanentes con cloro granulado para piscinas disuelto en agua (5 kg/ha). En zonas húmedas extensas también se aplicó, junto con el cloro, cal viva o hidróxido de calcio (300 kg/ha).
El llenado se hizo con agua finamente filtrada en malla marca Nytex® de 700 micras y en la fertilización se aplicó urea o nitrato de amonio a razón de 15 kg/ha. El control de “colonchos” (conocidos como gambas de fango del infraorden: Thalassinidea) se realizó con insecticidas como el Trampa® (diclorvos, 75% p/v) a razón de 7 litros/ha. Luego de un período de maduración de 8 días, se procedió a la siembra con una turbidez de 45 a 55 cm medida con el disco Sechii.
La densidad de siembra de L. vannamei, proveniente de la empresa Farallón en Nicaragua, fue de 10-12 camarones/m2 en el ciclo corto (90-110 días) y de 15 camarones/m2 en el ciclo largo (160 días). La siembra de las poslarvas (PL12-15) fue directa a los estanques de producción después de un período de aclimatación a la temperatura y salinidad. El peso inicial aproximado fue de 3 a 5 mg/PL o 333-200 PL/g.
Diariamente, se registraron los niveles de oxígeno disuelto y la temperatura con un medidor marca YSI®, modelo 55. Cada 15 días se midió la salinidad con un refractómetro portátil. Los recambios de agua se fueron incrementando de leves (5%) a moderados (10%), extrayendo el agua de la superficie desde la tercera hasta la novena semana. Posteriormente, se hicieron recambios fuertes (15-20%) extrayendo agua del fondo hasta el final del cultivo. Todos los recambios se realizaron de 3 a 4 días, aproximadamente, de manera quincenal aprovechando las mareas más grandes que se presentaron. La limpieza de filtros, las mediciones de turbidez del agua con el disco Sechii y los muestreos de peso se realizaron de manera semanal.
La alimentación inicial consistió en el plancton natural y el detritus generado por la fertilización. A partir del tercer día se aplicó alimento molido (marca Nicovita®, importado de Perú) con 30% o 35% de proteína a razón de 2 kg/ha una vez al día en la primera semana. Durante la segunda semana se aplicó la misma cantidad 2 veces al día. A partir de la tercera semana se alimentó, con la dieta granulada, en la mañana y en la tarde siguiendo la tabla de alimentación utilizada por el biólogo asesor de las fincas. La tasa alimenticia se fue ajustando según la biomasa existente de acuerdo con el peso promedio y con la sobrevivencia estimada. Los ajustes también se hicieron para obtener al final del cultivo una conversión alimenticia preestablecida en 1.2-1.3:1.0. El alimento se aplicó al voleo y un 3% se depositó en indicadores de consumo a razón de 4 indicadores/ha.
Semanalmente, se realizaron muestreos de salud y de peso de los camarones observándolos a simple vista y pesando, en balanzas portátiles (2 000 ± 0.5 g), grupos de 30 a 50 individuos para obtener el peso promedio. Después de pesados se devolvieron al respectivo estanque. La sobrevivencia fue estimada hasta que se pudo corroborar por medio de muestreos poblacionales con atarrayas de 2.0-2.5 m2 a razón de 10 lances/ha a partir de los 5-7 g de peso promedio. El peso promedio final fue obtenido en cada cosecha y el peso promedio ponderado, cuando hubo cosechas parciales, y la cosecha final se obtuvo sumando el resultado de la proporción de kilos en cada una con respecto al total multiplicado por el peso promedio del camarón en cada caso.
Análisis de datos
Los datos de producción se expresaron como promedio ± desviación estándar (D.E.). El coeficiente de variación (Covar) se obtuvo para la productividad (kg/ha) y se calculó con la fórmula: D.E./promedio * 100.
Con el fin de determinar si hubo un aumento o descenso en los rendimientos de producción en el transcurso de los 2 años de estudio en las mismas fincas, se calculó una tasa óptima de cultivo (COR), que toma en cuenta las variables más importantes al multiplicar la sobrevivencia por la tasa de crecimiento dividida entre la conversión alimenticia: sobrevivencia*crecimiento/conversión alimenticia. El rendimiento también se obtuvo tomando en cuenta los kilos producidos por cada millar de PL´s sembradas.
.
RESULTADOS
Los promedios con su respectiva desviación estándar y el rango de valores de los principales parámetros de la calidad del agua medidos en los 2 años de cultivo se presentan en el Cuadro 1.
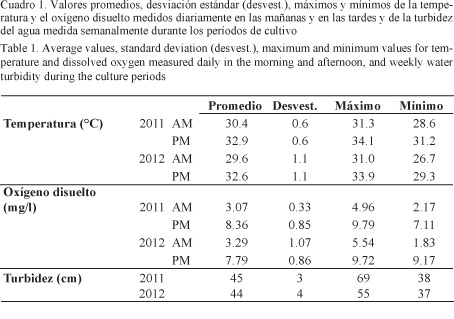
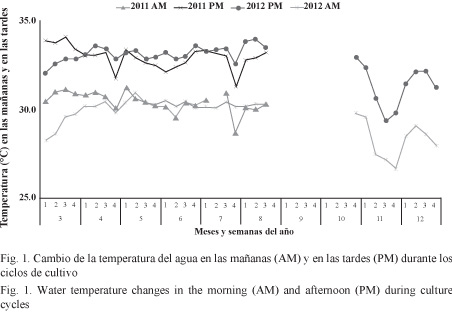
Las variaciones semanales en las mañanas y en las tardes de la temperatura y el oxígeno disuelto durante los ciclos de cultivo se presentan en las Figs. 1 y 2, respectivamente. Las mayores fluctuaciones de temperatura se obtuvieron en noviembre y diciembre del 2012 con los valores más bajos (26.7°C) en las mañanas, mientras que los más altos (34.1°C) se presentaron en marzo del 2011. El oxígeno disuelto en las mañanas fue decreciendo en el transcurso de los cultivos, presentándose valores más altos a finales del año. Los valores de las tardes fueron superiores a los de las mañanas, mostrando un incremento en el transcurso de los cultivos en los primeros ciclos del año y cierta estabilidad al final del año. La turbidez del agua no tuvo mayores variaciones en los ciclos de cultivo en ambos años.
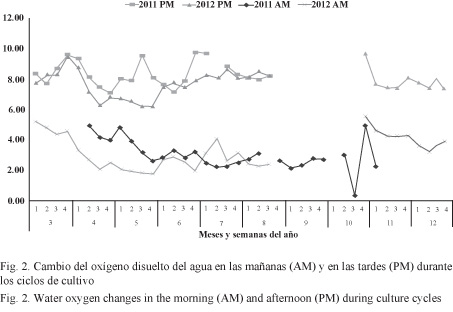
La fluctuación mensual de la salinidad del agua durante los años de estudio se muestra en la Fig. 3. Los ciclos iniciaron en marzo-abril con agua prácticamente marina (35 g/l), cuya salinidad fue reduciéndose con la llegada de las lluvias a partir de mayo hasta llegar a un mínimo de 15 g/l en octubre (época lluviosa). A partir de noviembre empieza a darse un incremento de la salinidad hasta alcanzar el nivel más alto en los primeros 4 meses del año (época seca).
Un ejemplo del Plan de Manejo utilizado en el I ciclo corto del 2013 en una de las fincas analizadas se presenta en la Fig. 4 y es el que rutinariamente se aplicó a las demás fincas en los 2 años anteriores. Los resultados obtenidos aplicando ese Plan de Manejo se presentan en el Cuadro 2. Se incluyen los dos ciclos cortos realizados en el 2011, así como un ciclo largo y uno cortó efectuados en el 2012.

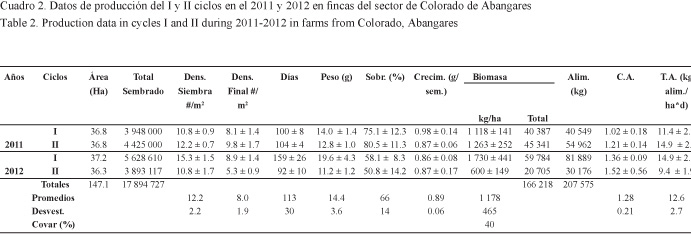
La sobrevivencia bajó de 75% y 80% en los dos ciclos del 2011 a 58% en el ciclo largo y a 51% en el corto del 2012, haciendo que la densidad final del cultivo fuera la más baja (5.3/m2) en el último ciclo con respecto a los demás (8 y 10/m2). El peso promedio final de la cosecha estuvo en 11-14 g en los ciclos cortos y el peso promedio ponderado, en cerca de 20 g en el ciclo largo, tomando en cuenta las raleas. La tasa de crecimiento decayó de 0.98 g/semana en el I ciclo del 2011 a 0.86-0.87 g/semana en los tres ciclos siguientes. Su relación con la sobrevivencia, que determinó la densidad final de cultivo, se muestra en la Fig. 5.
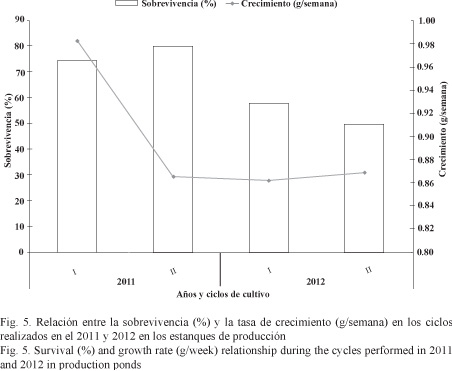
Como resultado de la baja sobrevivencia en el último ciclo corto del 2012, la productividad decayó a 600 kg/ha después de que se había venido dando un incremento considerable de 1 118 a 1 263 y 1 730 kg/ha en los tres ciclos anteriores (Fig. 6). El coeficiente de variación estuvo en un promedio de 40% para la productividad (kg/ha) en las fincas estudiadas durante los 4 ciclos de cultivo.
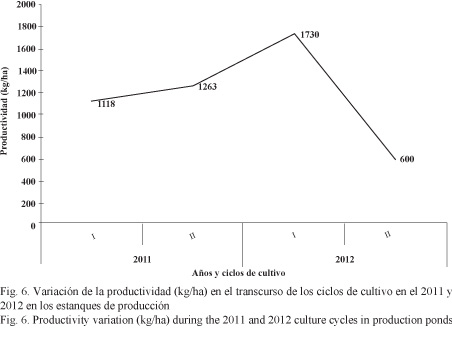
A pesar del esfuerzo por bajar la aplicación de alimento en el último ciclo a 9.4 kg alimento/ha*día, la conversión alimenticia no se pudo reducir, siendo la más alta (1.5:1.0) con respecto a las demás (Fig. 7). La relación entre las tasas alimenticias y las biomasas existentes (kg/ha) se muestra en la Fig. 8.
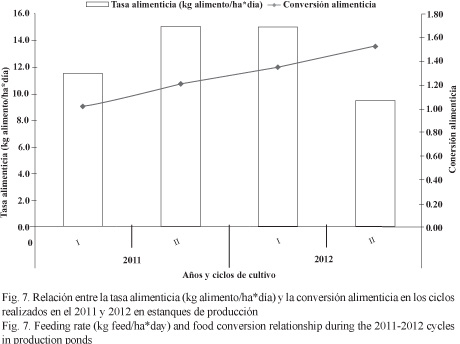
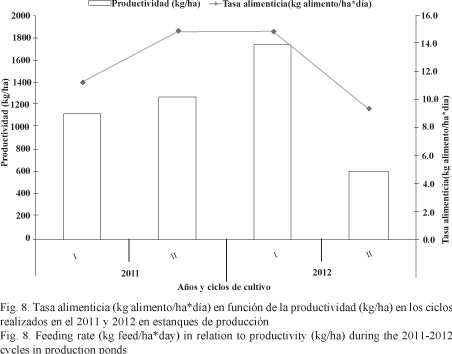
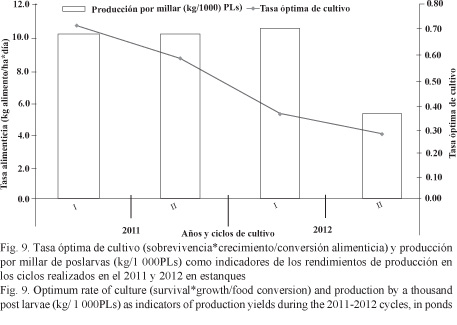
Los rendimientos de producción entre los ciclos a lo largo de los 2 años de estudio se compararon con el cálculo de la tasa óptima de cultivo (COR) y la producción (kg) por cada millar de PL´s sembradas (Fig. 9). En el primer caso se puede apreciar un descenso paulatino (0.72, 0.57 y 0.37) en tres ciclos sucesivos de cultivo, llegando al nivel más bajo (0.29) en el último del 2012. En el segundo caso, la producción en el último ciclo del 2012 se redujo a la mitad (5.3 kg/millar) con respecto a los tres ciclos anteriores en los que estuvo ligeramente superior a 10 kg/millar.
DISCUSIÓN
Se estima que las bajas temperaturas del agua en las mañanas (<27°C) y las fluctuaciones bruscas en el transcurso de las semanas en el Pacífico Norte costarricense a finales del 2012 tuvieron un efecto negativo directo sobre los camarones cultivados en el último ciclo. Aunque los mejores datos de producción han sido obtenidos en temperaturas entre 28 y 30ºC (Ponce-Palafox et al. 1997), como las que predominaron durante este estudio. No ocurre lo mismo en la época seca cuando se presentan las noches más frías al romper los vientos alisios fuertes en dirección N y NE (LITTORALIS, 2003).
Según el Instituto Meteorológico Nacional de Costa Rica (Solano, 2012), el 2012 fue un año particularmente seco en el que llovió menos de lo normal en todo el país, con un déficit de lluvias de hasta el 30% en el Pacífico Norte. Temperaturas inferiores y sobre todo variaciones bruscas entre la noche y el día pudieron haber provocado estrés, bajo consumo de alimento, poco crecimiento y debilidad en el camarón, haciéndolo más propenso al ataque de enfermedades (Kautsky et al. 2000).
Las mortalidades causadas por enfermedades como la Vibriosis y la Mancha Blanca fueron más severas en el segundo ciclo a finales del 2012, sobre todo en los últimos días de cultivo después de las mudas. Hubo que realizar cosechas de emergencia cuando aparecieron los primeros síntomas de estas enfermedades, pero las sobrevivencias ya habían disminuido considerablemente. Estudios en fincas afectadas por la Mancha Blanca, días después de que se dieran cambios abruptos en la temperatura y la salinidad por efecto de las lluvias, han mostrado tasas de mortalidad de hasta un 80% en poco tiempo (Peinado-Guevara & López-Meyer, 2006). Según estos mismos autores, las mortalidades pueden llegar al 100% en término de 3-10 días cuando se presentan los signos clínicos de la Mancha Blanca. La Vibriosis, conocida como el Síndrome de la Gaviota por la cantidad de aves que atrae o el Síndrome del Verano por presentarse mayormente en esta época del año, también fue más común a finales del año con la llegada de la época seca en la región del Pacífico Norte costarricense. Tal enfermedad ha sido asociada al aumento en la temperatura del agua y a la duración de las horas de sol en el verano (Lemonnier et al. 2006).
Los niveles de oxígeno disuelto en las mañanas estuvieron dentro del rango recomendado (4-5 mg/l; Boyd, 1989) para el cultivo de camarones marinos hasta el segundo mes de cultivo, cuando decayeron a valores de 2-3 mg/l. Aunque estos niveles no son considerados letales (<1 mg/l; Hopkins et al. 1991), podrían haber afectado significativamente el consumo de alimento y la tasa de crecimiento del camarón en este estudio. El mayor nivel de oxígeno disuelto en las tardes y su incremento en el transcurso del cultivo revelan la alta productividad natural generada por una abundante densidad de fitoplancton. La turbidez del agua medida con el disco Sechii fue constante a lo largo del período de estudio y aunque estuvo dentro del rango recomendado (Van Wyk & Scarpa, 1999), no reveló información importante sobre las fluctuaciones en la densidad del fitoplancton y su influencia en los niveles de oxígeno disuelto encontrados.
Aunque la sobrevivencia ha estado inversamente relacionada con la densidad de siembra en otros estudios (Krummenauer et al. 2010), nuestros resultados indican una influencia más directa de otros factores como las variaciones bruscas de la temperatura del agua y la aparición de las principales enfermedades al final del año en esta región, en particular, sobre la tasa de sobrevivencia. Sobrevivencias superiores al 75% como las logradas en los dos ciclos cortos del 2011 revelan una buena aplicación del Plan de Manejo y un eficiente aprovechamiento del alimento suministrado (Krummenauer et al. 2010). Sin embargo, cuando la sobrevivencia decayó a un 51% en el ciclo corto a finales del 2012, se alejó del objetivo propuesto como consecuencia de condiciones ambientales adversas y cambios bruscos en la calidad del agua que estuvieron fuera de control en las prácticas de manejo.
La reducción en la densidad final del cultivo, producto de la menor sobrevivencia en el ciclo corto del 2012, tampoco mostró una relación inversa con la tasa de crecimiento. Al presentarse la mayor mortalidad al final del cultivo, no existió el efecto compensatorio esperado en la biomasa, producto de un mayor incremento en peso, como ocurre cuando se reducen las densidades de siembra (Krummenauer et al. 2010). No obstante, las tasas de crecimiento en todos los ciclos de este estudio fueron similares a las obtenidas en estanques grandes (8.8 has como promedio) en Venezuela (0.76 y 0.87 g/semana) desde 1990 hasta el 2002, con densidades similares de siembra en los programas de selección de reproductores de diferentes orígenes (México, Panamá y Colombia; De Donato et al. 2005).
Las producciones obtenidas en los tres primeros ciclos están dentro de los resultados esperados en el Plan de Manejo y son similares a las reportadas en fincas de Venezuela de 1990 al 2000, pero son ligeramente inferiores a las obtenidas en el 2002, cuando se incrementaron a 2 100 kg/ha (De Donato et al. 2005). La caída en la productividad fue muy notoria en el último ciclo del 2012, cuando decayó a menos de la mitad con respecto a los tres ciclos anteriores. Esto como producto de la baja sobrevivencia obtenida y la ausencia de un aumento considerable en el peso que compensara la biomasa perdida. La relación directa entre la sobrevivencia y la productividad demostrada en el cultivo de camarones marinos en estanques de tierra en otros países (McGraw et al. 2001) pudo ser corroborada en este estuio.
El coeficiente de variación del 40% obtenido para la productividad (kg/ha) podría considerarse relativamente alto. Es superior al obtenido en estanques de producción con peces en condiciones experimentales en la Universidad de Auburn, Alabama (EE.UU.), donde el promedio fue de 20% en un rango de 4.2% a 34.6% para todas las especies investigadas (Shell, 1983). No obstante, debe considerarse que en este estudio se trata de estanques manejados en el nivel comercial con poco o nulo control en las condiciones ambientales, la calidad del agua, el manejo y las enfermedades que indudablemente afectaron de manera directa los rendimientos de producción. Ese valor indica que en condiciones ambientales estables y de buena calidad del agua, las producciones, aplicando el Plan de Manejo descrito, pueden oscilar entre 800 y 1 900 kg/ha con un promedio de 1 370 kg/ha obtenido de los tres primeros ciclos de producción en este estudio. Valores inferiores como los obtenidos en el último ciclo del 2012 son atribuibles a otros factores fuera de control dentro del Plan de Manejo.
A pesar de la baja productividad en el último ciclo del 2012, se hicieron esfuerzos para impedir que aumentara de manera desproporcionada la conversión alimenticia. Esta se mantuvo en un nivel aceptable en tales circunstancias si se compara con las obtenidas en Venezuela, donde ha venido bajando de un máximo de 1.86:1.00 en 1990 a un mínimo de 1.51:1.00 en el 2002 (De Donato et al. 2005). Aunque se consideran normales en otros estudios conversiones alimenticias en 1.7-2.4:1.0 (Krummenauer et al. 2010), dentro del Plan de Manejo descrito son excesivas y las tasas alimenticias se ajustan para que las conversiones de alimento no sean mayores a 1.2-1.3:1.0.
Debido a tales esfuerzos, existió una estrecha relación entre la tasa alimenticia y la productividad obtenida al final del cultivo, lo cual revela un buen aprovechamiento del alimento utilizado. Las raciones alimenticias se ajustaron semanalmente, cumpliendo con dos raciones al día. Aunque se ha sugerido una alimentación más frecuente o que tenga continuidad en la noche, algunos estudios han demostrado que estas estrategias no aportan mayores beneficios en los rendimientos de producción en estanques de camarones marinos (Aguiar & Nunes, 2006).
La tasa óptima de cultivo (COR) integra tres de los factores más importantes que afectan la producción y tiene la ventaja de que mide la decadencia o el incremento de diferentes ciclos de cultivo de un año con respecto a los otros en las mismas fincas y no se ve tan afectada por las condiciones climáticas, de calidad del agua y de manejo (De Donato et al. 2005). En este estudio, la COR ha decaído paulatinamente en tres ciclos sucesivos de cultivo, llegando al nivel más bajo en el último ciclo del 2012, lo cual es preocupante en términos de la rentabilidad económica que espera el productor nacional. Se sugiere un posterior estudio de análisis de sensibilidad económica (Hernández-Llamas et al. 2004; Krummenauer et al. 2010), donde se evalúen la producción, el precio según el tamaño del producto y los costos variables para la toma de las mejores decisiones en términos de la densidad de siembra, la estrategia de producción y de comercialización que debe llevar a cabo el productor nacional con el fin de lograr su objetivo principal que es obtener ganancias económicas.
CONCLUSIONES
A partir de la experiencia descrita en este estudio se recomienda realizar el ciclo corto en la primera mitad del año, empezando en marzo y terminando en junio. Por otra parte, cabe sugerir que el ciclo largo se inicie en julio, con el fin de concluir en noviembre con camarones de más de 30 g después de varias raleas. No es conveniente tener camarones de cultivo entre diciembre y enero porque podrían morirse, incluso pocos días antes de la cosecha final.
También se aconseja mantener en buenas condiciones la calidad del agua en los estanques, como una medida preventiva ante las adversidades climáticas. Esto se logra evitando, por medio de las medidas del disco Sechii, que la turbidez llegue a valores bajos (<40 cm) debido a una alta proliferación del fitoplancton.
En el caso de las enfermedades, se recomienda mantener estrictas medidas de bioseguridad para evitar que lleguen a los estanques. A continuación se mencionan algunos factores de riesgo que deben mantenerse en el mínimo posible con medidas de bioseguridad: no introducir agua que provenga de otras fincas, tener un abastecimiento propio de agua, dividir estanques grandes para hacerlos más pequeños, sembrar a mediana o baja densidad, no sembrar en la época seca, remover los sedimentos de los estanques al menos una vez al año y proteger las zonas aledañas de manglar, entre otros (Tendencia et al. 2011).
Además de los resultados descritos, existen una serie de problemas que se presentan en los estanques de producción de camarones marinos ubicados en la región del Pacífico Norte del país que alteran irremediablemente la consecución de los objetivos propuestos en el Plan de Manejo. Estos problemas están asociados a las condiciones climáticas, las variaciones bruscas en la calidad del agua, el estrés y la mortalidad del camarón por presencia de enfermedades, la variabilidad genética y de rendimiento de las PL´s sembradas, las tasas efectivas de alimentación y los cambios en la diversidad y la abundancia del fitoplancton, entre los más importantes.
AGRADECIMIENTOS
Los autores agradecen la cooperación de los productores en las fincas camaroneras ubicadas en las comunidades de Colorado y Jicaral, a ambas márgenes del Golfo de Nicoya. Un particular agradecimiento a los evaluadores por sus valiosas observaciones.

La experiencia del cultivo comercial de camarones marinos en estanques de producción en Costa Rica por Revista Ciencias Marinas y Costeras se distribuye bajo una Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 Costa Rica License.
Basada en una obra en http://www.revistas.una.ac.cr/index.php/revmar.
Permisos que vayan más allá de lo cubierto por esta licencia pueden encontrarse en revmar@una.cr.
BIBLIOGRAFÍA
Aguiar, E. & Nunes, A. (2006). Effects of feeding frequency on feed leaching loss and grow-out patterns of the white shrimp Litopenaeus vannamei fed under a diurnal feeding regime in pond enclosures. Aquaculture, 252(2-4), 494-502.
Alfaro-Montoya, J. (en prensa). The effect of ibuprofen on female and male reproduction of the open thelyca marine shrimp, Litopenaeus. Aquac. Res.
Alfaro-Montoya, J. (2010). The reproductive conditions of male shrimps, genus Penaeus, sub-genus Litopenaeus (open thelyca penaeoid shrimps). A review. Aquaculture, 300, 1-9.
Alfaro-Montoya, J. & Hernández, L. (2012). The histological structure of the androgenic gland and cellular cord of the male reproductive system of adult Litopenaeus and Rimapenaeus byrdi. J. Crust. Biol., 32(3), 351-357.
Alfaro, J., Hernández, L., Zúñiga, G., Soto, R. & Mejía-Arana, F. (2009). Thoracic nerve cord-ganglia recognition in intraspecific and interspecific transplants in the white shrimp, Penaeus (Litopenaeus) vannamei. Aquaculture, 288, 126-131.
Alfaro, J., Ulate, K. & Vargas, M. (2007). Sperm maturation and capacitation in the open thelycum shrimp Litopenaeus (Crustacea: Decapoda: Penaeoidea). Aquaculture, 270, 436-442.
Alfaro-Montoya, J. & Vega, L. (2011). The effect of environmental cues and neurotransmitters on male sexuality of the eastern Pacific Penaeus (Litopenaeus) species. Aquaculture, 316, 60-67.
Alfaro, J. & Vega, L. (2010). Effects of transplants and extracts of thoracic nerve cord - ganglia on gonad maturation of penaeoid shrimp. Aquac. Res., 41(2), 182-188.
Alfaro, J., Zúñiga, G. & Komen, J. (2004). Induction of ovarian maturation and spawning by combined treatment of serotonin and a dopamine antagonist, spiperone in Litopenaeus stylirostris and Litopenaeus vannamei. Aquaculture, 236, 511-522.
Boyd, C. (1989). Water quality management and aeration in shrimp farming. Fisheries and Allied Aquacultures Department Series No. 2, Alabama Agricultural Experiment Station, Auburn University, Alabama, EE.UU.: Birmingham Publishing Co.
Broom, J. (1973). Shrimp culture studies in Honduras, 1969-1971. Proc. Annu. Workshop World Maric. Soc., 3, 194-204.
De Donato, M., Manrique, R., Ramírez, R., Mayer, L. & Howell, C. (2005). Mass selection and inbreeding effects on a cultivated strain of Penaeus (Litopenaeus) vannamei in Venezuela. Aquaculture, 247, 159-167.
Hameed, A., Yoganandhanb, K., Sathishb, S., Rasheeda, M., Muruganb, V. & Jayaramanb, K. (2001). White spot syndrome virus (WSSV) in two species of freshwater crabs (Paratelphusa hydrodomous and P. pulvinata). Aquaculture, 201(3-4), 179-186.
Hernández-Llamas, A., González-Becerril, A., Hernández-Vázquez, S. & Escutia-Zúñiga, S. (2004). Bioeconomic analysis of intensive production of the blue shrimp Litopenaeus stylirostris (Stimpson). Aquac. Res., 35(2), 103-111.
Hopkins, J., Stokes, A., Browdy, C. & Sandifer, P. A. (1991). The relationship between feeding rate, paddlewheel aeration rate and expected dawn dissolved oxygen in intensive shrimp ponds. Aquac. Eng., 10(4), 281-290.
INCOPESCA. (2006). Memoria Institucional 2002-2006: Instituto Costarricense de Pesca y Acuicultura. San José, Costa Rica: Imprenta Nacional.
Kalagayan, H., Godin, D., Kanna, R., Hagino, G., Sweeney, J., Wyban, J. & Brock, J. (1991). IHHN virus as an etiological factor in runt-deformity syndrome (RDS) of juvenile Penaeus vannamei cultured in Hawaii. J. World Aquac. Soc., 22(4), 235-243.
Kautsky, N., Rönnbäck, P., Tedengren, M. & Troell, M. (2000). Ecosystem perspectives on management of disease in shrimp pond farming. Aquaculture, 191(1-3), 145-161.
Krummenauer, D., Cavalli, R. O., Ballester, E. L. C. & Wasielesky, W. Jr. (2010). Feasibility of pacific white shrimp Litopenaeus vannamei culture in southern Brazil: effects of stocking density and a single or a double CROP management strategy in earthen ponds. Aquac. Res., 41(2), 240-248.
Lemonnier, H., Herbland, A., Salery, L. & Soulard, B. (2006). “Summer syndrome” in Litopenaeus stylirostris grow out ponds in New Caledonia: Zootechnical and environmental factors. Aquaculture, 261(3), 1039-1047.
LITTORALIS. (2003). Estudio de oceanografía física y química del Golfo de Nicoya. BID/ Parque Marino de Puntarenas, Costa Rica: Imprenta Nacional.
McGraw, W., Teichert-Coddington, D., Rouse, D. B. & Boyd, C. E. (2001). Higher minimum dissolved oxygen concentrations increase penaeid shrimp yields in earthen ponds. Aquaculture, 199(3-4), 311-321.
Mena, L. (1987). Cultivo de camarón marino aprovechando las salinas en la estación lluviosa: Lepanto de Puntarenas, Golfo de Nicoya, Costa Rica. Práctica Dirigida de Licenciatura no publicada. Universidad de Costa Rica.
Naegel, L. C. A. (1980). Status, potentials and problems of mariculture in Costa Rica. Proc. World Maric. Soc., 11(1-4), 570-576.
Peinado-Guevara, L. & López-Meyer, M. (2006). Detailed monitoring of white spot syndrome virus (WSSV) in shrimp commercial ponds in Sinaloa, Mexico by nested PCR. Aquaculture, 251(1), 33-45.
Ponce-Palafox, J., Martínez-Palacios, C. & Ross, L. (1997). The effects of salinity and temperature on the growth and survival rates of juvenile white shrimp, Penaeus vannamei, Boone, 1931. Aquaculture, 157(1-2), 107-115.
Riley, J. & Darmi, M. (1995). A survey of statistical use in aquacultural research. Aquac. Res., 26(2), 95-101.
Sakaew, W., Pratoomthai, B., Anantasomboon, G., Asuvapongpatana, S., Sriurairattana, S. & Withyachumnarnkul, B. (2008). Abdominal segment deformity disease (ASDD) of the whiteleg shrimp Penaeus vannamei reared in Thailand. Aquaculture, 284(1-4), 46-52.
Shell, E. (1983). Fish farming research. Auburn University, Alabama Agricultural Experimental Station, Auburn, AL, EE.UU.: Craftmaster Printers.
Solano, E. (2012). Resumen Meteorológico diciembre de 2012. Bol. Meteorológico Mensual, 1, 1-18.
Tang, K., Durand, S., White, B., Redman, R., Pantoja, C. & Lightner, D. (2000). Postlarvae and juveniles of a selected line of Penaeus stylirostris are resistant to infectious hypodermal and hematopoietic necrosis virus infection. Aquaculture, 190(3-4), 203-210.
Tendencia, E., Bosma, R. & Verreth, J. (2011). White spot syndrome virus (WSSV) risk factors associated with shrimp farming practices in polyculture and monoculture farms in the Philippines. Aquaculture, 311(1-4), 87-93.
Van Wyk, P. & Scarpa, J. (1999). Water Quality Requirements and Management. En P. Van Wyk, M. Davis-Hodgkins, R. Laramore, K. L. Main, J. Mountain & J. Scarpa (Eds.), Farming Marine Shrimp in Recirculating Freshwater Systems (pp. 128-138). Tallahassee, FL. EE.UU.: Florida Department of Agriculture and Consumers Services.