Rev. Mar. Cost. ISSN 1659-455X. Vol. 8 (1): 79-93, Enero-Junio 2016.
DOI: http://dx.doi.org/10.15359/revmar.8-1.6
Reproducción del camarón carabalí Trachypenaeus byrdi (Burkenroad, 1934) en la parte interna del Golfo de Nicoya, Costa Rica
Reproduction of the carabalí shrimp Trachypenaeus byrdi (Burkenroad, 1934) in the inner section of the Gulf of Nicoya, Costa Rica
Luis Hernández Noguera1*, Rosa Soto Rojas1 y Cristian Canales Ramírez2
1 Escuela de Ciencias Biológicas, Universidad Nacional, Heredia, Costa Rica. luis.hernandez.noguera@una.cr*
2 Departamento Evaluación de Recursos, Instituto de Fomento Pesquero (IFOP), Blanco Encalada #839, Valparaíso, Chile.
Recibido: 13 de febrero de 2015
Corregido: 16 de noviembre de 2015
Aceptado: 30 de noviembre de 2015
Resumen
El grupo de camarón blanco (Litopenaeus sp.) es uno de los recursos de mayor importancia socioeconómica en el Golfo de Nicoya. Sin embargo, en los últimos años, el camarón carabalí (Trachypenaeus byrdi) ha experimentado una alta presión pesquera, debido a su valor en el mercado local. Por ende, en este estudio, se analizaron las muestras recolectadas del camarón carabalí (T. byrdi) en la zona interna de este Golfo durante 15 meses, entre los años 2008 y 2009, para conocer algunos de los aspectos biológicos y la dinámica poblacional de este recurso. Se comprobó que T. byrdi se distribuye en los fondos lodosos de la parte interna de este Golfo, cercana a la zona costera, y en profundidades no mayores de 15 metros. Los parámetros poblacionales muestran que la talla media de madurez para las hembras es de 87 mm de LT. Se determinaron dos periodos máximos de reproducción en los meses de marzo-abril y en los meses de julio-setiembre. Los parámetros de crecimiento estimados para las hembras fueron: Loo= 112.6 mm, K= 1.29 año-1, to= -0.084 y Woo= 18.68 g; mientras que para los machos fueron: Loo= 88.2 mm, K= 1.26 año-1 y to= -0.094.
Palabras claves: Camarón carabalí, Golfo de Nicoya, islas Venado y Caballo, Trachypenaeus byrdi, reproducción.
ABSTRACT
The white shrimp (Litopenaeus sp.) is among the most socioeconomically important resources in the Gulf of Nicoya. However, in the last years, the carabalí shrimp (Trachypenaeus byrdi) has become a species of high local commercial value. Therefore, samples of the carabalí shrimp (T. byrdi) collected in the inner section of the Gulf for 15 months between 2008 and 2009 were analyzed in the present study in order to ascertain the biology and population dynamics of this resource. It was confirmed that T. byrdi is found mainly on muddy bottoms located in the inner part of the Gulf, close to the coastal area at depths no greater than 15 m. Population parameters show that female average size at maturity is 87 mm TL (Total Lenght). Two main reproduction periods were identified: March-April and July-September. Estimated growth parameters were Loo= 112.6 mm, K= 1.29 yr-1, to= -0.084 and Woo= 18.68 g for females and Loo= 88.2 mm, K= 1.26 yr-1 and to= -0.094 for males.
Keywords: Carabalí shrimp, Gulf of Nicoya, Venado and Caballo islands, Trachypenaeus byrdi, reproduction.
INTRODUCCIÓN
Las especies de la familia Penaeidae se distribuyen en la región tropical y templada, donde han sido expuestas a una gran presión pesquera por medio de la pesca tanto artesanal como industrial. En este último caso, el método más común para capturar este recurso es el arrastre (Vannuccini, 2004).
En el grupo de camarones comerciales más importante para esta industria en Costa Rica, se encuentran el camarón blanco y azul, género Litopenaeus, y otras especies de profundidad, como es el caso del camarón pinky o rosado del género Farfantepenaeus (INCOPESCA, 2006). Por sus características gustativas, organolépticas, patrones de distribución y abundancia, la captura de este grupo se convierte en una actividad rentable, en la mayoría de las zonas costeras de Centroamérica (FAO, 2007).
En el caso del litoral pacífico costarricense, el Golfo de Nicoya (GN) es la región en la que se ha desarrollado la actividad pesquera artesanal más intensa. Por encima del 50% de la producción pesquera del país proviene de sus aguas (INCOPESCA, 2006).
Sin embargo, las capturas de camarón blanco se han reducido durante la última década (Chacón et al. 2007; BIOMARCC-SINAC-GIZ, 2013) y sumado al alto valor económico del camarón conchudo o carabalí Trachypenaeus byrdi (Burkenroad, 1934) han provocado una alta presión pesquera del recurso en la zona interna de este Golfo. Además, este camarón representa un gran aporte en el campo social (muchas mujeres de las islas obtienen ingresos en el “descabeceo y pelado” de este).
Asimismo, T. byrdi podría cumplir un papel ecológico determinante en la dieta de muchas especies de peces de interés comercial. Por dichas razones, la presente investigación fue orientada al análisis de la pesquería de este camarón, mediante la evaluación de algunos parámetros poblacionales en la zona interna del Golfo de Nicoya.
MATERIALES Y MÉTODOS
Recolección de datos
La investigación de campo se realizó en la zona interna del Golfo de Nicoya, Costa Rica, entre abril del año 2008 y junio del año 2009, en dos comunidades cercanas a las islas Venado (09º 58’ 71’’ N, 085º 02’ 56’’ W) y Caballo (09º 59’ 06’’ N, 85º 02’ 47’’ W) (Fig. 1). Cada comunidad se visitó una vez por mes durante estos 15 meses.
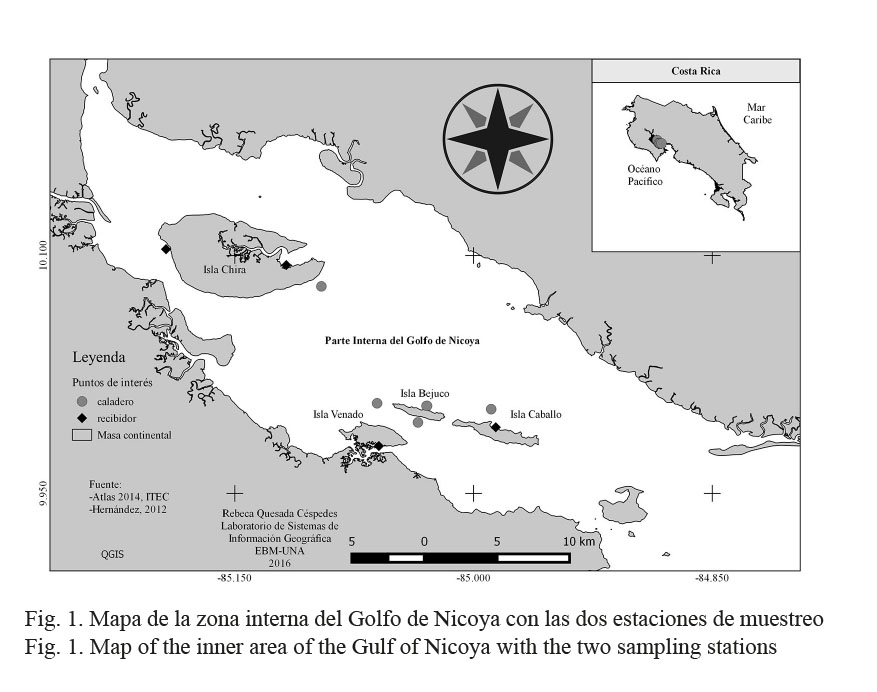
La muestra se obtuvo de los desembarques de los pescadores artesanales de estas dos comunidades, los cuales utilizan redes de 3.5 metros de longitud, 1.5 m de abertura de la boca y media pulgada de luz de malla en la parte del copo. A partir de la captura se analizó una muestra de 300 especímenes en cada mes, a los cuales se les midió la longitud total (LT) desde la punta del rostro hasta la punta del telson con calibrador vernier digital (0.01 mm de precisión) y el peso total se midió con una balanza digital marca AND-GF-3000 (0.01 g de precisión). La especie y el sexo se identificaron mediante la clave ilustrada para camarones comerciales en América elaborada por Pérez-Farfante (1988).
Crecimiento y mortalidad
El crecimiento fue analizado considerando la metodología propuesta por Canales y Arana (2009) relativa al ajuste simultáneo de múltiples componentes modales de las composiciones de tallas. La longitud total promedio del individuo se estimó según la ecuación de von Bertalanffy, parametrizada por Walford (1946):
Lt= L∞ (1 – e-K) + e-KLt-1 (1)
Donde K es el coeficiente de crecimiento, L∞ la talla asintótica y Lt la talla a la edad t (en años). Este modelo por ser recursivo considera una talla promedio mínima que es estimada en el proceso de ajuste.
En el caso de la estimación del valor de t0 se estimó por medio de la ecuación propuesta por Pauly (1984):
Log (-to ) = -0.3922 – 0.2752 log L∞ (mm) –
1.038 logK (año-1)
(2)
Se realizó una prueba de Chi-cuadrado para establecer si existe diferencia significativa entre el número de hembras y machos en las muestras de cada mes. Se utilizó el ANOVA de una vía, con el fin de comprobar si hay significancia estadística entre la talla media de captura mensual de hembras y machos de T. byrdi. Para estos análisis estadísticos se utilizó el programa de licencia libre R (R Core Team, 2014).
Previo a la estimación del crecimiento en peso, se analizaron los datos a través de un modelo potencial característico de regresión no lineal, con el fin de describir la relación longitud total vs. peso total. Siendo la ecuación de este modelo W=aLb (W= peso total; a= constante y L= longitud total); indicando este modelo que si el resultado de “b” es igual a 3, refleja que la relación entre variables es isométrica.
El peso total asintótico se estimó con la ecuación: W∞ = a*L∞b. El índice de crecimiento (Ø ′) estándar se estimó con la ecuación de Munro y Pauly (1983), que ha sido utilizada en muchas poblaciones de crustáceos, derivada de la ecuación de Pauly (1979):
∅′ = LogK + 2 Log L∞
(3)
La mortalidad natural (M) se calculó a través de la siguiente ecuación de Pauly (1984):
Log10 (M) = -0.0066-0.279 Log10 (L∞) + 0.6543 Log10 (K) + 0.4634 Log10T (ºC)
(4)
Donde T es la temperatura del agua promedio (28ºC es la temperatura promedio del Golfo de Nicoya, según Calvo et al. 2014).
La mortalidad total “Z” se estimó usando curvas de capturas por talla en la subrutina de FiSAT II (Gayanillo et al. 1995). La estimación de la mortalidad por pesca (F) se obtuvo despejando F=Z-M (Sparre & Venema, 1995). Por su parte, la tasa de explotación para esta población se determinó mediante la generalización de Gulland (1983), donde E=F/Z (Cadima, 2003).
En cuanto a la determinación del grado de explotación, se definió de acuerdo con el criterio de Gulland & Carroz (1968); si E=0.5, la población está en el punto óptimo de explotación; si E<0.5, la población está subexplotada y si E>0.5, la población está sobreexplotada.
Madurez y talla al 50%: Se determinó el desarrollo de madurez gonádica en hembras de T. byrdi mediante el método macroscópico o de observación directa, donde se describen cuatro estadios de desarrollo gonadal en hembras, según la descripción presentada por Castro (1999):
Estadio I: hembras inmaduras, el ovario es transparente y no se distingue delineado en la parte dorsal (reposo).
Estadio II: hembras con desarrollo gonadal temprano, los ovarios se encuentran inmaduros o iniciando su ciclo de maduración, gónadas casi vacías, delgadas y con color blancuzco o transparente con indicios de pigmentación amarilla.
Estadio III: hembras en proceso temprano de maduración, las gónadas son visibles a través del exoesqueleto presentando coloraciones entre amarillo fuerte y verde claro. Se caracteriza por la separación que existe con el primer segmento abdominal.
Estadio IV: hembras maduras, las gónadas son muy grandes y presentan colores verdosos más fuertes, desde verde musgo claro hasta verde muy oscuro. El evento de desove se considera muy cercano. Se caracteriza porque el ovario se encuentra conectado completamente en el primer segmento abdominal.
Para efectos de cálculo del estado de madurez de cada individuo se midieron los atributos biológicos: talla, sexo y estado reproductivo, este último fue clasificado como variable binaria, tomando valor igual a uno aquellas hembras en Estadio IV y valor cero las restantes. La estimación de la talla media de madurez fue establecida con base en un modelo logístico, cuya variable respuesta es la proporción de hembras maduras a la talla (con 5 mm de intervalo de clase de longitud total) (Montreuil et al. 1998):
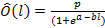
(5)
Donde Ô representa la proporción esperada de hembras maduras en el l-ésimo intervalo de tallas, en tanto p, a y b son coeficientes del modelo a ser estimados. La estimación de los coeficientes del modelo fueron determinados a través de mínimos cuadrados no lineales usando la herramienta SOLVER de Excel:
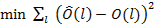
(6)
Una vez resueltos los coeficientes, la talla media de madurez o la talla al 50% de madurez se calculó como:
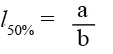
(7)
RESULTADOS
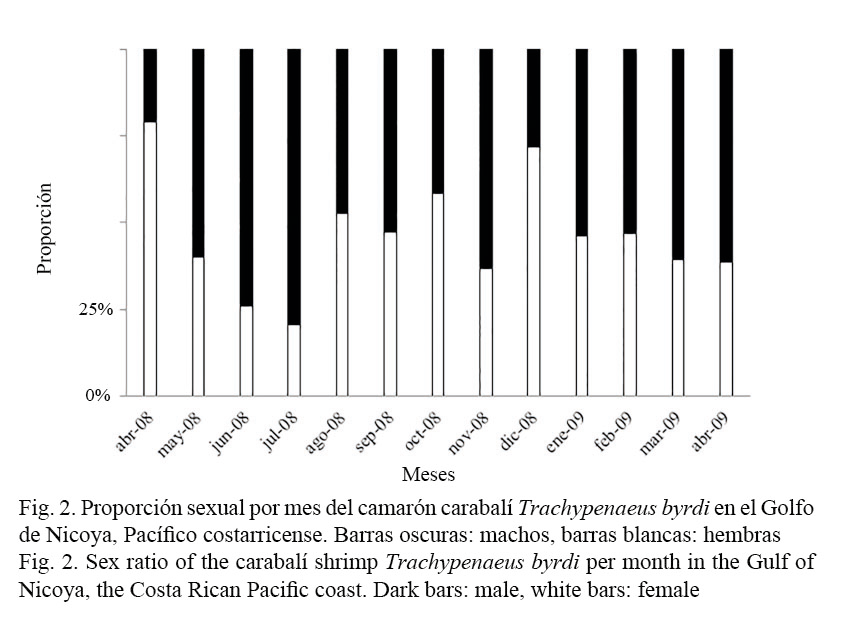
Una de las características de esta especie es un marcado dimorfismo sexual, evidente tanto en las estructuras sexuales externas como en su talla mensual de captura. En este estudio se realizaron los análisis por separado, ya que las hembras presentaron mayor talla media de captura que los machos, el ANOVA de una vía resultó con valor F y P = 0, demostrando diferencias entre los dos sexos para cada medición. Se analizó un total de 3 568, 44.9% hembras y 55.1% machos (Fig. 2). Durante la mayor parte del muestreo, dominaron los machos, con mayor porcentaje en los meses de mayo, junio y julio del año 2008 y el más bajo en el mes de abril de ese mismo año (Fig. 2). Existen diferencias significativas entre la abundancia de machos y hembras en todos los meses muestreados (Chi2 = 248.37; P = 0.000). La proporción en la población de T. byrdi fue de ocho hembras por cada diez machos. La longitud total en hembras varió de 43 a 148 mm con una moda de 87 mm; mientras que en el caso de los machos la longitud total varió de 40 a 112 mm con una moda de 83 mm. Los datos de tallas y pesos descritos a través de un modelo potencial mostró isometría, donde la relación longitud-peso para las hembras fue de P = 0.00002·Lt2.96 (R2 = 0.94) y para los machos fue de P = 0.00002·Lt2.88(R2 = 0.91).
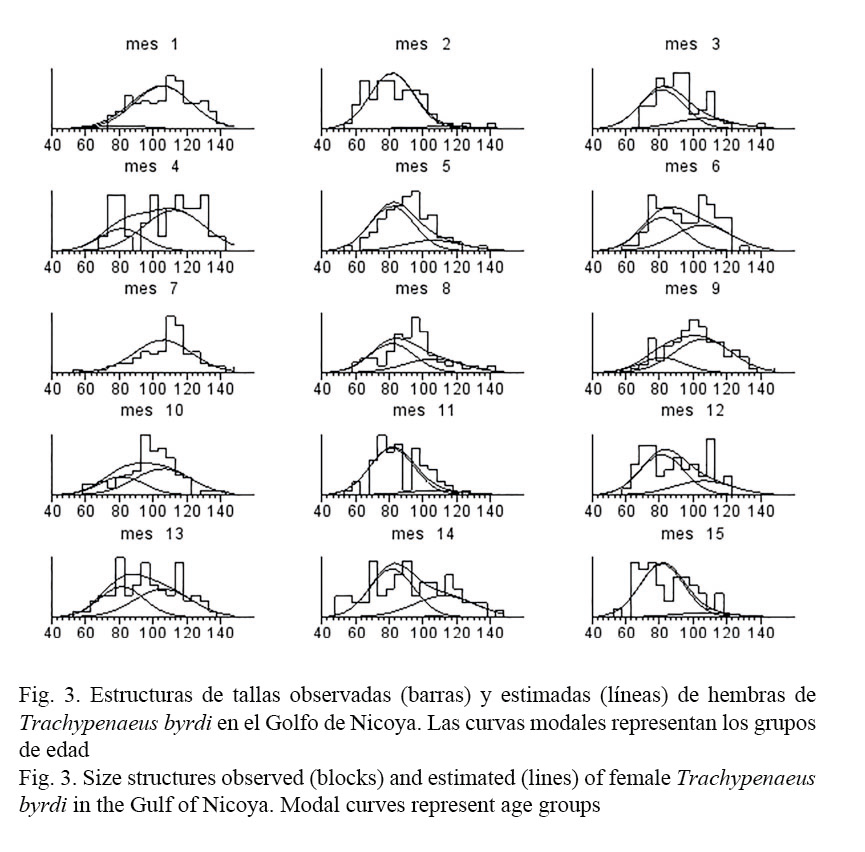
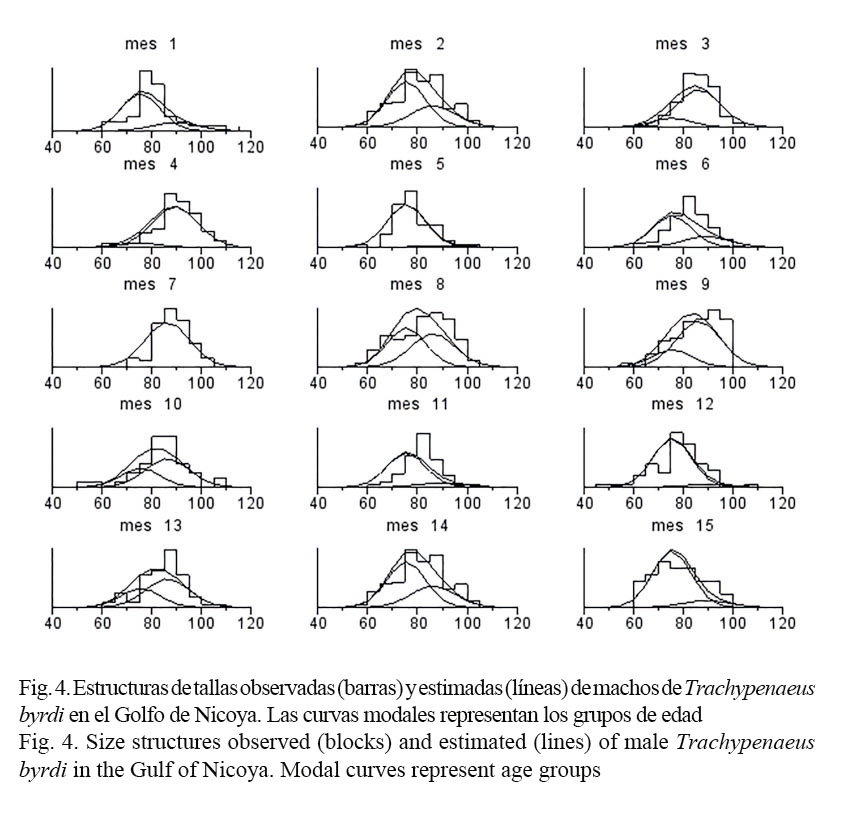
El análisis de las composiciones de tallas (Canales & Arana, 2009) supuso que la población explotada está constituida por tres grupos de edad. El ajuste del modelo se resume en las figuras 3 y 4, donde las barras representan los datos y las líneas muestran el modelo junto a las clases anuales. De estas se desprende que el modelo pudo recoger una gran parte de la variabilidad mensual de las composiciones de tallas observadas.
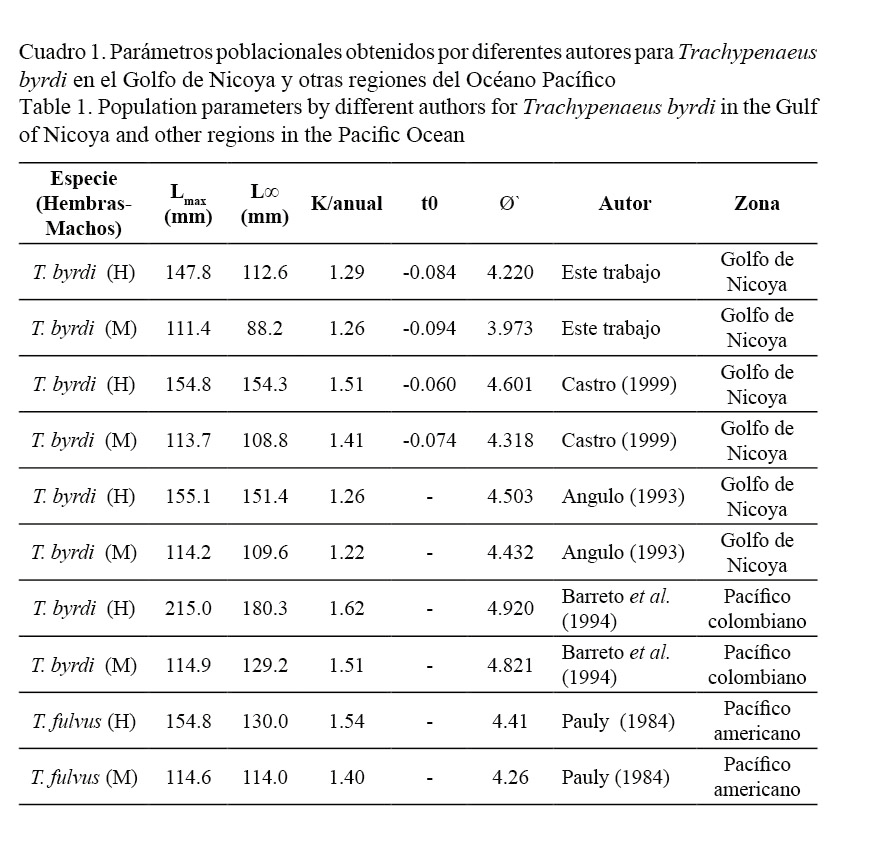
Los parámetros de crecimiento obtenidos en este estudio y los consignados en la literatura se muestran en el cuadro 1. Las hembras alcanzan tallas más grandes que los machos, por lo que presentan una mayor longitud asintótica; sin embargo, la tasa de crecimiento para ambos sexos es similar (Fig. 5). Los valores de la constante de crecimiento obtenidos K= 1.29 para hembras y de K= 1.26 para machos son elevados (>1), consistentes y propios de especies con ciclo de vida corto, como es el caso de los camarones; en tanto que los valores de la longitud asintótica (L∞) obtenidos tanto para machos (L∞= 88.2 mm) como para hembras (L∞= 112.6 mm) se encuentran en los rangos registrados por otros autores para organismos de la misma familia (Fig. 5). Por su parte, el modelo de crecimiento expresado en peso respecto de la edad se observa en la figura 6. Las estimaciones indican que el peso total asintótico (W∞) para hembras de camarón carabalí alcanza 18.6 gr, mientras en los machos se estima en 6.7 gr.
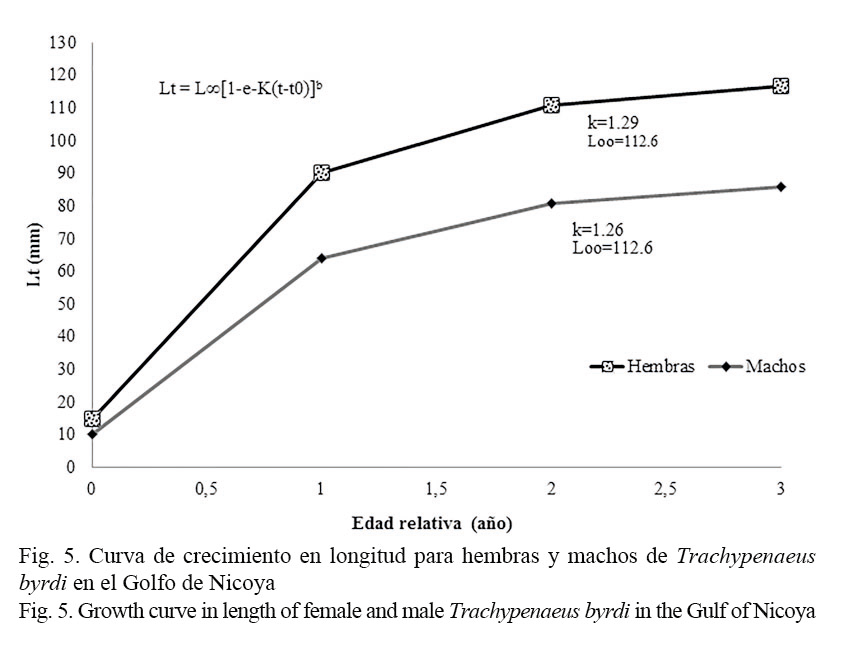
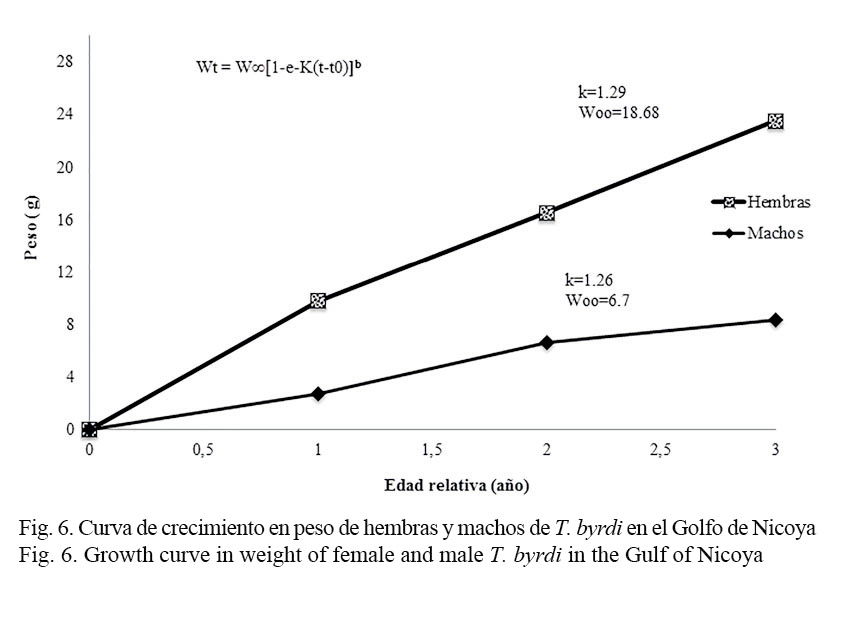
La curva de crecimiento de von Bertalanffy, generada a partir de estas estimaciones, indica que tanto en las hembras como en los machos su longevidad promedio llegaría a los 3 años.
Por su parte, el valor estimado de mortalidad natural (M) presentó como resultado valores de M=1.46 (hembras) y de 1.54 (M) para machos. La mortalidad por pesca (F) fue de 2.14 en las hembras y de 1.97 para los machos; y la mortalidad total (Z) fue de 3.60 para las hembras y de 3.50 para los machos. Por lo anterior, la tasa de explotación para T. byrdi fue calculada en E=0.59 para las hembras y de E=0.56 para los machos.
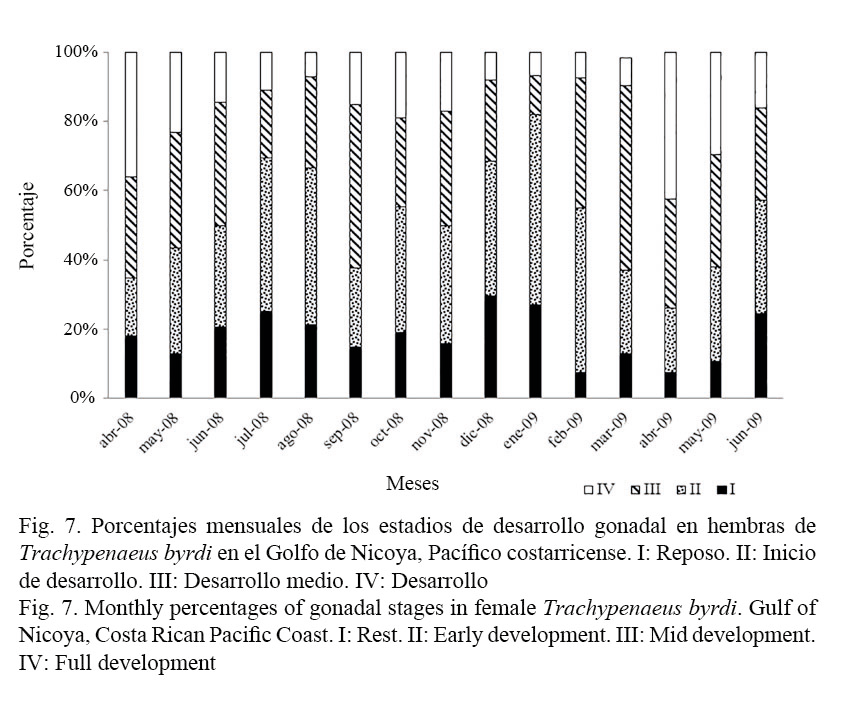
La determinación de los diferentes estadios de desarrollo gonadal en las hembras de T. byrdi se realizó a través de la observación macroscópica. En total se analizaron 1 312 hembras a lo largo del periodo de estudio. La especie se reproduce durante todo el año, presentando dos máximos de desove o puestas: uno entre marzo-abril (época seca) y otro en julio-setiembre (época lluviosa). En los meses de mayo-junio y en octubre, la gran mayoría de los especímenes recolectados se encontraban en estadios juveniles (Fig. 7).
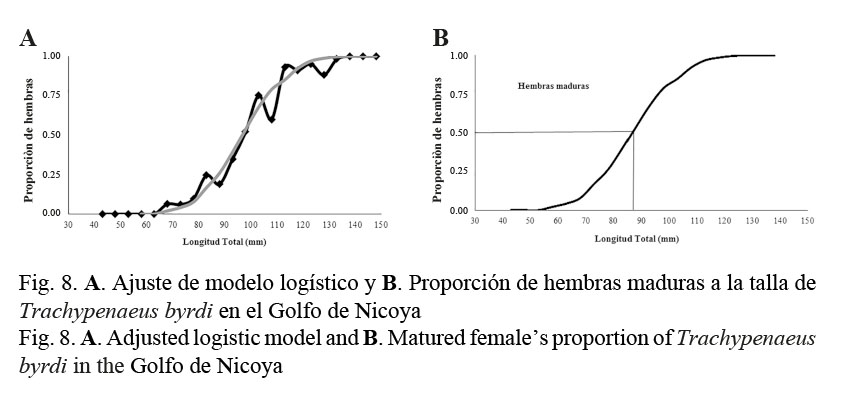
En lo que se refiere a la talla media de madurez, las hembras de T. byrdi desovan a los 87 mm de longitud total (9 meses), esto de acuerdo con los datos obtenidos (Fig. 8). Además de esto, se puede mencionar que en general no todas las hembras se encuentran maduras al tratarse de una especie de télico cerrado.
DISCUSIÓN
El rango de longitudes encontradas en esta investigación, tanto para machos como para hembras, coincide parcialmente con lo consignado para la misma especie y organismos de igual género por otros autores, a pesar de que en la actualidad no se cuenta con publicaciones similares de este camarón. Así se tiene que Castro (1999) encontró una longitud máxima para hembras de 154 mm de LT; Angulo (1993) en el Golfo de Nicoya registró 154.8 mm de LT y una L∞ de 155 mm y 160 mm, respectivamente. En el caso de Colombia, sin embargo, se estimó una L∞ de 210 mm para la misma especie (Barreto et al. 1994), un valor muy alto al compararlo con el estimado en este estudio (112.6 mm para las hembras y 88.2 mm para los machos). Por su parte, Fisher et al. (1995) también consignaron tallas de longitud asintótica mayores, en el Pacífico americano (hembras 179 mm y machos 134 mm). Este camarón, T. byrdi, al presentar un dimorfismo sexual tan marcado (Figs. 5 y 6), donde las hembras son mucho más grandes que los machos, coincide con lo anotado por Castro (1999), Barreto et al. (1994), Fisher et al. (1995) y para especies de otras variedades de este género registradas por Pauly (1984).
Los individuos más pequeños encontrados en este estudio fueron de 40 mm y 43.4 mm de LT para machos y hembras, respectivamente; Castro (1999) registró 42 mm de LT para machos y 44 mm de LT para hembras; lo que se podría explicar con las artes de pesca utilizadas en la captura comercial actual (es una pesquería relativamente joven) y con la disponibilidad del recurso en el área de pesca. Es probable que los juveniles de T. byrdi se encuentren en áreas de crianza de aguas tranquilas y someras, en zonas de manglares o lagunas costeras cercanas al área o caladeros de pesca. Además, se ha descubierto que los juveniles de T. byrdi se dirigen a los pequeños esteros y canales en búsqueda de refugio, permaneciendo fuera del área de pesca, hasta alcanzar cierta talla en la cual se reclutan al stock de adultos (Castro, 1999).
La ausencia de tallas menores (LT< 40 mm) se debe, probablemente, al arte de pesca utilizado, ya que el tamaño de malla de la red (1/4 de pulgada) no captura a organismos de esta talla, o bien, porque estos juveniles se encuentran en otras zonas de crianza.
Los parámetros de crecimiento obtenidos por el método de frecuencia de tallas (L∞= 112.6 mm; k= 1.29 año-1 y t0= -0.084 para las hembras, y en el caso de los machos con una L∞= 88.2 mm; k= 1.26 año-1 y t0= -0.094) son menores a las longitudes asintóticas registradas por Castro (1999) y Angulo (1993) en el Golfo de Nicoya. Estas diferencias se podrían explicar por el método de muestreo. En cuanto a los valores registrados por Fisher et al. (1995), Barreto et al. (1994) y Pauly (1984), podrían deberse a diferencias de crecimiento por habitar en distintas latitudes que presentan características ambientales, como la temperatura y el fotoperiodo, propias de dichas regiones, las cuales pueden variar estacionalmente y están correlacionadas con los cambios en la abundancia y calidad del alimento (ciclos de producción del mar) en el caso de las investigaciones elaboradas en Colombia y en otras regiones del Pacífico americano.
Es importante resaltar que los valores de longitud asintótica obtenidos en esta investigación están por debajo de la longitud total máxima observada, ya que la primera talla puede ser interpretada como aquella sobre la cual los organismos crecen a una tasa muy baja, o bien, como la talla promedio de los individuos más grandes de la población (Figs. 3 y 4).
Los valores de la constante de crecimiento obtenidos, como se mencionó anteriormente en este estudio para las hembras de T. byrdi (k = 1.29 año-1) y de los machos (k = 1.26 año-1), se encuentran entre los valores biológicos de esta especie (Fig. 5). Según Sparre y Venema (1995), los valores de K altos son característicos de especies de ciclo de vida corto, lo que les permite alcanzar su longitud máxima en pocos años. En esta investigación se determinó que las hembras y los machos de esta especie logran la longitud asintótica a los 1.8 años de vida.
El valor de K (constante de crecimiento) está influenciado por la longevidad, la fisiología, las condiciones ambientales, pesqueras, de estrés, entre otros factores, que pueden variar según el sexo. Además, esta especie de camarón, al tratarse de una pesquería relativamente joven, en la actualidad no se han publicado estudios similares comparables. Por estas razones, es difícil establecer un patrón definido por la relación de L∞-K entre sexos, poblaciones o especies, a pesar de que según García y Le Restre (1986) los camarones machos usualmente presentan menores L∞ y mayores K que las hembras. Al comparar con otros autores los resultados de crecimiento, para camarones en el Golfo de Nicoya o en otras partes del mundo, no parece existir una tendencia general en el comportamiento del crecimiento según el sexo; por ejemplo, en los estudios de Angulo (1993) para L. stylirostris y L. occidentalis, Palacios et al. (1993a) para L. stylirostris, Castro (1999) para T. byrdi y la presente investigación se obtuvieron valores de K menores para los machos que para las hembras; mientras que García y Le Restre (1986) y Pauly (1984) para T. fulvus registran el comportamiento inverso.
Los valores de Phi prima (Ø`) calculados para esta especie en la presente investigación y en estudios anteriores son similares (Cuadro 1). Pauly y Munro (1984) encontraron que las especies en una misma familia tienen valores similares a Ø` y calcularon este parámetro para un gran número de especies, se encontró que, dentro de una familia, los valores de Ø` están normalmente distribuidos. El valor del coeficiente de variación del índice de crecimiento Ø` indica similitud en los parámetros de crecimiento de T. byrdi obtenidos por diferentes autores, tanto en el Golfo de Nicoya como en otras zonas del Pacífico americano.
La población de T. byrdi estaría compuesta por tres grupos de edades (Figs. 3 y 4). De este modo, la talla media de cada grupo de edad corresponde a la talla promedio de las mudas sucesivas de ese mismo grupo de edad.
Por su parte, los valores de mortalidad natural estimados en este trabajo se encontraron entre los valores promedio de mortalidad obtenidos para camarones de la misma familia, tanto en el Golfo de Nicoya como en otras zonas del Pacífico (Angulo, 1993; Palacios et al. 1993b; Castro, 1999), ya que no se hallaron otros trabajos similares y actualizados para esta especie. En cuanto a la tasa de mortalidad por pesca estimada en este estudio (F=2.14 para hembras y de F=1.97 para machos), esta varía respecto de la valorada por Castro (1999), debido principalmente a las diferencias concernientes a las estimaciones de L∞ informadas por este autor. A partir de los valores y de las tasas de explotación estimadas para hembras (E= 0.59) y machos (E= 0.56), es posible establecer un moderado estado de sobreexplotación de este recurso en el Golfo de Nicoya.
En relación con su ciclo reproductivo, es sabido que por habitar en ambientes tropicales y tener un ciclo de vida corto, esta especie presenta desoves continuos durante todo el año. Sin embargo, con los resultados de este estudio, se pudo determinar un comportamiento cíclico en el desove, observándose dos picos máximos o de mayor reproducción, relacionados probablemente con factores ambientales: uno entre marzo-abril y el otro entre julio-setiembre (Fig. 7) (Palacios et al. 1993a). En efecto, los datos obtenidos podrían sugerir que el camarón desova y se recluta cada 2 meses de manera sincrónica (Figs. 2 y 3) a partir de mayo y en torno a una talla de 60 mm de LT. Estos resultados coinciden con los registrados para la misma especie por Castro (1999) y Angulo (1993).
En cuanto a la talla media de madurez sexual en hembras determinada en 87 mm de longitud total para T. byrdi, esta se estimó significativamente inferior a la informada por Castro (1999) (L∞=119 mm), implicando con esto, en términos teóricos, que T. byrdi dispone de una mayor producción en el desove (a menor L50% mayor producción de huevos) y, por ende, de mejores expectativas frente a una sobreexplotación de su población. Probablemente, las diferencias en la L50% se deben a la escala de madurez empleada en este trabajo (Figs. 8A y 8B).
Finalmente, se destaca la importancia en el conocimiento acerca de los periodos de reproducción de una especie, ya que es a partir de dicha información que se puede establecer un manejo adecuado de esta y así permitir que la población se reproduzca y asegurar, por tanto, que la biomasa explotable y la actividad extractiva se mantengan en el tiempo.

Artículo por Revista Ciencias Marinas y Costeras se distribuye bajo una Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 Costa Rica License.
Basada en una obra en http://www.revistas.una.ac.cr/index.php/revmar.
Permisos que vayan más allá de lo cubierto por esta licencia pueden encontrarse en revmar@una.cr.
BIBLIOGRAFÍA
Angulo, R. (1993). Crecimiento, mortalidad y madurez sexual de Penaeus stylirostris, Penaeus occidentalis y Trachypenaeus byrdi en el Golfo de Nicoya, Costa Rica. Tesis de Licenciatura no publicada, Universidad Nacional, Heredia, Costa Rica.
Barreto, C., Valderrama, M. & Ramírez, A. (1994). Estados de explotación, rendimiento sostenible, reclutamiento a la pesquería y lineamientos de ordenación de la pesca de camarón de aguas someras de Penaeus occidentalis, Xiphopenaeus riveti y Trachypenaeus byrdi, en el Pacífico Colombiano. Bol. Cient. INPA., 2(2), 96-109.
BIOMARCC-SINAC-GIZ. (2013). Evaluación de las pesquerías em la zona media y externa del Golfo de Nicoya, Costa Rica: San José, Costa Rica. BIOMARCC-SINAC-GIZ.
Cadima, E. L. (2003). Manual de evaluación de recursos pesqueros. Roma, Italia: FAO.
Calvo Vargas, E., Boza Abarca, J. & Berrocal Artavia, K. (2014). Efectos de El Niño y La Niña sobre el comportamiento del microfitoplancton marino y las variables fisicoquímicas durante el 2008 a 2010 en el Golfo de Nicoya, Costa Rica. Rev. Mar. Cost., 6, 115-133. doi:10.15359/revmar.6.8
Canales, C. & Arana, P. M. (2009). Crecimiento, mortalidad y evaluación de la población de cangrejo dorado (Chaceonchilensis) explotado en el archipiélago de Juan Fernández, Chile. Lat. Am. J. Aquat. Res., 37(3), 313-326. http://dx.doi.org/10.3856/vol37-issue3-fulltext-4
Castro, S. (1999). El camarón conchudo Trachypenaeus byrdi (Decapoda: Litopennaeus): Algunos aspectos de su biología y evaluación de la población alrededor de la Isla Chira, Golfo de Nicoya, Costa Rica. Tesis de Licenciatura no publicada, Universidad Nacional, Heredia, Costa Rica.
Chacón, A., Araya, H., Vásquez, A. R., Brenes, R., Marín, B., Palacios, J., … & Mejía-Arana, F. (2007). Estadísticas Pesqueras del Golfo de Nicoya (1994-2005). Proyecto Manejo Sostenible de la Pesquería para el Golfo de Nicoya. UNA-JICA-INCOPESCA. Puntarenas, Costa Rica: Hermanos Salas.
FAO. (2007). Estado mundial de la pesca y la acuicultura 2006. Roma, Italia: FAO.
Fisher, W., Krupp, F., Schneider, W., Sommer, W., Carpenter, K. & Niem, V. (1995). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Vol. III. Roma, Italia: FAO.
García, S. & Le Restre, L. (1986). Ciclos vitales, dinámica, explotación y ordenación de las poblaciones de camarones peneidos costeros. FAO Doc. Téc. Pesca, (203). Roma, Italia: FAO.
Gayanillo, F. C. Jr., Sparre, P. & Pauly, D. (1995). The FAO-ICLARM stock assessment tools (FiSAT) User’s Guide. Roma, Italia: FAO.
Gulland, J. A. & Carroz, J. E. (1968). Management of fishery resources. Adv. Mar. Biol., 86, 1-71.
Gulland, J. A. (1983). Fish stock assessments: A manual of basic methods. Chichester, Reino Unido: FAO/Wiley Series on Food and Agriculture.
INCOPESCA. (2006). Boletines anuales de pesca. San José, Costa Rica: Departamento de Estadística-INCOPESCA.
Montreuil, V., García, A. & Rodríguez, R. (1998). Longitud de primera madurez y época de desove del dorado (Brachyplatystoma flavicans) en la amazonia peruana. Fol. Amaz., 1-2(19), 23-28.
Munro, J. L. & Pauly, D. (1983). A simple method for comparing the growth of fishes and invertebrates. Fishbyte, 1(1), 5-6.
Palacios, J. A., Rodríguez, J. A. & Angulo, R. A. (1993a). Edad de primera madurez y selectividad del arte de pesca en Pennaeus stylirostris (Decapoda: Penaeidae) en el Golfo de Nicoya, Costa Rica. Rev. Biol. Trop., 41(3), 579-583.
Palacios, J. A., Rodríguez, J. A. & Angulo, R. A. (1993b). Estructura poblacional de Pennaeus stylirostris (Decapoda: Penaeidae) en el Golfo de Nicoya, Costa Rica. Rev. Biol. Trop., 41(2), 233-237.
Pauly, D. (1979). Theory and management of tropical multispecies stocks: A review with emphasis on the Southeast Asian demersal fisheries. ICLARM Stud. Rev., 156, 47-78.
Pauly, D. (1984). Fish population dynamics in tropical waters: A manual for use with programmable calculators. ICLARM Stud. Rev., 42, 297-325.
Pauly, D. & Munro, J. L. (1984). Once more on the comparison of growth in fish and invertebrates. Fishbyte, 2(1), 21-25.
Pérez-Farfante, I. (1988). Illustrated key to penaeiod shrimps of commerce in the Americas. Springfield, EE. UU.: NOAA.
R Core Team. (2014). R: A language and environment for statistical computing. Viena, Austria: R Foundation for Statistical Computing.
Sparre, P. & Venema, S. C. (1995). Introduction to tropical fish stock assessment. Part I. Roma: Italia: FAO.
Vannuccini, S. (2004). Overview of fish production, utilization, consumption and trade. Roma: Italia: FAO.