| ISSN Electrónico: 2215-3470 DOI: http://dx.doi.org/10.15359/ru.33-1.1 |
UNICIENCIA Vol. 33, N° 1. Enero-Junio, 2019 URL: www.revistas.una.ac.cr/uniciencia Correo electrónico: revistauniciencia@una.cr |
 |
 |
Abundancia, biomasa y estructura de la ictiofauna demersal del mar Caribe de América Central |
Abundance, biomass and distribution of demersal fish of the Caribbean Sea of Central América
A Abundância, a biomassa e a estrutura da ictiofauna demersal do mar Caribe da América Central
|
Rosario Benavides-Morera Laboratorio de Oceanografía y Manejo Costero, Departamento de Física, Universidad Nacional, Heredia, Costa Rica. |
Fernando Campos-Calderón Laboratorio de Oceanografía y Manejo Costero, Departamento de Física, Universidad Nacional Heredia, Costa Rica. |
Recibido-Received: 21/set/2017 • Corregido-Corrected: 12/mar/2018
Aceptado-Accepted: 16/abr/2017 • Publicado-Published: 31/ene/2019
|
Resumen Se analizaron 96 puntos de muestreo realizados a bordo del B/O Miguel Oliver, desde el 3 de enero hasta el 3 de febrero del 2011. En cada punto se llevaron a cabo faenas de pesca de arrastre utilizando una red Lofoten. Los arrastres de 30 minutos de duración cada uno se efectuaron en 25 transectos equidistantes y divididos en estratos según la profundidad local, hasta un máximo de 1500 m. Se encontraron y analizaron un total de 142 especies de peces óseos y cartilaginosos (n = 28 074) pertenecientes a 73 familias diferentes. Se determinó la abundancia relativa, la biomasa y la frecuencia de las capturas. Antigonia combatia mostró la mayor abundancia (58,5 %), Centrophorus granulosus reportó la biomasa más representativa en el estudio (10,9 %) y Nezumia aequalis fue la especie más frecuente (32,6 %). Además, se estudió el ordenamiento espacial en posibles ensamblajes de los peces como respuesta a la profundidad. El análisis de conglomerados (Mantel test r = 0,86; p < 0,05), el de ordenamiento espacial no paramétrico (NMDS) y el de similitud (ANOSIM) suponen suficiente evidencia de que las especies se encontraron agregadas en patrones espaciales con respecto al gradiente de profundidad. Palabras clave: América Central; mar Caribe; demersal; ictiofauna; plataforma continental. Abstract A total of 96 sampling points were analyzed on board the B/O Miguel Oliver from January 3 to February 3, 2011. At each sampling point, trawling operations were carried out using a Lofoten network. The trawls of 30 minutes each were performed in 25 equidistant transects and divided into strata according to local depth, up to a maximum of 1500 m. A total of 142 species of bony and cartilaginous fish (n = 28074) belonging to 73 different families were found and analyzed. Relative abundance, biomass and catch frequency were determined. Antigoniacombatia showed the highest abundance (58.5%), Centrophorusgranulosus reported the most representative biomass in the study (10.9%), and Nezumiaaequalis was the most frequent species (32.6%). In addition, the spatial distribution in possible assemblages of the fish as a response to depth was studied. The cluster analysis (Mantel test r = 0.86; p <0.05), nonparametric spatial distribution analysis (NMDS) and similarity analysis (ANOSIM) provide sufficient evidence that species were found to be aggregated into spatial patterns with respect to the depth gradient. Keywords: Central America; Caribbean Sea; demersal; ichthyofauna; continental shelf. Resumo Foram analisados 96 pontos de amostragem realizados a bordo do B/O Miguel Oliver, desde o dia 3 de janeiro até o dia 3 de fevereiro de 2011. Em cada ponto foram levados a cabo fainas de pesca de arrastre utilizando uma rede Lofoten. Os arrastos de 30 minutos de duração cada um foram realizados em 25 transeções equidistantes e divididos em estratos segundo a profundidade local, chegando ao máximo de 1500 m. Foram encontradas e analisadas um total de 142 espécies de peixes ósseos e cartilaginosos (n = 28 074) pertencentes a 73 famílias diferentes. Determinou-se a abundância relativa, a biomassa e a frequência das capturas. A Antigonia combatia mostrou uma maior abundância (58,5 %), a Centrophorus granulosus reportou a biomassa mais representativa no estudo (10,9 %) e a Nezumia aequalis foi a espécie mais frequente (32,6 %). Além disso, estudou-se o ordenamento espacial em possíveis montagens dos peixes como respuesta à profundidade. A análise de conglomerados (Mantel teste r = 0,86; p < 0,05), o de ordenamento espacial no paramétrico (NMDS) e o de semelhança (ANOSIM) supõem suficiente evidência de que as espécies se encontraram agregadas em padrões espaciais com relação ao gradiente de profundidade. Palavras-chaves: América Central; mar Caribe; demersal; ictiofauna; plataforma continental. |
Cerca del 50% de la superficie de nuestro planeta está por debajo de los 3000 m de profundidad, de modo que el mayor ecosistema de la tierra está constituido por las profundidades marinas y su gran biodiversidad. Durante mucho tiempo, la ausencia de tecnología hizo que el estudio de estos ecosistemas fuese complicado y escaso (Ramírez y Billett, 2006). Sin embargo, los avances tecnológicos de las últimas décadas han impulsado la exploración de dichos ecosistemas, contribuyendo de esta forma al estudio biológico y ecológico de la fauna que habita las zonas profundas de los océanos (Davies et al., 2007). Los recursos marinos representan una fuente importante de alimento para la población. La sobreexplotación de muchas especies de valor comercial ha hecho que las flotas pesqueras en muchos países estén implementando artes de pesca para niveles cada vez más profundos (> 500 m) en la columna de agua, en busca de nuevas alternativas que sustenten las necesidades alimenticias y las demandas de algunos mercados. Los ciclos de vida que caracterizan a las especies habitantes de estas zonas del océano las hacen muy vulnerables ante una posible extracción intensiva (Wehrtmann et al., 2012).
A pesar de que este tipo de pesquería se viene practicando en Europa desde antes de la II Guerra Mundial, no es sino hasta los años ochenta que se tienen registros de algunas revisiones biológicas y pesqueras de esta actividad (Koslow et al., 2000). Su auge ocurrió a partir de 1969, cuando las técnicas de pesca mejoraron, permitiendo su expansión y, consecuentemente, aumentando la vulnerabilidad de las especies de profundidad (Gordon et al., 2003). Por esta razón, hasta hace poco tiempo la mayoría de los datos que estaban disponibles pertenecían a estudios realizados en el océano Atlántico, (Gordon et al., 2003; Large et al., 2003; Powell et al., 2003).
En el 2004, las capturas mundiales de especies de aguas profundas significaron 5,6 millones de toneladas, de las cuales cerca del 3 % correspondió a países de América Latina, entre ellos Chile y Brasil (Arana et al., 2009). Según la Organización para la Agricultura y la Alimentación (FAO, 2007), en el océano Atlántico Central las pesquerías de aguas profundas se centran en especies de sables (Trichiuridae) y merluza (Merlucciidae), al ser el principal objetivo los peces cartilaginosos. De este grupo en particular, existe más información científica para áreas costeras del margen este de América, como el trabajo publicado sobre ensamblaje de tiburones de profundidad ligados a la pesca de arrastre de camarón en las costas del Caribe colombiano, realizado por Acevedo et al. (2007).
Para el caso específico de América Latina, la información disponible sobre extracción de aguas profundas es mayoritariamente acerca de invertebrados demersales y bentónicos (Arana et al., 2009). Wehrtmann y Nielsen (2009) estudiaron la pesca de arrastre de crustáceos decápodos del Pacífico de Costa Rica, identificando tres especies de interés comercial como las más importantes en las capturas, Heterocarpus affinis, H. vicarius y Solenocera agassizii. También, Wehrtmann et al. (2012), en una revisión sobre la pesca del camarón en el nivel latinoamericano, encontró que en el área se pesca un total de 17 especies con fines comerciales, mientras que Costa Rica, Colombia y Chile son los países que llevan a cabo pesca de camarones en aguas profundas.
En el caso del Caribe centroamericano, existe poca información sobre la biodiversidad o taxonomía de especies de profundidad, con excepción de Belice y Panamá (Alvarado et al., 2008).
Más allá del interés económico de los recursos pesqueros de aguas profundas, resulta imperativo investigar sus aspectos biológicos con la finalidad de contribuir a incrementar el conocimiento científico que se tiene de aquellos. Características reproductivas ligadas a sus ciclos de vida, como lo son sus limitadas capacidades de reproducción, madurez sexual, tasas de fecundidad, entre otros, son algunos de los aspectos que deben ser abordados en el futuro inmediato (Morato et al., 2006). En este contexto, es importante comprender el grado de estabilidad y vulnerabilidad de los ambientes y sus comunidades demersales, realizando, simultáneamente, evaluaciones de la diversidad biológica, para proporcionar datos que ayuden en la administración de los recursos de la zona cuando sea necesario.
La información de los organismos marinos o estudios de sus asociaciones en aguas profundas del Caribe centroamericano es casi inexistente y contextualiza el objetivo principal de este trabajo. Se busca contribuir al estudio de algunos rasgos ecológicos poblacionales de la ictiofauna demersal en dicha región, con el fin de proporcionar nuevos datos sobre su composición y estructura. Es un esfuerzo por solventar parcialmente algunos vacíos existentes en la ecología de las especies estudiadas y a la vez generar información que sea útil en el futuro cercano, para su aplicación en el manejo de los recursos.
Metodología
El área de estudio abarcó la plataforma y el talud continental del Caribe centroamericano, desde el sur de Panamá hasta el norte de Belice. A lo largo de esta zona, se realizó una prospección pesquera entre el 3 de enero del 2011 y el 3 de febrero del 2011. La faena de pesca se realizó a bordo del Buque Oceanográfico (B/O) Miguel Oliver, el cual utilizaba como arte de pesca una red de arrastre de fondo tipo Lofoten (arrastre con puertas), de dos tapas de paño polietileno para fondos duros, cuya longitud total era de 48,7 m; copo de 14,3 Poliamida y tren de arrastre de 41,7 m de longitud, de 1000 kg de peso aproximado.
La metodología de pesca consistió en 96 lances con una duración de 30 min de arrastre efectivo, contando desde el momento del firme del lance en el fondo hasta el inicio de la orden de virada. El control del tiempo de arrastre se realizó mediante el empleo de los sensores de red (ITI-SCANMAR). Todas las faenas de pesca fueron diurnas (Benavides et al., 2014).
Se definieron cinco estratos a diferentes profundidades en la plataforma y el talud continental. Dependiendo de la batimetría de la zona, se establecieron los puntos de muestreo dentro de 25 transectos equidistantes y perpendiculares a la costa, siguiendo criterios de estratificación previamente definidos (EI de 0 a 300 m, EII de 300 a 600 m, EIII de 600 a 900 m, EIV de 900 a 1200 m y EV de 1200 a 1500 m). En la mayoría de los puntos de muestreo se obtuvo información sobre las características físico-químicas de la columna de agua, haciendo uso de un perfilador de temperatura, salinidad y presión (CTD) marca Sea Bird, modelo SB 25 plus. Los organismos colectados en cada punto de muestreo fueron llevados al parque de pesca, donde fueron contabilizados, pesados y clasificados por sus grupos taxonómicos hasta el nivel de género y especie, con la ayuda de claves (Carpenter, 2002a, 2002b y 2002c). La validez taxonómica, la autoridad y el año de la descripción de cada especie se corroboraron según Eschmeyer et al. (2018).
Se calculó la abundancia, la biomasa y la frecuencia relativa de todas las especies capturadas durante el muestreo. Adicionalmente, se construyó una matriz de datos con los conteos de cada especie, según el punto de muestreo y la profundidad donde fue recolectada. Para reducir las influencias de números elevados y estandarizar el área de muestreo, se transformó la matriz de datos de especies colectadas a log (x + 1) y se dividió por el área muestreada de cada punto (Paramo et al., 2012). Se elaboraron gráficos de la riqueza de especies (d) y la diversidad (H’), calculados en EstimateS 9.1.0.
Se elaboró un análisis de conglomerados (Distancia-distancia de Bray-Curtis) sobre las similitudes en términos de número de individuos y, posteriormente, se graficó; se evaluó con el cálculo del coeficiente de correlación cofenético (Lapointe y Legendre, 1995). Posteriormente, se llevó a cabo un escalamiento multidimensional no métrico (NMDS). Estos análisis estadísticos se efectuaron en el programa libre R, usando los paquetes Vegan (Oksanen et al., 2013) y Mass (Venables y Ripley, 2002). Para ellos, solo se tomaron en cuenta especies con abundancias mayores a 0,5 %. Finalmente, se realizó un análisis de similaridad ANOSIM, con el fin de constatar la existencia de diferencias entre los grupos. Adicionalmente, se estimó la contribución de las especies a la similitud entre la composición de los ensamblajes, mediante una prueba de porcentajes de similitud (SIMPER). Con el propósito de explorar los efectos de las variables ambientales medidas sobre los ensamblajes encontrados, se realizaron correlaciones de Spearman entre la profundidad (m), temperatura (°C), salinidad, concentración de clorofila (mg m-3) y la abundancia total de especies para cada sustrato, cuando hubiese datos presentes. Se elaboró un análisis de componentes principales para detallar la influencia de estas variables en los sitios de muestreo, mediante análisis estadísticos del software libre PAST.
Resultados
Un total de 28 074 organismos, pertenecientes a 142 especies y 73 familias, fue capturado durante el muestreo (ver Tabla 1). La especie Antigonia combatia fue la más abundante (58,5 %), seguida de Synagrops bellus y Steindachneria argentea (ambas con 3,3 %). En cuanto a biomasa, la reportada para Centrophorus granulosus (10,9 %) fue la más alta, seguida por Polymixia lowei (9,1 %) y Squalus cubensis (6,3 %). La frecuencia fue representada mayormente por Nezumia aequalis (32,6 %), seguida por Chauliodus sloani (31,5 %) y Bathygadus favosus (25,8 %). La familia Macrouridae fue la más diversa con un total de 17 especies, seguida por las familias Rajidae y Gempylidae con seis especies cada una.
Tabla 1
Abundancia (% A), Biomasa (% B), frecuencia (% F) y rango de profundidad de las especies capturadas en el Caribe centroamericano
|
Familia |
Especie |
% A |
% B |
% F |
Rango prof. (m) |
|
Alepisauridae |
Alepisaurus ferox (Lowe, 1833) |
0,007 |
0,007 |
2,247 |
1026-1171 |
|
Acropomatidae |
Synagrops bellus (Goode y Bean, 1896) |
3,309 |
2,052 |
15,730 |
226-1193 |
|
Synagrops pseudomicrolepis (Shultz, 1940) |
0,089 |
0,053 |
1,124 |
303-1296 |
|
|
Alepocephalidae |
Xenodermichthys copei (Gill, 1884) |
0,014 |
0,011 |
3,371 |
596-770 |
|
Balistidae |
Balistes capriscus (Gmelin, 1789) |
0,004 |
0,006 |
1,124 |
915-910 |
|
Batrachoididae |
Porichthys pauciradiatus (Caldwell y Caldwell, 1963) |
0,007 |
0,003 |
1,124 |
151-159 |
|
Berycidae |
Beryx splendens (Lowe, 1834) |
0,007 |
0,008 |
2,247 |
793-827 |
|
Bothidae |
Chascanopsetta lugubris (Alcock, 1894) |
0,004 |
0,001 |
1,124 |
474-488 |
|
Chascanopsetta danae (Bruun, 1937) |
0,004 |
0,012 |
1,124 |
393-406 |
|
|
Bythitidae |
Cataetyx laticeps (Koefoed ,1927) |
0,018 |
1,386 |
2,247 |
1224-1429 |
|
Callichthydae |
Hoplostethus occidentalis (Woods, 1973) |
0,018 |
0,158 |
4,494 |
488-827 |
|
Callionymidae |
Foetorepusagassizii (Goode y Bean, 1888) |
0,021 |
0,013 |
4,494 |
258-397 |
|
Caproidae |
Antigonia capros (Lowe, 1834) |
1,197 |
0,514 |
5,618 |
121-322 |
|
Antigonia combatia (Berry y Rathjen, 1959) |
58,492 |
1,087 |
4,494 |
257-504 |
|
|
Carangidae |
Seriola rivoliana (Valenciennes, 1833) |
0,004 |
0,315 |
1,124 |
127-130 |
|
Trachurus lathami (Nichols, 1920) |
0,189 |
0,789 |
2,247 |
258-397 |
|
|
Centrophoridae |
Centrophorus granulosus (Blochy Schneider, 1801) |
0,061 |
10,862 |
8,989 |
596-875 |
|
Centrophorus tessellatus (Garman, 1906) |
0,014 |
1,121 |
2,247 |
793-952 |
|
|
Deania profundorum (Smith y Radcliffe, 1912) |
0,004 |
0,109 |
1,124 |
769-817 |
|
|
Cetomimidae |
Danacetichthys galathenus (Paxton, 1989) |
0,004 |
0,016 |
1,124 |
1071-1106 |
|
Chaunacidae |
Chaunax pictus (Lowe, 1846) |
0,004 |
0,069 |
1,124 |
400-415 |
|
Chaunax suttkusi (Caruso, 1989) |
0,289 |
0,611 |
20,225 |
330-775 |
|
|
Chlorophthalmidae |
Parasudis truculenta (Goode y Bean, 1896) |
0,513 |
0,668 |
6,742 |
257-436 |
|
Chimaeridae |
Chimaera cubana (Howell Rivero, 1936) |
0,004 |
0,084 |
5,618 |
270-1005 |
|
Hydrolagus alberti (Bigelow y Schroeder, 1951) |
0,053 |
0,812 |
5,618 |
617-753 |
|
|
Hydrolagus mirabilis (Collett, 1904) |
0,036 |
0,406 |
5,618 |
488-1061 |
|
|
Congridae |
Bathyuro congervicinus (Vaillant, 1888) |
0,021 |
0,247 |
2,247 |
824-842 |
|
Japonoconger caribbeus (Smith y Kanazawa, 1977) |
0,004 |
0,018 |
1,124 |
552-554 |
|
|
Dasyatidae |
Hypanus americanus (Hildebrandy Schroeder, 1928) |
0,007 |
0,520 |
1,124 |
240-277 |
|
Hypanus guttatus (Blochy Schneider, 1801) |
0,011 |
5,092 |
2,247 |
202-229 |
|
|
Diretmidae |
Diretmichthys parini (Post y Quéro, 1981) |
0,203 |
1,819 |
19,101 |
707-1326 |
|
Epigonidae |
Epigonus denticulatus (Dieuzeide, 1950) |
0,085 |
0,242 |
3,371 |
485-548 |
|
Epigonus macrops (Brauer, 1906) |
0,014 |
0,049 |
2,247 |
706-775 |
|
|
Etmopteridae |
Etmopterus carteri (Springer y Burgess, 1985) |
0,004 |
0,003 |
1,124 |
496-596 |
|
Etmopterus gracilispinis (Krefft, 1968) |
0,064 |
1,675 |
7,865 |
742-1173 |
|
|
Etmopterus schultzi (Bigelow, Schroeder y Springer, 1953) |
0,004 |
0,008 |
1,124 |
676-739 |
|
|
Evermannellidae |
Odontostomops normalops (Parr, 1928) |
0,007 |
0,002 |
2,247 |
1414-1418 |
|
Gempylidae |
Lepidocybium flavobrunneum (Smith, 1843) |
0,007 |
0,033 |
2,247 |
1135-1337 |
|
Nealotus tripes (Johnson, 1865) |
0,004 |
0,001 |
1,124 |
544-553 |
|
|
Neoepinnula americana (Grey, 1953) |
1,870 |
1,502 |
12,360 |
158-523 |
|
|
Nesiarchus nasutus (Johnson, 1862) |
0,021 |
0,264 |
5,618 |
793-1135 |
|
|
Promethichthys prometheus (Cuvier, 1832) |
0,178 |
0,763 |
15,730 |
397-1457 |
|
|
Ruvettus pretiosus (Cocco, 1833) |
0,011 |
0,027 |
2,247 |
488-509 |
|
|
Grammicolepididae |
Xenolepidichthys dalgleishi (Gilchrist, 1922) |
0,887 |
0,574 |
11,236 |
396-1362 |
|
Halosauridae |
Halosaurus guentheri (Goode y Bean, 1896) |
0,146 |
0,133 |
4,494 |
824-1418 |
|
Halosaurus ovenii (Johnson, 1864) |
0,353 |
0,408 |
20,225 |
371-1429 |
|
|
Hexanchidae |
Heptranchias perlo (Bonnaterre, 1788) |
0,004 |
0,089 |
1,124 |
260-276 |
|
Holocentridae |
Ostichthys trachypoma (Günther, 1859) |
0,007 |
0,006 |
1,124 |
158-159 |
|
Labridae |
Decodon puellaris (Poey, 1860) |
0,018 |
0,009 |
2,247 |
154-226 |
|
Lophiidae |
Sladenia shaefersi (Caruso y Bullis, 1976) |
0,004 |
0,017 |
1,124 |
435-438 |
|
Lutjanidae |
Lutjanus analis (Cuvier, 1828) |
0,004 |
0,458 |
1,124 |
158-159 |
|
Lutjanus vivanus (Cuvier, 1828) |
0,039 |
2,809 |
3,371 |
154-202 |
|
|
Pristipomoides macrophthalmus (Müller yTroschel, 1848) |
2,490 |
3,966 |
12,360 |
154-274 |
|
|
Rhomboplites aurorubens (Cuvier, 1829) |
0,830 |
1,881 |
6,742 |
154-257 |
|
|
Macrouridae |
Bathygadus favosus (Goode y Bean, 1886) |
0,684 |
3,968 |
25,843 |
775-1457 |
|
Bathygadus melanobranchus (Vaillant, 1888) |
0,053 |
0,546 |
3,371 |
617-824 |
|
|
Coelorinchus caelorhincus (Risso, 1810) |
0,100 |
0,117 |
4,494 |
226-1296 |
|
|
Caelorinchus occa (Goode y Bean, 1885) |
0,192 |
1,223 |
11,236 |
706-1429 |
|
|
Caelorinchus ventrilux (Marshall y Iwamoto, 1973) |
1,151 |
0,426 |
2,247 |
130-596 |
|
|
Cetonurus globiceps (Vaillant, 1884) |
0,014 |
0,039 |
3,371 |
1414-1457 |
|
|
Coryphaenoides alateralis (Marshall y Iwamoto, 1973) |
0,036 |
0,831 |
7,865 |
826-1362 |
|
|
Coryphaenoides mexicanus (Parr, 1946) |
0,036 |
1,735 |
7,865 |
1089-1457 |
|
|
Coryphaenoides rudis (Günther, 1878) |
0,061 |
3,722 |
7,865 |
481-1481 |
|
|
Gadomus arcuatus (Goode y Bean, 1886) |
0,075 |
0,430 |
8,989 |
540-1224 |
|
|
Gadomus longifilis (Goode y Bean, 1885) |
0,125 |
0,146 |
20,225 |
554-1354 |
|
|
Nezumia aequalis (Günther, 1878) |
0,531 |
0,299 |
32,584 |
485-1429 |
|
|
Nezumia sclerorhynchus (Valenciennes, 1838) |
0,028 |
0,039 |
2,247 |
742-1135 |
|
|
Sphagemacrurus grenadae (Parr, 1946) |
0,378 |
0,640 |
14,607 |
397-1296 |
|
|
Trachonurus sulcatus (Goode y Bean, 1885) |
0,185 |
1,342 |
19,101 |
481-1352 |
|
|
Ventrifossa macropogon (Marshall, 1973) |
0,011 |
0,026 |
1,124 |
724-755 |
|
|
Ventrifossa mucocephalus (Marshall, 1973) |
0,203 |
0,624 |
16,854 |
407-952 |
|
|
Malacanthidae |
Caulolatilus cyanops (Poey, 1866) |
0,014 |
0,037 |
3,371 |
154-213 |
|
Melanonidae |
Melanonus zugmayeri (Norman, 1930) |
0,014 |
0,031 |
2,247 |
875-1089 |
|
Merlucciidae |
Merluccius albidus (Mitchill, 1818) |
0,271 |
2,462 |
21,348 |
213-952 |
|
Steindachneria argentea (Goode y Bean, 1896) |
3,306 |
4,570 |
14,607 |
226-1337 |
|
|
Moridae |
Laemonema goodebeanorum (Meléndez y Markle, 1997) |
0,053 |
0,094 |
6,742 |
485-617 |
|
Moridae |
Physiculus fulvus (Bean, 1884) |
0,004 |
0,001 |
1,124 |
276-330 |
|
Mullidae |
Upeneus parvus (Poey, 1852) |
0,894 |
0,734 |
2,247 |
158-274 |
|
Nemichthyidae |
Avocettina infans (Günther, 1878) |
0,007 |
0,004 |
2,247 |
1027-1171 |
|
Neoscopelidae |
Neoscopelus microchir (Matsubara, 1943) |
0,777 |
1,064 |
16,854 |
488-827 |
|
Nettastomatidae |
Venefica proboscidea (Vaillant, 1888) |
0,039 |
0,140 |
5,618 |
875-1429 |
|
Nomeidae |
Psenescya nophrys (Valenciennes, 1833) |
0,007 |
0,065 |
1,124 |
1106-1072 |
|
Ophidiidae |
Dicrolene filamentosa (Garman, 1899) |
0,004 |
0,016 |
1,124 |
1316-1358 |
|
Penopus microphthalmus (Vaillant, 1888) |
0,004 |
0,001 |
1,124 |
1330-1378 |
|
|
Xyelacyba myersi (Cohen, 1961) |
0,057 |
1,934 |
8,989 |
1095-1451 |
|
|
Paralichthyidae |
Ancylopsetta cycloidea (Tyler, 1959) |
0,004 |
0,005 |
1,124 |
202-203 |
|
Ancylopsetta dilecta (Goode y Bean, 1883) |
0,007 |
0,048 |
2,247 |
226-274 |
|
|
Cyclopsetta fimbriata (Goode y Bean, 1885) |
0,007 |
0,037 |
1,124 |
158-274 |
|
|
Citharichthys dinoceros (Goode y Bean, 1886) |
0,004 |
0,001 |
1,124 |
269-280 |
|
|
Parazenidae |
Parazen pacificus (Kamohara, 1935) |
0,089 |
0,054 |
6,742 |
226-397 |
|
Cyttopsis rosea (Lowe, 1843) |
0,292 |
0,170 |
14,607 |
226-617 |
|
|
Percophidae |
Chrionema squamentum (Ginsburg, 1955) |
0,139 |
0,124 |
14,607 |
159-617 |
|
Peristediidae |
Peristedion imberbe (Poey, 1861) |
1,984 |
0,921 |
16,854 |
127-546 |
|
Peristedion longispatha (Goode y Bean, 1886) |
0,004 |
0,002 |
1,124 |
400-415 |
|
|
Platytroctidae |
Platytroctes apus (Günther, 1878) |
0,007 |
0,008 |
2,247 |
1089-1418 |
|
Pleuronectidae |
Poecilopsetta beanii (Goode, 1881) |
0,004 |
0,001 |
1,124 |
318-327 |
|
Polymixiidae |
Polymixi alowei (Günther, 1859) |
9,756 |
9,101 |
11,236 |
226-793 |
|
Priacanthidae |
Cookeolus japonicus (Cuvier, 1829) |
0,004 |
0,003 |
1,124 |
240-277 |
|
Rajidae |
Schroederobatis americanus (Bigelow y Schroeder, 1962) |
0,007 |
0,012 |
2,247 |
554-704 |
|
Breviraja nigriventralis (McEachran y Matheson, 1985) |
0,004 |
0,006 |
1,124 |
552-556 |
|
|
Cruriraja rugosa (Bigelow y Schroeder, 1958) |
0,011 |
0,036 |
2,247 |
488-509 |
|
|
Dipturus bullisi (Bigelow y Schroeder, 1962) |
0,004 |
0,010 |
1,124 |
719-832 |
|
|
Gurgesiella atlantica (Bigelow y Schroeder, 1962) |
0,007 |
0,005 |
1,124 |
435-438 |
|
|
Leucoraja yucatanensis (Bigelow y Schroeder, 1950) |
0,018 |
0,076 |
3,371 |
270-488 |
|
|
Rhinochimaeridae |
Neoharriotta carri (Bullis y Carpenter, 1966) |
0,228 |
2,810 |
5,618 |
384-554 |
|
Rhinochimaera atlantica (Holt y Byrne, 1909) |
0,004 |
0,227 |
1,124 |
1433-1470 |
|
|
Sciaenidae |
Protosciaena trewavasae (Chao y Miller, 1975) |
0,385 |
0,562 |
1,124 |
213-301 |
|
Umbrina broussonnetii (Cuvier, 1830) |
0,046 |
0,197 |
3,371 |
266-481 |
|
|
Umbrina milliae (Miller, 1971) |
0,207 |
0,872 |
2,247 |
257-258 |
|
|
Scombrolabracidae |
Scombrolabrax heterolepis (Roule, 1921) |
0,014 |
0,025 |
4,494 |
707-1026 |
|
Scopelarchidae |
Scopelarchoides danae (Johnson, 1974) |
0,004 |
0,006 |
1,124 |
853-898 |
|
Scorpaenidae |
Pteroisolitans (Linnaeus, 1758) |
0,085 |
0,411 |
1,124 |
165-143 |
|
Scorpaena brasiliensis (Cuvier, 1829) |
0,014 |
0,013 |
2,247 |
158-258 |
|
|
Scyliorhinidae |
Apristurus parvipinnis (Springer y Heemstra, 1979) |
0,004 |
0,015 |
1,124 |
719-732 |
|
Apristurus riveri (Bigelow y Schroeder, 1944) |
0,007 |
0,028 |
1,124 |
1344-1360 |
|
|
Galeus arae (Nichols, 1927) |
0,221 |
0,292 |
7,865 |
270-548 |
|
|
Galeus springeri (Konstantinou y Cozzi, 1998) |
0,004 |
0,036 |
1,124 |
521-525 |
|
|
Schroederichthys maculatus (Springer, 1966) |
0,021 |
0,016 |
1,124 |
328-333 |
|
|
Serranidae |
Serranus maytagi (Robins y Starck, 1961) |
0,107 |
0,071 |
2,247 |
270-274 |
|
Serranus phoebe (Poey, 1851) |
0,004 |
0,013 |
1,124 |
158-159 |
|
|
Choranthias tenuis (Nichols, 1920) |
0,007 |
0,007 |
1,124 |
260-272 |
|
|
Serrivomeridae |
Serrivomer lanceolatoides (Schmidt, 1916) |
0,028 |
0,020 |
6,742 |
1005-1451 |
|
Setarchidae |
Setarches guentheri (Johnson, 1862) |
1,403 |
0,606 |
12,360 |
303-753 |
|
Ectreposebastes imus (Garman, 1899) |
0,078 |
0,167 |
6,742 |
704-824 |
|
|
Squalidae |
Squalus cubensis (Howell Rivero, 1936) |
0,488 |
6,278 |
14,607 |
226-436 |
|
Squatinidae |
Squatina dumeril (Lesueur, 1818) |
0,004 |
0,290 |
1,124 |
165-173 |
|
Stephanoberycidae |
Stephanoberyx monae (Gill, 1883) |
0,374 |
0,091 |
15,730 |
1005-1429 |
|
Stomiidae |
Chauliodus sloani (Bloch y Schneider, 1801) |
0,321 |
0,139 |
31,461 |
384-1326 |
|
Heterophotus ophistoma (Regan y Trewavas, 1929) |
0,036 |
0,147 |
5,618 |
824-1005 |
|
|
Synaphobranchidae |
Synaphobranchus kaupii (Johnson, 1862) |
0,011 |
0,086 |
3,371 |
1095-1224 |
|
Synodontidae |
Saurida caribbaea (Breder, 1927) |
0,139 |
0,046 |
3,371 |
274-396 |
|
Saurida normani (Longley, 1935) |
0,385 |
1,793 |
8,989 |
154-397 |
|
|
Synodus poeyi (Jordan, 1887) |
0,089 |
0,085 |
2,247 |
213-258 |
|
|
Tetraodontidae |
Sphoeroides pachygaster (Müller y Troschel, 1848) |
0,032 |
0,165 |
5,618 |
158-330 |
|
Triakidae |
Mustelus norrisi (Springer, 1939) |
0,007 |
0,323 |
1,124 |
150-154 |
|
Trichiuridae |
Benthodesmus simonyi (Steindachner, 1891) |
0,559 |
0,883 |
16,854 |
485-827 |
|
Trichiurus lepturus (Linnaeus, 1758) |
0,061 |
0,499 |
4,494 |
226-546 |
|
|
Triglidae |
Bellatore gretta (Goode y Bean, 1896) |
0,032 |
0,017 |
1,124 |
158-274 |
|
Prionotus punctatus (Bloch, 1793) |
0,018 |
0,092 |
1,124 |
158-274 |
|
|
Prionotus stearnsi (Jordan y Swain, 1885) |
1,190 |
0,359 |
2,247 |
274-330 |
|
|
Uranoscopidae |
Kathetostoma cubana (Barbour, 1941) |
0,046 |
0,065 |
2,247 |
158-274 |
|
Zeidae |
Zenopsis conchifer (Lowe, 1852) |
0,021 |
0,540 |
2,247 |
226-303 |
Nota: Fuente propia de la investigación.
Tanto la riqueza como la diversidad de las especies muestreadas presentan un máximo en áreas poco profundas. Ambas tienden a decrecer levemente hasta encontrar un incremento entre los 500 y los 1000 m. Por debajo de los 1000 m hay un nuevo descenso (Figura 1).
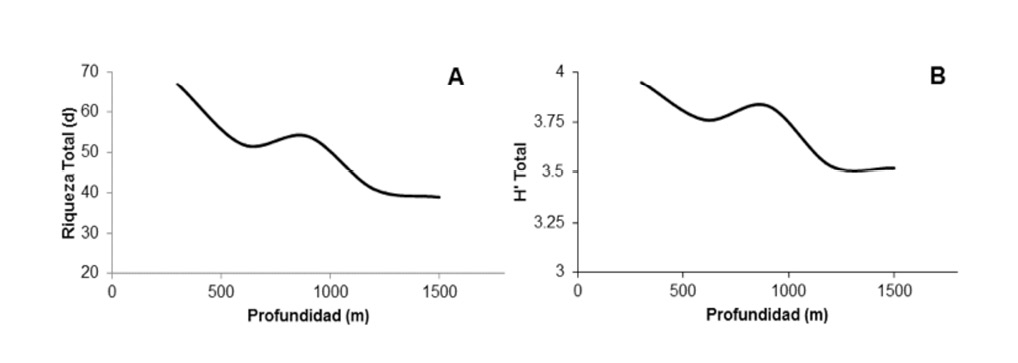
Figura 1. Modelos de las relaciones entre la riqueza de especies (d) (A) y la diversidad (H’) (B) con respecto a la profundidad (m) en el ecosistema marino estudiado.
Nota: Fuente propia de la investigación.
El análisis de conglomerados (Figura 2A) y el de NMDS (Figura 2B) evidencian que la ictiofauna se agrega en tres diferentes ensamblajes con respecto a la profundidad, I, II y III. El resultado de este análisis (Mantel test r = 0,86, p < 0,05) muestra al ensamblaje I que comprende las estaciones más superficiales, con una profundidad promedio de 331(± 105 m); el ensamblaje II presentó una profundidad promedio de 1018 m (± 346 m), siendo el más profundo, y el ensamblaje III, con una profundidad promedio de 525 m (± 202 m). El coeficiente de correlación cofenético de esta prueba (0,94) muestra que la distancia ecológica de las especies está representada de una manera adecuada. La prueba de ordinación no paramétrica evidencia una segregación de los sitios en cuanto a la variación del número de especies presentes. El valor de estrés de la prueba basado en Kruskal muestra la validez de la configuración de los datos (0,1).
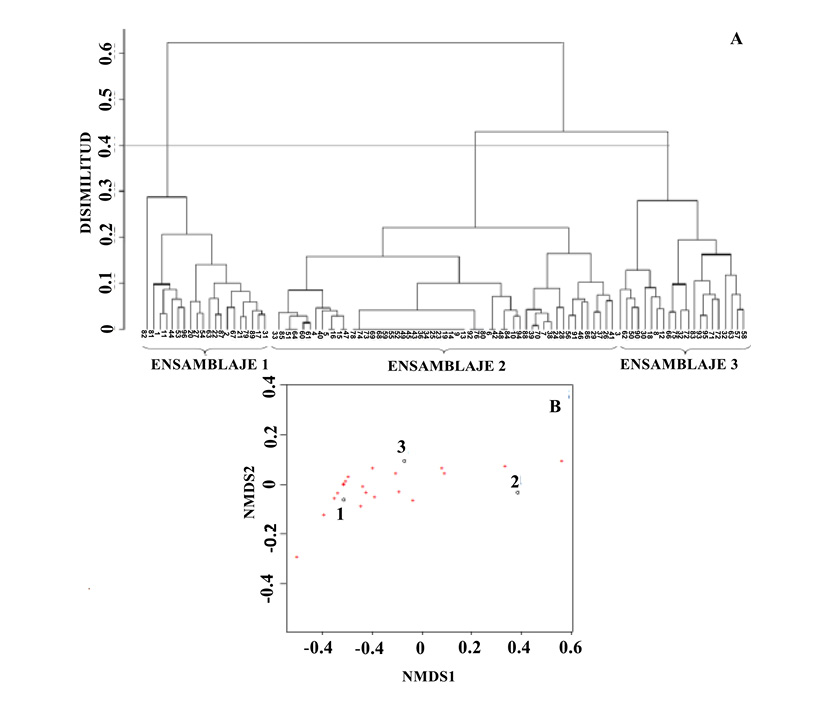
Figura 2. Dendrograma de las estaciones muestreadas donde se indica la presencia de tres ensamblajes con respecto a las especies en cada lance basado en un 0,4 de disimilaridad de Bray-Curtis (A). Escalamiento multidimensional no métrico (NMDS) de dos dimensiones que muestran los tres ensamblajes según la profundidad (B).
Nota: Fuente propia de la investigación.
La prueba ANOSIM mostró evidencia para asegurar que estos ensamblajes se diferencian en su composición (R = 1; p < 0,05). La disparidad en la composición del ensamblaje I y II versus I y III se debió principalmente a la presencia de P. lowei (ver Tabla 2). El análisis de similitud confirma la existencia de tres ensamblajes con valores elevados de disimilitud (> 60 %).
Tabla 2
Análisis de similitud (SIMPER) entre ensamblajes. Las cinco especies más importantes se enumeran en orden de su contribución a la disimilitud promedio dentro de cada conjunto.
|
Ensam. I - Ensam. II (Dis. Prom. Total. 97,84) |
|||
|
Dis. Prom. |
Contrib % |
Acum % |
|
|
Polymixia lowei |
19,29 |
19,72 |
19,72 |
|
Peristedion imberbe |
9,10 |
9,30 |
29,02 |
|
Squalus cubensis |
7,30 |
7,46 |
36,47 |
|
Synagrops bellus |
6,98 |
7,13 |
43,60 |
|
Steindachneria argentea |
5,94 |
6,08 |
49,68 |
|
Ensam. I - Ensam. III (Dis. Prom. Total. 82,2) |
|||
|
Dis. Prom. |
Contrib % |
Acum % |
|
|
Polymixia lowei |
13,02 |
15,84 |
15,84 |
|
Peristedion imberbe |
6,72 |
8,17 |
24,00 |
|
Steindachneria argentea |
5,84 |
7,10 |
31,11 |
|
Synagrops bellus |
5,46 |
6,65 |
37,75 |
|
Pristipomoides macrophthalmus |
5,43 |
6,61 |
44,36 |
|
Ensam. II - Ensam. III (Dis. Prom. Total. 90,9) |
|||
|
Dis. Prom. |
Contrib % |
Acum % |
|
|
Neoscopelus microchir |
12,33 |
13,56 |
13,56 |
|
Benthodesmus simonyi |
10,16 |
11,18 |
24,74 |
|
Steindachneria argentea |
8,60 |
9,46 |
34,20 |
|
Pristipomoides macrophthalmus |
8,56 |
9,42 |
43,62 |
|
Nezumia aequalis |
8,16 |
8,98 |
52,60 |
Nota: Fuente propia de la investigación.
La correlación entre abundancia y profundidad resultó negativa y de una magnitud considerable -0,76 (p < 0,05), mientras que para la temperatura fue positiva 0,72 (p < 0,05). El oxígeno, a pesar de mostrar una correlación con significancia, tuvo una magnitud de efecto menor -0,46 (p < 0,05). Para la salinidad 0,50 (p > 0,05) y la clorofila 0,19 (p > 0,05), se obtuvieron valores de correlaciones bajas y no significativas.
El gráfico de ordinación del análisis de componentes principales (PCA) (Figura 3) muestra cómo los sitios del ensamblaje II (▲) se vieron mayormente influenciados por la profundidad, mientras que los del ensamblaje I (+) se vieron mayormente influenciados por la salinidad y la temperatura. Finalmente, los sitios del ensamblaje III se encuentran en un punto medio de transición.
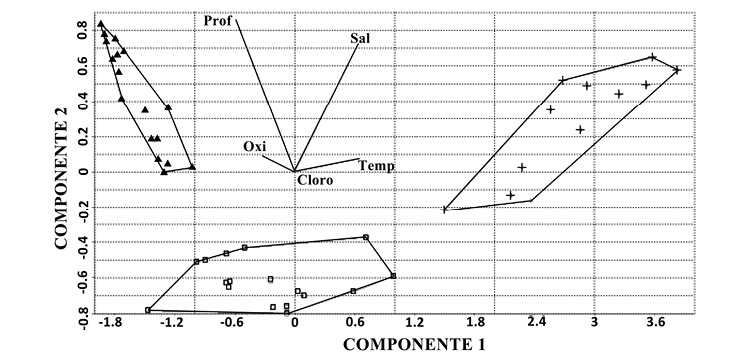
Figura 3. Ordinación del análisis de componentes principales para el ensamblaje uno (+) diferenciado por la salinidad y temperatura, el ensamblaje dos (▲) por la profundidad y el ensamblaje tres (□) con una influencia intermedia de todas las variables. Nota: Fuente propia de la investigación.
Discusión
De las tres familias más abundantes, de la que se posee menos información es Caproidae. Recientemente, Stange (2016) propuso generar una base de conocimientos para apoyar la gestión de una nueva pesquería de Capros aper (Caproidae) en el Atlántico Norte, especie muy similar a Antigonia combatia. Adicionalmente, Powell et al. (2003) encontraron que A. capros fue la más abundante en el estrato profundo del golfo de México.
Según Haimovici et al. (1994), S. bellus y Parascombrops spinosus son peces de talla pequeña con amplia distribución en el océano Atlántico Oriental y se capturan abundantemente en aguas profundas de la región sur de Brasil. Se capturaron también en aguas del Caribe colombiano, donde se les realizó un análisis de la relación entre peso y talla (Díaz et al., 2000).
De las tres especies más abundantes, resalta el carácter comercial que tienen los individuos de la familia Merlucciidae. Según Cerna y Oyarzún (1998), la merluza común (Merluccius gayi) es una de las especies más significativas por sus niveles de captura e importancia económica en las costas de Chile. Además, Merluccius hubbsi forma parte de las pesquerías de aguas demersales que se realizan en la zona argentino-uruguaya desde hace varios años atrás (Inrusta et al., 2009). El Instituto Nacional de Pesca de Ecuador y el Instituto del Mar del Perú tienen registradas importantes contribuciones de esta familia a las capturas de las flotas pesqueras de sus países. Existe mucha información para especies del Pacífico, mientras que para el Caribe no hay reportes de S. argentea o de esta familia y sus otras especies.
En cuanto a la biomasa, se puede observar que dos de las especies dominantes pertenecen al grupo de los condrictios, C. granulosus y S. cubensis, ambas son especies pelágicas de importancia comercial, las cuales realizan migraciones y se distribuyen en todo el Caribe (Benavides et al., 2014). Mientras, P. lowei se distribuye en el Atlántico Occidental desde Uruguay hasta Nueva Jersey, Estados Unidos. Su talla alcanza los 22 cm y se alimenta principalmente de Bregmaceros atlanticus y de pequeños crustáceos decápodos bentónicos (Haimovici et al., 1994).
La familia Macrouridae ha sido estudiada en la zona del Atlántico por su importancia comercial. Son peces bentopelágicos que se distribuyen entre 250 y 2000 m en el talud continental (Palacios et al., 2009). Las especies con mayor porcentaje de frecuencia fueron N. aequalis y B. favosus, que, junto con Coryphaenoides, son conocidas comúnmente con el nombre de granaderos y forman parte importante de la dieta del pescado consumido en parte del Mediterráneo. Otra de las especies más frecuentes fue C. sloani, se distribuye mundialmente; Sutton y Hopkins (1996) lo reportan en el golfo de México y describen la estructura de un ensamblaje encontrado sobre los 1000 m de profundidad.
La familia Rajidae se encuentra representada por individuos de al menos seis especies que poseen un importante valor ecológico. El mismo resultado fue reportado por Benavides et al. (2014), cuando analizaron la población de condrictios en el Caribe centroamericano. De la misma forma que la familia Rajidae, la Gempylidae contribuyó al estudio con seis especies. La asociación de ambas familias con ambientes mesopelágicos y bentopelágicos de áreas tropicales, subtropicales y templadas es global, y se conoce poco sobre ellas (Nakamura y Parin, 2002).
Acero y Rueda (1992) reportaron la presencia de Prometichtys prometeus en el Caribe colombiano. En el presente estudio, P. prometeus obtuvo una frecuencia significativa, se encontró entre los 400 y 1400 m de profundidad, con tallas que oscilaron entre los 20 y 50 cm. Recientemente, se registró el primer reporte de Ruvettus pretiosus en el Caribe colombiano (Gómez-Cubillos y Grijalba-Bendeck, 2016).
Las familias Bathygadidae, Macrouridae, Merlucciidae y Moridae encontradas en este trabajo pertenecen al orden de los gadiformes, uno de de los grupos de peces de profundidad más explotados históricamente. Según Koslow et al. (2000), tienen especies distribuidas sobre el talud continental y poseen características biológicas que las hacen vulnerables a las actividades extractivas. Por ejemplo, Beryx splendens, encontrada en nuestro trabajo, es una especie que tiene congéneros de valor comercial que se extraen en el Atlántico de Portugal desde hace más de una década (Alagador y Costa, 2003).
La riqueza y la diversidad decrecen con respecto a la profundidad. Un resultado similar fue reportado por Acevedo et al. (2012), quienes atribuyen este comportamiento a las condiciones ambientales (disminución tanto de la temperatura como de la concentración de O2 disuelto) que cambian drásticamente con la profundidad. Powell et al. (2003) llegaron a la misma conclusión para la ictiofauna demersal de aguas profundas en el golfo de México. Fujita et al. (1995) sostienen que los cambios que presentan principalmente la temperatura, la salinidad, el oxígeno disuelto así como el sustrato, los sedimentos y el nivel de luz son algunos de los factores que modulan dicho comportamiento.
El patrón de la riqueza específica observado cambia con la profundidad. Este patrón ya había sido observado por Paramo et al. (2012) en la región del Caribe. Según Smith y Brown (2002), la tendencia a decrecer de la diversidad marina es una característica que refleja la influencia de las condiciones ambientales; así, los peces pelágicos se ven afectados por factores que incluyen tanto la depredación intensa como las adaptaciones fisiológicas a las altas temperaturas y a las bajas presiones que exhiben las aguas más superficiales. Por otro lado, sugieren que una combinación de alta productividad y temperatura cálida promueve una alta diversidad de especies en esos estratos.
El análisis de conglomerados y la prueba de la ordenación NMDS evidencia significativamente tres ensamblajes (Figuras 2A, 2B). Los resultados significativos de la prueba ANOSIM y el análisis SIMPER (Tabla 2) corroboran que en general hay un 97 % de disimilaridad en la composición de los ensamblajes I y II, 82 % entre I y III y un 90 %, entre II y III. Esto evidencia que la comunidad de los peces demersales del Caribe centroamericano presenta una conformación en grupos. Dentro de los ensamblajes identificados, existen características en común referentes a la composición de especies y se diferencian en cuanto a su localización y batimetría. Páramo (2012) encontró en el mar Caribe tres ensamblajes diferenciados en cuanto a su distribución vertical y determinó que la localización y la profundidad juegan un papel importante en configurar los ensamblajes ictiofaunísticos. Este resultado coincide con lo reportado en el presente trabajo.
Tamdrari et al. (2015) consideran que es difícil identificar el factor responsable de la estructura espacial de las comunidades a lo largo del gradiente batimétrico. Sin embargo, Katsanevakis y Maravelias (2009) reconocen que frecuentemente el gradiente batimétrico se constituye en el principal elemento modulador a lo largo del cual ocurren los cambios faunísticos en los ensamblajes sobre la plataforma y el talud continental. Además, como fue mencionado anteriormente, el nivel de luz, sustrato y sedimentos, macrofauna béntica, así como características físicas y químicas como temperatura, oxígeno disuelto, salinidad y corrientes tienen una influencia directa en la distribución espacial de las comunidades demersales (Fujita et al., 1995; Tamdrari et al., 2015). Por otro lado, Merrett y Haedrich (1997) señalan que factores biológicos como la abundancia de predadores y presas pueden influir también en regular la distribución de los ensamblajes de la ictiofauna.
La época del año puede ser un posible factor en determinar la composición de las especies encontradas, ya que algunas realizan migraciones de desove o alimentación (Clark et al., 2010). La agregación de individuos de determinadas especies también se puede explicar en menor medida por diversas características relacionadas con las interacciones bióticas intrínsecas que ocurren entre ellas y no solamente por los cambios en la profundidad (Pauly et al., 2000; Katsanevakis y Maravelias, 2009).
En el presente trabajo se encontró, en el PCA, que los dos principales efectos modeladores de la abundancia de los ensamblajes fueron, en mayor porcentaje, la profundidad seguida de la temperatura, mientras que los bajos valores de correlación muestran que las otras variables ambientales no tuvieron más influencia sobre los ensamblajes. Por otro lado, los sitios menos someros del ensamblaje I se diferenciaron por la temperatura y los más someros por la salinidad.
La presencia de algunas especies desconocidas en la zona, así como otras de importancia comercial conformando los diferentes ensamblajes indican lo importante y variada que puede ser esta comunidad. La comprensión de estos ensamblajes contribuye no solo al conocimiento de la ecología de las especies de profundidad, sino que podría, en el futuro, ser utilizada para analizar su potencial riesgo, si se convirtieran en objetivo de nuevas pesquerías. Por otro lado, en la actualidad, el uso de indicadores simples como la productividad y el análisis de susceptibilidad (PSA) ha ayudado a superar las deficiencias y limitaciones de información de datos (Patrick et al., 2010; Ye et al., 2011), sin dejar de lado que la conservación y protección de los hábitats son indispensables para desarrollar una gestión racional y sostenible de los recursos que existen en aguas profundas.
La investigación futura debe abordar aspectos de las diferentes especies y su interacción con el hábitat, mediante modelajes desde los niveles de productividad hasta los tróficos de la ictiofauna, para evidenciar la importancia de las características de la columna de agua en el patrón de dispersión espacial y temporal de los organismos. El presente estudio revela aspectos importantes de la comunidad de peces que habita las aguas profundas en la región caribeña, así como su relación con algunas características físicas. Ambos constituyen los primeros pasos para continuar con la evaluación de los recursos de la región hacia un enfoque ecosistémico que considere las interacciones ecológicas, tales como la competencia y la presa, las especies objetivo con los depredadores y las interacciones entre peces.
Agradecimientos
Este trabajo fue financiado parcialmente por la Universidad Nacional, a través del Proyecto de Investigación Servicio Regional de Información Oceanográfica. Nuestro agradecimiento al Lic. Mario González Recinos, exdirector de OSPESCA, por permitirnos acceder a la información de campo.
Referencias
Acero, P. A. y Rueda, A. (1992). Presencia de Prometichtys prometeus (Cuvier) (Pisces: Gemplylidae) en el Caribe Colombiano. Anales del Instituto de Investigaciones Marinas, 21, 127-130.
Acevedo, K.; Bohórquez-Herrera, J.; Moreno, F.; Moreno, C.; Molina, E.; Grijalba-Bendeck, M. y Gómez-Canchong, P. (2007). Tiburones y rayas (Subclase Elasmobranchii) descartados por la flota de arrastre camaronero en el Caribe de Colombia. Acta Biológica Colombiana, 12(2), 69-80.
Alagador, D. A. y Costa, P. M. (2003). Distribution patterns of deep-sea benthopelagic fish off the Algarve coast (Portugal). Boletín del Instituto Español de Oceanografía, 19(1-4), 407-417.
Alvarado, J. J.; Solís-Marín F. A. y Ahearn, C. (2008). Equinodermos (Echinodermata) del Caribe Centroamericano. Revista Biología Tropical, 56(3), 37-55.
Arana, P.; Pérez, J. A. y Pezzuto, P. R. (2009). Deep-sea fisheries off Latin America: an introduction. Latin American Journal of Aquatic Research, 37(3), 281-284.
Benavides, M. R.; Brenes, R. C. L. y Márquez, A. A. (2014). Análisis de la población de condrictios (Vertebrata: Chondrichthyes) de aguas demersales y profundas del Caribe centroamericano, a partir de faenas de prospección pesquera con redes de arrastre. Revista de Ciencias Marinas y Costeras, 6, 9-27. Doi https://doi.org/10.15359/revmar.6.1
Carpenter, K. E. (2002a). FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5. The living marine resources of the Western Central Atlantic. Volume 1: Introduction, molluscs, crustaceans, hagfishes, sharks, batoid fishes, and chimaeras. Roma, Italia: FAO.
Carpenter, K. E. (2002b). FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5. The living marine resources of the Western Central Atlantic. Volume 2: Bony fishes part 1 (Acipenseridae to Grammatidae). Roma, Italia: FAO.
Carpenter, K. E. (2002c). FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5. The living marine resources of the Western Central Atlantic. Volume 3: Bony fishes part 2 (Opistognathidae to Molidae), sea turtles and marine mammals. Roma, Italia: FAO.
Cerna, J. F. y Oyarzún, C. (1998). Talla de primera madurez sexual y fecundidad parcial de la merluza común (Merluccius gayi, Guichenot 1848) del área de la pesquería industrial de la zona de Talcahuano, Chile. Investigaciónes Marinas, 26, 31-40. Doi https://doi.org/10.4067/S0717-71781998002600004
Clark, M. R.; Althaus, F.; Williams, A.; Niklitschek, E.; Menezes, G. M.; Hareide, N. R.; Sutton, P. y O’Donnell, C. (2010). Are deep-sea demersal fish assemblages globally homogenous? Insights from seamounts. Marine Ecology, 31(1), 39-51. Doi https://doi.org/10.1111/j.1439-0485.2010.00384.x
Davies, A. J.; Roberts, J. M. y Hall-Spencer, J. (2007). Preserving deep-sea natural heritage: emerging issues in offshore conservation and management. Biology Conservancy, 138(3-4), 299-312. Doi https://doi.org/10.1016/j.biocon.2007.05.011
Díaz, L. S.; Roa, A.; García, C. B.; Acero, A. y Navas, G. (2000). Length-Weight Relationships of demersal Fishes from the Upper Continental Slope off Colombia. Naga: the ICLARM Quarterly, 23(3).
Eschmeyer, W. N.; Fricke, R. y Van der Laan, R. (2018). Catalog of Fishes: genera, species, references. California Academy of Sciences. Recuperado de http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp
Food and Agriculture Organization of the United Nations (FAO). (2007). Report and documentation of the Expert Consultation on Deep-sea Fisheries in the High Seas. Fisheries Report. No. 838. Bangkok, Tailandia.
Fujita, T.; Inada, T. e Ishito, Y. (1995). Depth-gradient structure of the demersal fish community on the continental shelf and upper slope off Sendai Bay, Japan. Marine Ecology Progress Series, 118, 13-23. Doi https://doi.org/10.3354/meps118013
Gómez, C. M. C. y Grijalba, B. M. (2016). Presence of Ruvettus pretiosus (Gempylidae) in the Colombian continental Caribbean. Universitas Scientiarum, 21(1), 53-61. Doi https://doi.org/10.11144/Javeriana.SC21-1.porp
Gordon, J. D. M.; Bergstad, O. A.; Figueiredo, I. y Menezez, G. (2003). Deep-water Fisheries in the Northeast Atlantic: I. Description and Current Trends. Journal of Northwest Atlantic Fishery Science, 31, 137-150. Doi https://doi.org/10.2960/J.v31.a10
Haimovici, M.; Silva, M. A.; Lima de Figueiredo, J. y Castelli, V. P. (1994). Demersal bony fish of the outer shelf and upper slope of the southern Brazil Subtropical Convergence Ecosystem. Marine Ecology Progress Series, 108, 59-77. Doi https://doi.org/10.3354/meps108059
Irusta, C. G.; Castrucci, R. y Simonazzi, M. (2009). Pesca comercial y captura por unidad, de esfuerzo de la merluza (Merluccius hubbsi) entre 34° S-41° S durante el periodo 1986-2005 y evidencias sobre cambios en la distribución y composición por tallas del recurso. Informe Técnico. Instituto Nacional de Investigación y Desarrollo Pesquero (INIDEP), Paseo Victoria Ocampo Nº 1, Escollera Norte, B7602HSA - Mar del Plata, Argentina. Recuperado de http://marabierto.inidep.edu.ar/bitstream/handle/inidep/155/INIDEPIT74.pdf?sequence=1
Katsanevakis, S. y Maravelias, C. D. (2009). Bathymetric distribution of demersal fish in the Aegean and Ionian Seas based on generalized additive modelling. Fisheries Science, 75, 13-23. Doi https://doi.org/10.1007/s12562-008-0033-5
Kendall, N. C. y Orlóci, L. (1986). Applying Metric and Nonmetric Multidimensional Scaling to Ecological Studies: Some New Results. Ecology, 64(4), 919-928.
Koslow, J. A.; Boehlert, G. W.; Gordon, J. D. M.; Haedrich, R. L.; Lorance, P. y Parin, N. (2000). Continental slope and deep-sea fisheries: implications for a fragile ecosystem. ICES. Journal of Marine Science, 57, 548-557. Doi https://doi.org/10.1006/jmsc.2000.0722
Lapointe, F. J. y Legendre, P. (1995). Comparison tests for dendrograms: A comparative evaluation. Journal of Classification, 12(2), 265-282. Doi https://doi.org/10.1007/BF03040858
Large, P. A.; Hammer, C.,; Bergstad, O. A.; Gorgon, J. D. M. y Lorance, P. (2003). Deep water fisheries of the Northeast Atlantic: II Assessment and Management Approaches. Journal of Northwest Atlantic Fishery Science, 31, 151-163. Doi https://doi.org/10.2960/J.v31.a11
Merrett, N. y Haedrich, R. (1997). Deep-Sea Demersal Fish and Fisheries. Reino Unido: Chapman and Hall, Londres.
Morato, T.; Watson, R.; Pitcher, T. J. y Pauly, D. (2006). Fishing down the deep. Fish Fisheries, 7, 23-33. Doi https://doi.org/10.1111/j.1467-2979.2006.00205.x
Nakamura, I. y Parin, N. (2002). Gempylidae, Snake mackerels (Scolars, Oilfisch). En Carpenter, K. E. (Ed.), FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5.The living marine resources of the Western Central Atlantic. Vol 3: Bony fishes part 2 (Opistognathidae to Molidae), sea turtles and marine mammals. Roma, Italia: FAO. pp. 1375-2127
Oksanen, J.; Blanchet, F. G.; Kindt, R.; Legendre, P.; Minchin, P. R.; O’Hara, R. B.; Simpson, G. L.; Solymos, P.; Stevens, M. H. y Wagner, H. (2013). Vegan: Community Ecology Package. R package version 2.0-6.
Palacios, J.; Barriga, E.; Salazar, C.; Rodríguez, A. y Romero, M. (2009). Aspectos de la biología de Coryphaenoides delsolari (Chirichigno y Iwamoto, 1977) frente a la zona norte del Perú. Latin American Journal of Aquatic Research, 37(3), 455-462. Doi https://doi.org/10.3856/vol37-issue3-fulltext-14
Páramo, J.; Wolff, M. y Saint-Paul, U. (2012). Deep-sea fish assemblages in the Colombian Caribbean Sea. Fisheries Research, 125-126, 87-98. Doi https://doi.org/10.1016/j.fishres.2012.02.011
Patrick, W.; Spencer, P.; Link, J.; Cope, J.; Field, J.; Kobayashi, D.; Lawson, P.; Gedamke, T.; Cortés, E.; Ormseth, O.; Bigelow, K. y Overholtz, W. (2010). Using roductivity and susceptibility indices to assess the vulnerability of United States fish stocks to overfishing. Fishery Bulletin, 108(3), 305-322.
Pauly, D.; Christensen, V. y Walters, C. (2000). Ecopath, Ecosim, and Ecospace as tools for evaluating ecosystem impact of fisheries - ICES. Journal of Marine Science, 57, 697-706. Doi https://doi.org/10.1006/jmsc.2000.0726
Powell, S. M.; Haedrich, R. L. y Mc Eachran, J. D. (2003). The deep-sea demersal fish fauna of the Northern Gulf of México. Journal of Northwest Atlantic Fishery Science, 31, 9-33. Doi https://doi.org/10.2960/J.v31.a2
Ramírez, L. E. y Billett, D. S. M. (2006). Ecosistemas de las profundidades marinas: Reservorio privilegiado de la biodiversidad y desafíos tecnológicos. En Duarte, C. M. (Ed.), La exploración de la diversidad marina. Desafíos científicos y tecnológicos. Fundación BBVA. 1-93, España.
Smith, K. F. y Brown, J. H. (2002). Patterns or diversity, depth range and body size among pelagic fishes along a gradient to depth. Global Ecology y Biogeography, 11, 313-322. Doi https://doi.org/10.1046/j.1466-822X.2002.00286.x
Stange, K. (2016). Building a knowledge base for management of a new fishery: Boarfish (Capros asper) in the Northeast Atlantic. Fisheries Research, 174, 94-102. Doi https://doi.org/10.1016/j.fishres.2015.08.023
Sutton, T. T. y Hopkins, T. L. (1996). Species composition, abundance, and vertical distribution of the Stomiid (Pisces: Stomiiformes) fish assemblage of the Gulf of Mexico. Bulletin of Marine Sciece, 59(3), 530-542.
Tamdrari, H.; Brethes, J. C. y Archambault, D. (2015). Spatio-temporal variations in demersal fish assemblages and diversity in the northern Gulf of St. Lawrence (Canada). Marine Ecology, 36, 557-571. Doi https://doi.org/10.1111/maec.12163
Venables, W. N. y Ripley, B. D. (2002). Modern Applied Statistics with S. Cuarta edición. Nueva York, Estados Unidos: Springer. Doi https://doi.org/10.1007/978-0-387-21706-2
Wehrtmann, I. S. y Nielsen, M. V. (2009). The deepwater fishery along the Pacific coast of Costa Rica, Central America. Latin American Journal of Aquatic Research, 37(3), 543-554. Doi https://doi.org/10.3856/vol37-issue3-fulltex-18
Wehrtmann, I. S.; Arana, P. M.; Barriga, E.; Gracia, A. y Pezzuto, P. R. (2012). Deep-water shrimp fisheries in Latin America: a review. Latin American Journal of Aquatic Research, 40(3): 497-535. Doi https://doi.org/10.3856/vol40-issue3-fulltext-2
Ye, Y.; Cochrane, K. y Qiu, Y. (2011). Using ecological indicators in the context of an ecosystem approach to fisheries for data-limited fisheries. Fisheries research, 112(3), 108-116. Doi https://doi.org/10.1016/j.fishres.2011.06.004
Abundancia, biomasa y estructura de la ictiofauna demersal del mar Caribe de América Central. (Rosario Benavides- Morera y otros) por Revista Uniciencia se encuentra bajo una Licencia CreativeCommons Atribución-NoComercial-SinDerivadas 3.0 Unported.
