UNICIENCIA Vol. 30, No. 2, pp. 75-85. Julio-diciembre, 2016.
URL: www.revistas.una.ac.cr/uniciencia
Email: revistauniciencia@una.cr
ISSN Electrónico: 2215-3470
DOI: http://dx.doi.org/10.15359/ru.30-2.6
Resistencia al glifosato en biotipos de zacate cabezón (Paspalum paniculatum L.) de la Región del Caribe de Costa Rica
Glyphosate Resistance in Weed Biotypes (Paspalum paniculatum L.) in the Costa Rican Caribbean Region
Fernando Ramírez-Muñoz
Instituto Regional de Estudios en Sustancias Tóxicas
Universidad Nacional
Heredia, Costa Rica
Recibido-Received: 2/feb/2015/ Aceptado-Accepted: 26/jun/2015/ Publicado-Published: 31/jul/2016.
Resumen
Durante los años 2012 y 2013 se estudió, en un invernadero en Tambor de Alajuela, la respuesta de biotipos de Paspalum paniculatum, una maleza poacea, al herbicida glifosato, con el objetivo de determinar su nivel de resistencia. Los biotipos de zacate cabezón provenían de fincas productoras de palmito de pejibaye, banano orgánico y banano convencional de la provincia de Limón, y de bordes de caminos de Guanacaste y Heredia. A las plantas se les aplicaron dosis crecientes de glifosato y se midió su peso fresco 21 días después. Se encontraron tres biotipos resistentes a glifosato (R), que necesitan de 2,0 a 8,3 veces más herbicida para sufrir una reducción del 50% en su crecimiento con respecto a biotipos susceptibles (S), en fincas de producción convencional de pejibaye y banano con más de 12 años de aplicar glifosato como único método de control de malezas. Los biotipos S provenían de una finca de banano orgánico y de bordes de caminos, donde el uso de glifosato fue nulo o mínimo.
Palabras claves: Glifosato; malezas; resistencia; poáceas.
Abstract
In order to determine the level of resistance , the growth response to increasing doses of glyphosate herbicide in biotypes of Paspalum paniculatum (Poaceae) weed was studied in a Tambor de Alajuela greenhouse during the years 2012 and 2013. The Paspalum biotypes plants came from hearts of palm (pejibaye), conventional and organic banana farms at the Province of Limon, and from roadsides in Heredia and Guanacaste Provinces of Costa Rica. Plants were sprayed with increasing doses of glyphosate, harvested and their fresh weight was measured 21 days after treatment. In farms of conventional production of pejibaye and banana with over 12 years of applying glyphosate as a unique method of weed control, we found three (R) glyphosate-resistant biotypes, they need from 2.0 to 8.3 times more herbicide to suffer a reduction of 50% growth with respect to susceptible biotypes (S). S biotypes came from an organic banana farm and the roadsides, where the use of glyphosate was null or minimum.
Keywords: Glyphosate; weeds; resistance; Poaceae.
El glifosato (N-(fosfonometil) glicina) es un herbicida de aplicación foliar postemergente ampliamente usado para el control de plantas herbáceas y leñosas, tanto anuales como perennes, de hoja angosta y ancha. Es el herbicida no selectivo de mayor uso en el mundo y en Costa Rica; actualmente, es el segundo plaguicida de mayor importación en el país, representando del año 2006 al 2010 el 10,5% del total de plaguicidas y el 33,6% del total de herbicidas (Ramírez et al., 2009; Walkelin et al., 2004) .
Se utiliza en aplicaciones totales antes de la siembra de cultivos anuales o perennes y en aplicaciones dirigidas en cultivos perennes, como madurador en caña de azúcar, en zonas urbanas, no agrícolas y en cultivos transgénicos resistentes. Se empezó a comercializar a nivel mundial en 1974 por la compañía Monsanto con la marca Round up (Woodburn, 2000); en Costa Rica se tienen registros de importaciones desde el año 1982 con cerca de 50 toneladas i.a. con un aumento especialmente alto a partir de los años 90, para llegar a 1.761 ton i.a. en 2013 (SFE, 2014b). Actualmente, debido a la expiración de la patente de Monsanto en el año 2000 (Duke y Powels, 2008), existen en el mercado una gran variedad de formulaciones comerciales de glifosato, en concentraciones desde 20,4% a 76% de i.a., principalmente al 35,6 y 68% y formulado en líquidos solubles (SL) y gránulos dispersables (WG) respectivamente (SFE, 2014a).
El glifosato posee muchos atributos positivos como herbicida, incluyendo su efectividad en un amplio número de especies y baja toxicidad aguda para mamíferos, lo que ha contribuido a considerarlo clave en el manejo de malezas en la agricultura moderna (Jasieniuk et al., 2008), a pesar de que recientemente la Agencia Internacional para la Investigación en Cáncer (IARC por sus siglas en inglés) lo reclasificara como posible carcinogénico para seres humanos (IARC, 2015). Esa característica de alta eficacia en el control de especies muy susceptibles, precisamente, es un factor que aumenta la presión de selección de resistencia (Vega de la, 2013).
Es importante considerar que el uso repetido de un herbicida en una misma área expone la población de malezas a una presión de selección que conduce al aumento del número de individuos resistentes, generando un biotipo o población de plantas que se ha seleccionado y posee características genéticas únicas (Nandula, 2010). Es así como poblaciones que se controlaban con una dosis normal de glifosato, sobreviven y se reproducen ante la aplicación de esa dosis letal y evolucionan en resistentes. Desde que se informó el primer caso en Australia en 1996, a nivel mundial se han reportado 31 especies de malezas con resistencia comprobada al glifosato, 16 dicotiledóneas y 15 monocotiledóneas (Heap, 2015). Paspalum paniculatum aún no está incluida en la lista anterior.
En Costa Rica, Valverde (2010), a partir de reportes de problemas de control de Eleusine indica y P. paniculatum, ambas de la familia Poaceae, en una finca productora de pejibaye para palmito de la zona del Caribe, determinó, mediante experimentos de invernadero, que biotipos de ambas especies eran moderadamente resistentes a glifosato; pero lo suficiente para provocar fallos a nivel de campo en el control de estas especies, utilizando la dosis comercial del herbicida.
P. paniculatum es una planta monocotiledónea, perenne, cespitosa, que se reproduce principalmente por semilla. En Costa Rica se conoce popularmente como zacate cabezón y crece en elevaciones de 0 a 1500 metros sobre el nivel del mar. Es un pasto originario de los trópicos de América del Sur, actualmente se encuentra distribuido del sur de México hasta Argentina, incluyendo las islas del Caribe y ha sido introducido en Estados Unidos, Japón, islas del Pacífico y en todos los trópicos mundiales (PIER, 2014). Crece desde áreas estacionalmente secas a regiones muy húmedas, en suelos arcillosos de buena fertilidad y especialmente en áreas perturbadas, cultivos perennes, potreros, jardines, terrenos baldíos, bordes de caminos y zonas urbanas (Gargiullo et al., 2008). Es muy común encontrarlo en cultivos perennes como café, palmito, cítricos, banano, plátano, guanábana, papaya, palma africana, y en otros anuales de ciclo largo como yuca, tiquizque, ñame y jengibre. Brenes y Agüero (2007) la reportan como una maleza común en plantaciones de piña. Es precisamente en cultivos perennes donde se utiliza con mayor frecuencia el glifosato.
A pesar del dominio global del glifosato como herbicida, el primer caso de resistencia no fue documentado sino hasta más de veinte años después del inicio de su comercialización, en una población de Lolium rigidum en Australia (Pratley et al., 1996), expuesta durante 15 años a dos o tres aplicaciones de glifosato al año (Powles et al., 1998). Para la misma especie, más recientemente se reportan, en Sudáfrica, poblaciones con resistencia después de 17 años de uso de glifosato como método primario de control de zacates (Kaundun et al., 2011); aunque Neve et al. (2003) documentan resistencia en la misma especie, después de 15 aplicaciones del herbicida, lo que pudo haber ocurrido solamente después de 3 a 4 años de uso, dependiendo del cultivo y del manejo de malezas.
Actualmente, el número de casos y especies resistentes a glifosato ha aumentado hasta conformar un amplio grupo de 230 biotipos pertenecientes a 31 especies de malezas en 24 países en todos los continentes (Heap, 2015). La aparición de poblaciones de malezas resistentes a glifosato tiene el rasgo común de darse luego de varios años de usar el herbicida con varias aplicaciones por año y como único método de control de malezas, especialmente en cultivos perennes y transgénicos.
En algunas especies como Lolium multiflorum se reporta la aparición de biotipos resistentes en cultivos perennes después de varios años de uso. En Chile, Pérez y Kogan (2003) reportan resistencia en frutales luego de 8 a 10 años de uso; Pérez-Jones et al. (2007), luego de 15 años de uso en avellanas con 2 a 3 aplicaciones por año y dosis entre 1,44 a 1,68 kg ea/ha y, Jasieniuk et al., (2008), luego de 14 años de uso en almendras.
Para otra poácea, E. indica, en Malasia se reporta resistencia en cultivo de guayaba, luego de tres años de aplicaciones intensivas (6 a 7 veces por año) y con dosis crecientes (Lee y Ngim, 2000) . Otros autores en el mismo país (Ng et al., 2003) indican aparición de resistencia después de 5 a 15 años de aplicaciones repetidas. Kaundun et al. (2008) reportan en Filipinas, en zonas no agrícolas, biotipos resistentes a glifosato después de 5 años de ser aplicado 4 veces al año.
También la poacea perenne Digitaria insularis en el sureste de Brasil se reporta resistente a glifosato, luego de 15 años de uso en campos de cero labranza y de cultivos perennes (de Carvalho et al., 2012).
En la región de Andalucía, España, se encontraron biotipos de Conyza bonariensis (Asteraceae) resistentes a glifosato en plantaciones de olivo, donde se habían hecho aplicaciones repetidas de glifosato, al menos una vez por año, por un periodo de 4 a 6 años, a pesar de que en los 5 años anteriores al muestreo se habían usado otros herbicidas como oxyfluorfen, amitrol, diuron y MCPA (Dinelli et al. 2008). También en Colombia, en cultivos perennes, se reportan poblaciones de otra asterácea, Parthenium hysterophorus, que soportan hasta 10 l/ha de formulación comercial al 35,6%, luego de 20 años de aplicaciones repetidas y uso reducido de labranza (Gómez, 2009).
De igual forma existen reportes de resistencia a glifosato en cultivos anuales. En 2006 se identificó en Argentina a Sorghum halepense (Poaceae) luego de 6 años de siembras constantes de soya transgénica resistente a glifosato y un uso anterior no constante por 6 años (Valverde y Gressel 2006); y en 2008 a Lolium perenne en trigo, manejado con el sistema de siembra directa durante trece años, con un promedio de tres aplicaciones anuales de glifosato en dosis de 480 a 960 g equivalente a ácido (e.a.) ha-1 (Yanniccari et al., 2009).
La aparición de casos de resistencia es una indicación de un exceso de dependencia de los herbicidas dentro de un sistema particular de producción. La acción del herbicida elimina los individuos susceptibles y permite que los resistentes sobrevivan y se reproduzcan, lo cual aumenta la presencia de estos últimos en los campos. Este trabajo pretende evaluar si biotipos de zacate cabezón (Paspalum paniculatum) de fincas productoras de palmito y banano de la región Caribe de Costa Rica son resistentes al glifosato.
Materiales y métodos
Para determinar la respuesta de biotipos de P. paniculatum al herbicida glifosato, se realizaron bioanálisis de invernadero con plantas enteras, cultivadas a partir de semillas colectadas en fincas comerciales dedicadas a la producción de cultivos perennes, particularmente de palmito (Bactris gasipaes Kunt) y banano (Musa paradisiaca L.), donde han tenido problemas de control de esta maleza y se sospecha resistencia a glifosato (biotipos R). Estas fincas se ubican en la Región Huetar Atlántica de Costa Rica, en el cantón de Pococí, provincia de Limón; los biotipos evaluados se nombraron como B, D y L. La semilla de las plantas presuntamente susceptibles (biotipos S) se recolectó de lugares donde la población ha sido poco o nada expuesta al glifosato: una finca dedicada al cultivo de banano orgánico en la comunidad de Shiroles (biotipo H), cantón Talamanca, Limón, en la Reserva Indígena Bribri, que nunca ha estado expuesta al herbicida; el Campus Omar Dengo de la Universidad Nacional en Heredia (biotipo C), y un borde de camino en San Juan de Santa Cruz, Guanacaste (biotipo T). En estos últimos dos lugares el glifosato se ha aplicado no más de una vez al año, en años no consecutivos, y se ha alternado con controles mecánicos y manuales.
Las semillas se recolectaron manualmente de plantas con inflorescencias maduras en proceso de desprendimiento de las semillas, que resistieron la aplicación comercial de glifosato; se colocaron en bolsas de papel y se llevaron al laboratorio para su secado y limpieza. Posteriormente, las semillas limpias se colocaron en platos petri con papel de filtro de grado para germinación (Advantec N.° 131, Tokio RoshiKaisha, Japón), humedecido con una solución de nitrato de potasio (0,2% p/v) en una cámara de germinación bajo luz fluorescente continua a ٣٠º C. Las semillas germinadas se trasplantaron en bandejas con una mezcla de sustrato de crecimiento y suelo (50/50) y, posteriormente, a macetas para ser tratadas con los herbicidas.
Las macetas, con un volumen de 100 dm3, se llenaron con una mezcla comercial de medio de crecimiento (peatmost) y suelo suplementado con 2 g de fertilizante químico granulado (10-30-10). En cada maceta se trasplantó una plántula de P. paniculatum que creció en un invernadero protegido por malla antiáfidos, techo plástico transparente, riego aplicado dos veces al día, luz natural cerca de 12 horas diarias y temperatura diaria promedio de 30º C.
Para determinar la respuesta de los biotipos a dosis crecientes de glifosato, se trataron independientemente plantas en dos estados de crecimiento: edad I (plantas de hasta 4 hojas y sin hijos) y edad II (plantas de 1 a 3 hijos). Las plantas se asperjaron una sola vez con una dilución de una formulación comercial de glifosato que contiene 360 g de e.a. de glifosato por litro, con un equipo portátil accionado por CO2 calibrado para descargar 200 L ha-1 a través de una boquilla de abanico plano 8002 (SprayerSystems) a una altura de 50 cm. Una vez que el follaje tratado se secó, las macetas se transfirieron de nuevo al invernadero. Cada experimento consistió de ocho dosis y dos testigos sin tratar, para un total de 10 plantas por repetición (tabla 1), dispuestas en un diseño experimental de bloques completos al azar con 5 repeticiones; cada experimento se repitió al menos una vez.

Las plantas se cosecharon 21 días después de la aplicación (dda); se cortaron a 0,5 cm del suelo y se determinó su peso fresco para obtener el valor de la dosis efectiva media (DE50), que corresponde a la dosis de herbicida que reduce el crecimiento de la planta a la mitad del logrado por las plantas testigo. Este se calculó con base en la curva de respuesta a dosis, usando el paquete estadístico R (R CoreTeam, 2013), modelo logístico descrito por Seefeldt et al. (1995). Este modelo usa la siguiente ecuación para expresar la biomasa como porcentaje de control y de la dosis x del herbicida:

Donde U ij denota la respuesta a la dosis j del herbicida i; D representa la asintótica superior del crecimiento de las plantas a la concentración cero (testigo), y Ci es el límite inferior del herbicida i para reducir el crecimiento de la planta a la mitad del valor entre D y C, y b i es la pendiente de la curva cerca de la DE50 (i). Los valores están expresados en litros de producto comercial (l p.c.) formulado al 35,6% de glifosato y en gramos e.a. de glifosato, con su correspondiente error estándar.
El índice de resistencia (IR) se calculó dividiendo la DE50 del biotipo R entre la del biotipo S. Una población en estudio se puede considerar resistente de dos formas cuantificables: cuando el valor del IR es mayor de 2, y a nivel de campo, cuando las plantas no son controladas con la dosis comercial del herbicida (Heap 2015).
Resultados y discusión
El manejo de malezas en monocultivos perennes convencionales intensivos, como el palmito y banano, tiene la característica de contar con aplicaciones repetidas de herbicidas, poca labranza del suelo, carencia de rotación de cultivos, métodos de control de malezas y de herbicidas. La combinación de un uso intensivo de herbicidas con el mismo modo de acción y un limitado uso de tácticas culturales de manejo de malezas resultan en una intensa presión para seleccionar malezas resistentes (Dinelli et al., 2008) y, generalmente, es característica propia del manejo de los sistemas agrícolas donde malezas han evolucionado resistencia (Mortensen et al., 2000).
Esta condición se da en las fincas que reportan problemas de control de P. paniculatum en la región Caribe costarricense. El itinerario común de control de malezas en estas fincas de palmito se basa en la utilización de un herbicida sistémico (glifosato) y eventualmente de un herbicida que controla hojas anchas (2,4-D o metsulfuron metilo), con aplicaciones de glifosato que van de 5 a 7 veces por año, hechas durante 12 a 15 años. Los problemas de control se evidenciaron desde el año 2010 (Valverde 2010) y, a partir del año siguiente, se inició con la aplicación de otros herbicidas graminicidas (haloxifop metilo) y de otras formas de control de malezas (corta manual), pero siempre después de las aplicaciones de glifosato.
En la finca bananera donde se detectó el problema, en el año 2013, el control de malezas se realiza únicamente con el herbicida glifosato, en dosis comerciales (2,5 a 3 litros p.c./ha al 35,6%) y con 7 a 8 ciclos de aplicación anual. Este itinerario se ha repetido en los últimos 12 años antes de detectarse los problemas de control de malezas y en la misma finca, el glifosato tiene una historia de uso de más de 20 años. De forma similar a las fincas de palmito, se ha implementado la corta manual de malezas sobrevivientes, después de las aplicaciones de glifosato.
Si bien el glifosato ha sido muy utilizado en estos cultivos debido a su alta efectividad, este tipo de herbicidas, usados en forma persistente, impone una alta presión de selección de resistencia a las poblaciones de malezas. Aunque el glifosato carece de persistencia, el agricultor lo vuelve en la práctica persistente o residual, al aplicarlo frecuentemente en los campos. Su uso repetido como único o principal método de control de malezas por varios ciclos de producción, la ausencia de rotación de cultivos y de mezclas de herbicidas, los sistemas de mínima o cero labranza, sumado a esto características de la maleza como tipo de polinización, capacidad de movimiento del polen, alta producción de semillas, baja latencia y variabilidad genética, contribuyen a aumentar la presión de selección de resistencia (Powles y Preston, 2006; Powles y Yu, 2010; Preston et al., 2009; Vega de la, 2013).
Respuesta de P. paniculatum a glifosato
En la tabla 2 se presentan los valores de DE50 de los biotipos evaluados para ambas edades en litros de p.c./ha y en gramos de e.a./ha de glifosato. Para los biotipos R, la DE50 promedio de la edad I es de 0,71 l p.c./ha, mientras que para los S es de 0,16. Lo anterior significa que es necesario 4,4 veces más herbicida en los biotipos R que en los biotipos S para causar una reducción del 50% en el peso fresco. Para plantas más desarrolladas (edad II), la DE50 promedio para biotipos S es 0,26, mientras que para los biotipos R es 0,92 l p.c./ha.
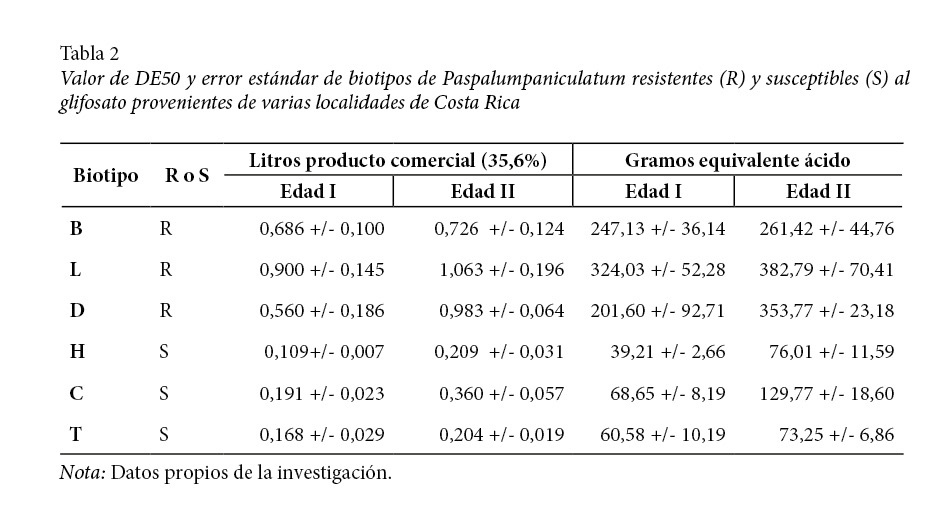
De las plantas, el biotipo H, el más susceptible de los evaluados, proviene de una plantación de banano orgánico, donde nunca se ha aplicado glifosato; los biotipos C y T, de bordes de caminos donde la presión de selección de resistencia ha sido muy baja, lo cual se manifiesta en sus menores valores de DE50.

En la figura anterior se nota la respuesta a dosis crecientes de glifosato en plantas de biotipos R (L) y S (H). A los 21 dda, una dosis de 0,25 l p.c./ha (p.c. con 35,6% glifosato) provoca la muerte de la planta del biotipo S; mientras, en el biotipo R, el mismo efecto se da a dosis de 6 l p.c./ha. La dosis comercial de aplicación de glifosato en las fincas con problemas es cercana a 2,5 l p.c./ha, insuficiente para controlar las plantas R, las cuales mantienen un crecimiento aceptable y la capacidad para desarrollarse y producir semilla viable a esa dosis. Al calcular la DE50, se tiene que para el biotipo R es de 0,90 l p.c./ha, mientras que para el biotipo S de 0,11 l p.c./ha, lo cual indica que en plantas de P. paniculatum de 0 a 3 hijos, se requiere cerca de 8 veces más herbicida en el biotipo R que en el S para causar una reducción del crecimiento del 50%. Los valores de DE50 son menores en plantas de edad I que en plantas de mayor edad, lo que indica que en estas últimas se necesita mayor cantidad de glifosato para lograr un daño similar que en plantas con menor desarrollo.

En la tabla 3 se observan los IR entre biotipos R y S para la edad I y II. Cuando se compara el biotipo más resistente con el más susceptible, el índice es mayor a 8 para la edad I y mayor a 5 para la edad II. De acuerdo con los parámetros planteados por Heap (2015) sobre poblaciones resistentes, los biotipos L, D y B, tanto para la edad I como para la edad II, al presentar un IR <10, poseen una resistencia al glifosato de orden moderada, con IR de 2,0 a 8,6. En otras malezas poáceas, dependiendo de su mecanismo de resistencia, se han encontrado diversos valores de IR: en L. rigidum de 3 a 12 (Preston y Wakelin, 2008) y de 14 a 20 (Preston et al. 2009); en L. multiflorum de 5 a 15 (Jasienuk et al. 2008); en S. halepense de 5 a 7 (Riar et al, 2011) y en E. colona de 4 a 9 (Alarcón-Reverte et al, 2014).
A nivel mundial y recientemente en Costa Rica, la aparición de poblaciones de malezas resistentes a glifosato en explotaciones agrícolas nos sugiere la necesidad de diversificar en los métodos de manejo y control de malezas, y usar prácticas adicionales para el control de malezas resistentes a este herbicida. La dependencia en el método de control químico de malezas, y aún más, con un solo herbicida, es una práctica peligrosa que puede poner en riesgo la sostenibilidad de grandes áreas de cultivos intensivos. Costa Rica cuenta con cerca de 42.000 ha de banano y 7.000 ha de palmito (SEPSA 2014), manejadas de forma similar, con una presión de selección de resistencia alta, además de otros cultivos como plátano, cítricos, palma africana, yuca, entre otros, que hacen uso de glifosato como método principal de manejo de malezas.
Si los agricultores deben confiar en los herbicidas para controlar sus malezas, un enfoque útil para demorar o prevenir la resistencia a los herbicidas es el uso de sus mezclas, de sinergistas o la rotación de sus ingredientes activos, especialmente si son de familias químicas que poseen diferentes mecanismos de acción. La resistencia dificulta el manejo adecuado de las malezas; además de incrementar los costos de producción, aumenta la carga ambiental por herbicidas, cuando el deficiente control de la maleza resistente obliga a usar dosis más altas o a repetir la aplicación (Espinoza et al. 2009).
Algunos autores como Mortensen et al. (2000) y Fisher (2013) han indicado que se debería ir más allá de la noción de considerar las malezas como un problema que puede ser solucionado solamente con herbicidas y comprender que pueden ser manejadas con un mejor diseño de los sistemas de producción; ahora es necesario volver a las buenas prácticas agrícolas y de manejo integrado de malezas para reducir la presión evolutiva de selección que favorece a los biotipos de maleza resistentes a herbicidas.
Se hace necesario informar y convencer a los productores, para que introduzcan modificaciones en los actuales sistemas de producción, como control cultural, preventivo, mecánico y físico de malezas, coberturas vivas, aumentar la densidad de siembra, cultivares más competitivos, uso de mezclas y alternancia de herbicidas distintos, y en fin, aplicar la diversidad en las prácticas de manejo y control de malezas, con el objetivo de prevenir o retardar la aparición de malezas resistentes a herbicidas y de cómo afrontarlas una vez que aparezcan.
Bibliografía
Alarcón-Reverte, R., García, A., Watson, S., Abdallah, I., Sabaté, S., Hernández, M. J., Dayan, F. E. y Fischer, A. (2014). Concerted action of target-site mutations and hoghEPSPS activity in glyphosate-resistant junglkerice (Echinochloacolona) from California. Pest Management Science. Recuperado de https://www.researchgate.net/publication/264968558_Concerted_action_of_targetsite_mutations_and_high_EPSPS_activity_in_glyphosateresistant_junglerice_%28Echinochloa_colona%29_from_California
Brenes, S. y Agüero, R. (2007). Reconocimiento taxonómico de arvenses y descripción de su manejo, en cuatro fincas productoras de piña (Ananascomosus L.) en Costa Rica. Agronomía Mesoamericana, 18(2), 239-246.
Carvalho de, L. B., Da Costa Aguiar Alves P. L., González-Torralva, H. E. Cruz-Hipolito, A. M. Rojano-Delgado, R. de Prado J. Gil-Humanes, F., Barro, M. D., Luque de Castro. (2012). Pool of Resistance Mechanisms to Glyphosate in Digitariainsularis. Journal of Agric. and Food Chem, 60, 615-622.
Dinelli, G., Marotti, I., Bonetti, A., P. Catizone, Urbano, J., y Barnes, J. (2008). Physiological and molecular bases of glyphosate resistance in Conyzabonariensis biotypes from Spain. Weed Research, 48, 257-265.
Duke, S. y Powles, S. (2008). Glyphosate: A once-in-a-century herbicide. Pest Management Science 64, 319-325.
Espinoza, N., Díaz, J., Galdames, R., De Prado, R., Rodríguez, C. y Ruiz, E. (2009). Estrategias de manejo de malezas gramíneas resistentes a herbicidas en trigo y otros cultivos extensivos en el sur de Chile. In N. Espinoza (ed.), Seminario Internacional “Diagnóstico y Manejo de la Resistencia a Herbicidas”. Instituto Nacional de Investigación Agropecuaria, Serie de Actas de INIA Nº ٤٤, Chile, pp. 92-105.
Fisher, A. J. (2013). Resistencia a herbicidas: Mecanismos y mitigación. Revista Especial de Malezas 29, 13-19.
Gargiullo, M., Magnuson, B., y Kimball, L. (2008). A Field Guide to Plants of Costa Rica. Zona Tropical publication. Oxford University Press. China.
Gómez, C. (2009). Mecanismos de resistencia de Partheniumhysterophorus L. a glifosato, Valle del Cauca, Colombia (Tesis de doctorado), Universidad Nacional de Colombia, Bogotá.
Heap, I. (2015). Glycines Resistant Weeds.International Survey of Resistant Weeds.Consultado el 12 de enero 2015, Recuperado de http://www.weedscience.org/Summary/UspeciesMOA.asp?lstMOAID=12
International Agency for Research in Cancer. (IARC). (2015). Evaluation of five organophosphate insecticides and herbicides. IARC Monographs Vol. 112. Lyon, France, 20 March 2015.
Jasieniuk, M., Ahmad, R., Sherwood, A., Firestone, J., Perez-Jones, A., Lanini, T., Mallory-Smith, C. y Stednick, Z. (2008). Glyphosate-Resistant Italian Ryegrass (Loliummultiflorum) in California: Distribution, Response to Glyphosate, and Molecular Evidence for an Altered Target Enzyme. Weed Science, 56, 496-502.
Kaundun, S. S., Dale, R. P., Zelaya, I. A., Dinelli, G., Marotti, I., McIndoe, E. y Cairns. A. (2011). A Novel P106L Mutation in EPSPS and an Unknown Mechanism(s) Act Additively To Confer Resistance to Glyphosate in a South African Loliumrigidum Population. Journal of Agricultural and Food Chemistry 59, 3227-3233.
Kaundun, S. S., Zelaya, I. A., Dale, R. P., Lycett, A. J., Carter, P., Sharpies K. R. y McIndoe, E. (2008). Importance of the P106S target-site mutation in conferring resistance to glyphosate in a goosegrass (Eleusineindica) population from the Philippines. Weed Science, 56, 637-646.
Lee, L. J y Ngim, J. (2000). A first report of glyphosate-resistant goosegrass (Eleusineindica (L) Gaertn) in Malaysia. Pest ManagSc, 56, 336-339.
Mortensen, D. A., Bastiaans, L. y Sattin, M. (2000).The role of ecology in the development of weed management systems: An outlook. Weed Research, 40, 49-62.
Nandula, V. K. (2010). Herbicide resistance: Definitions and concepts. In V. K. Nandula (Ed.), Glyphosate Resistance in Crops and Weeds: History, Development, and Management (pp 35-43). Hoboken, New Jersey: John Wiley and Sons.
Neve, P., Diggle, A. J., Smith, F. P., y Powles, S. B. (2003). Simulating evolution of glyphosate resistance in Loliumrigidum. I. Population biology of a rare resistance trait. Weed Research, 43, 404-417.
Ng, C. H., Wickneswari, R., Salmijah, S., Teng, Y. T. y Ismail, B. S. (2003). Gene polymorphisms in glyphosate-resistant and –susceptible biotypes of Eleusineindica from Malaysia. Weed Research, 43, 108–115.
Pacific Island Ecosystems at Risk (PIER). (2014). Paspalumpaniculatum. Consultado el 02 de mayo 2014. En: http://www.hear.org/pier/species/paspalum_paniculatum.htm
Perez, A. y Kogan, M. (2003). Glyphosate-resistant Loliummultiflorum in Chilean orchards. Weed Research Oxford, 43(1), 12-19.
Perez-Jones, A.; Park, K., Polge, N.; Colquhoun, J.; Mallory-Smith, C. (2007). Investigating the Mechanisms of Glyphosate Resistance in Loliummultiflorum. Planta, 226, 395-404.
Powles, S. B., Lorraine-Colwill, D. F., Dellow, J. J. y Preston, C. (1998). Evolved resistance to glyphosate in rigid ryegrass (Loliumrigidum) in Australia. Weed Science, 46, 604-607.
Powles, S. B. y Preston, C. (2006). Evolved glyphosate resistance in plants: Biochemical and genetic basis of resistance. Weed Technol, 20, 282–289.
Powles, S. B. y Yu, Q. (2010). Evolution in action: Plants resistant to herbicides. Annu Rev Plant Biol, 61, 317-347.
Pratley, J; Baines, P., Eberbach, P,.Incerti, M., y Broster, J. (1996). Glyphosate resistance in annual ryegrass, En J. Virgona y D. Michalk (Edit.), Proceedings of bthe (p. 126). 11th Annual Conference of the Grasslands Society of New South Wales, WaggaWagga, Australia.
Preston, C., Wakelin A. M., Dolman, F. C., Bostaman, Y. y Boutsalis, P. (2009). A decade of glyphosate-resistant Lolium around the worl: Mechanisms, genes, fitness and agronomic management. Weed Science, 57, 435-441.
Preston, C. y Wakelin, A. M. (2008). Resistance to glyphosate from altered herbicide trnslocation patterns. Pest Management Science, 64, 372-376.
R. Core Team (2013). R: A language and environment for statistical computing. R FoundationforStatistical Computing, Vienna, Austria. Consultado el 3 de junio 2013. Recuperado de http://www.R-project.org/.
Ramírez, F., Chaverri, F., de la Cruz, E., Wesseling, C., Castillo, L., Bravo, V. (2009). Importación de plaguicidas en Costa Rica. Periodo 1977–2006. En Serie Informes Técnicos N.° ٦ (p. 58). Instituto Regional de Estudios en Sustancias Tóxicas, Universidad Nacional de Costa Rica.
Riar, D., Norsworthy, J., Johnson D, Scott, R. y Bagavathiannan, M. (2011). Glyphosate Resistance in a Johnsongrass (Sorghum halepense) Biotype from Arkansas. Weed Science, 59, 299-304.
Seefeldt, S. S; Jensen, J. E. y Fuerst, E. P. (april-june, 1995). Log-Logistic analysis of herbicide dose response relationships. Weed Technology, 9(2), 218-227.
SEPSA. (2014). Boletín Estadístico Agropecuario N.º 24, serie Cronológica 2010-2013. Departamento de Comunicaciones Agrícolas Ministerio de Agricultura y Ganadería (MAG). San José, Costa Rica. Recuperado de http://www.infoagro.go.cr/BEA/BEA24.pdf
SFE. (2014a). Centro de Consulta de Insumos. Recuperado de https://www.sfe.go.cr/insumosys/Principal.htm Consultado el 01 de agosto 2014.
SFE. (2014b). Importación de plaguicidas en Costa Rica. Recuperado de https://www.sfe.go.cr/perfiles/importacion/importacion_agroquimicos_equipos.html
Valverde, B. y Gressel, J. (2006). Dealing with the evolution and spread of Sorghum halepense glyphosate resistance in Argentina. Consultoría para SENASA, Argentina. Recuperado de http://www.weedscience.org/paper/Johnsongrass%20Glyphosate%20Report.pdf
Valverde, B. E. (2010). Glyphosate Resistance in Latin America. In V. K. Nandula (Ed.) Glyphosate Resistance in Crops and Weeds, History (pp. 249-280). Development and Management. Hoboken, New Jersey: John Wiley and Sons.
Vega de la, M. (2013). Resistencia de malezas a herbicidas. Revista Especial de Malezas 29, 29-34. Universidad Nacional de Tucumán, Argentina.
Wakelin, A. M., Lorraine-Colwill, D. F. y Preston, C. (2004). Glyphosate resistance in four different populations of Loliumrigidumis associated with reducetraslocation of glyphosate to meristematic zones. Weed Res 44, 453-459.
Woodburn, A. (2000). Glyphosate production, pricing and use worldwide. Pest Manag Sci. 56, 309-312.
Yanniccari, M. E., Istilart, M. C. y Gimenez, D. O. (2009). Evaluación de la resistencia a glifosato de una población de Lolium perenne del sur de la provincia de Buenos Aires. En Universidad Técnica de Lisboa (Ed.), Herbología e Biodiversida de Numa Agricultura Sustentavel (Vol. 2, pp. 521-524). XII Congreso de Sociedad Española de Malherbología (SEMh), XIX Congreso de la Asociación Latinoamericana de Malezas (ALAM), II Congreso Ibérico de Ciencias de las Malezas (IBCM). Lisboa, Portugal.
Resistencia al glifosato en biotipos de zacate cabezón (Paspalumpaniculatum L.) de la Región del Caribe de Costa Rica
(Fernando Ramírez-Muñoz) por Revista Uniciencia se encuentra bajo una Licencia CreativeCommons Atribución-NoComercial-SinDerivadas 3.0 Unported.