
Rev. Ciencias Veterinarias, Vol. 40, N° 2, [1-12], E-ISSN: 2215-4507, julio-diciembre, 2022
DOI: https://doi.org/10.15359/rcv.40-2.2
URL: http://www.revistas.una.ac.cr/index.php/veterinaria/index
Hallazgos post-mortem y caracterización bacteriana de salmonelosis septicémica equina. Descripción de un caso.
Post mortem findings and bacterial characterization of equine salmonella septicemia. A case report.
Achados post-mortem e caracterização bacteriana da salmonelose septicêmica equina. Descrição de um caso.
Enid Segura1, Ernesto Rojas Sánchez2, Carla Murillo3, Patricio Razquín3, Lohendy Muñoz2, Elias Barquero-Calvo4, Alejandro Alfaro-Alarcón1
1 Universidad Nacional, Escuela de Medicina Veterinaria, Laboratorio de Patología, Lagunilla, Heredia, Costa Rica. p10segura@hotmail.com; alejandro.alfaro.alarcon@una.cr
2 Universidad Nacional, Escuela de Medicina Veterinaria, Laboratorio de Salud Pública y Alimentos, Lagunilla, Heredia, Costa Rica. ernesto.rojas.sanchez@est.una.ac.cr; lohendy.munoz.vargas@una.cr
3 Universidad Nacional, Escuela de Medicina Veterinaria, Hospital Equino, Lagunilla, Heredia, Costa Rica. murilloc@purdue.edu; patorazquin@gmail.com
4 Universidad Nacional, Escuela de Medicina Veterinaria, Programa de Investigación en Enfermedades Tropicales, Lagunilla, Heredia, Costa Rica. elias.barquero.calvo@una.cr
Autor de correspondencia: alejandro.alfaro.alarcon@una.cr
Recibido: 2 de febrero de 2022 Corregido: 9 mayo de 2022 Aceptado: 13 de mayo de 2022
Resumen
Se describe el primer caso, debidamente confirmado, de salmonelosis en un equino en Costa Rica; una potra iberoamericana de siete meses de edad con un cuadro de diarrea de unas cuatro semanas de transcurso y baja condición corporal. Se confirmó la presencia de Salmonella entérica, subespecie entérica, mediante el estudio bacteriológico de muestras de heces. En el estudio post-mortem, se observó una tiflocolitis ulcerativa y necrotizante extensiva severa.
Palabras clave: salmonella, caballos, histopatología, caracterización bacteriana
Abstract
The first duly confirmed case of equine salmonellosis in Costa Rica is described, a seven-month-old Ibero-American filly with a four-week-long case of diarrhea and poor body condition. The presence of Salmonella enterica subspecies enterica was confirmed through a bacteriological study of stool samples. In the post-mortem study, severe extensive ulcerative and necrotizing typhlocolitis was observed.
Keywords: salmonella, equine, histopathology, bacterial characterization
Resumo
Descreve-se o primeiro caso devidamente confirmado de salmonelose equina na Costa Rica; uma potra ibero-americana de sete meses de idade com quatro semanas de diarréia e baixa condição corporal. A presença de Salmonella enterica subespécie enterica foi confirmada por estudo bacteriológico de amostras de fezes. No estudo post-mortem, foi observada tiflocolite ulcerativa e necrosante extensa grave.
Palavras-chave: salmonela, equino, histopatologia, caracterização bacteriana
Introducción
Salmonella spp. es un bacilo Gram negativo de la familia Enterobacteriaceae, capaz de infectar una amplia variedad de hospederos. Este género comprende más de 2000 serotipos de importancia clínica, los cuales pueden causar la enfermedad conocida como salmonelosis en animales y humanos (Lahiri et al. 2010). La salmonelosis es una de las enfermedades zoonóticas de mayor relevancia a nivel mundial, con capacidad de afectar animales de todas las edades, principalmente a jóvenes e inmunosupresos (Kirk et al. 2015). En equinos, Salmonella puede causar cuadros clínicos de colitis o tiflocolitis, con signos clínicos que van desde hiporexia y letargia leve, hasta cuadros potencialmente fatales como: diarreas de grandes pérdidas de volumen, fiebre, alteraciones en la motilidad e integridad intestinal, azotemia pre-renal, hepatitis y acidosis metabólica (ESE; León et al., 2018; Martelli et al. 2018). Otros agentes etiológicos, que podrían ser causales de lesiones y sintomatología clínica similar a Salmonella, que se deben considerar en la lista de diagnósticos diferenciales son: Clostridium perfringens, Clostridium difficile, Corinebacterium equi, cuadros parasitarios, coronavirosis, Rhodococcus equi, e incluso agentes micóticos e intoxicación por sus toxinas, como la fumonisina b. (Arroyo et al., 2018; Burgess & Morley, 2014; Manship et al., 2019).
En la literatura hay pocos reportes de casos de salmonelosis equina debidamente confirmados, quizá debido a la ausencia de estudios bacteriológicos, histopatológicos; así como de diagnóstico molecular realizados de forma complementaria y oportuna al abordaje clínico de los casos (Duarte et al. 2017).
Reporte de caso
Una potra de seis meses de edad, raza Iberoamericana, severamente deshidratada debido a un cuadro clínico de diarrea acuosa no sanguinolenta de transcurso de cuatro semanas, fallece durante el período de estabilización en el Hospital Equino de la Escuela de Medicina Veterinaria, de la Universidad Nacional, Costa Rica. El cuerpo fue enviado al Laboratorio de Patología de la Universidad Nacional (UNA) donde se realizó el estudio post-mortem y respectivo análisis histopatológico. Adicionalmente, se enviaron muestras de heces y de tejido intestinal al Laboratorio de Bacteriología de la UNA para realizar análisis complementarios.
Abordaje inicial
Cuando ingreso al centro médico, la paciente se estabilizó y suministró bolos endovenosos de solución salina de 20ml/kg, cada 30 minutos, hasta recuperar el déficit, flunixin meglumina 1,1mg/kg, cada doce horas intravenoso; marbofloxacina 2mg/kg cada 24 horas, vía subcutánea, como plan de acción farmacológico (Bosquet-Melou et al., 2002; Knych et al., 2021; Magdesian, 2005; Waxman et al., 2014). En las evaluaciones hematológicas y química séricas, realizadas con el equipo biomédico del laboratorio del Hospital Equino (Vetscan HM5); se evidenció leucopenia, hiponatremia e hipocalemia. Además, valores de nitrógeno ureico y creatinina aumentados (cuadros 1 y 2) (Stokol., 2020). La paciente presentó un deterioro abrupto. Falleció a las pocas horas del abordaje inicial debido al mal estado en que ingresó al centro hospitalario.
Estudio post-mortem.
Hallazgos anatomo-histopatológicos
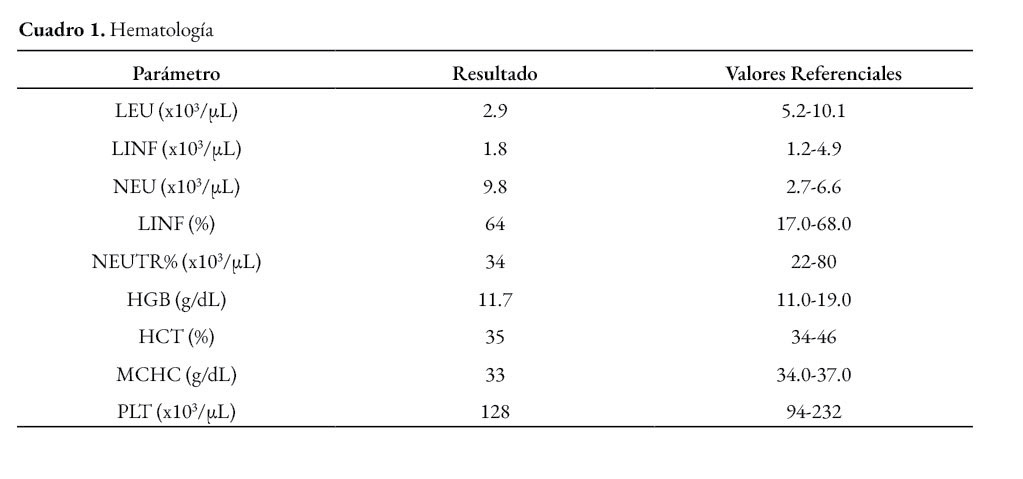
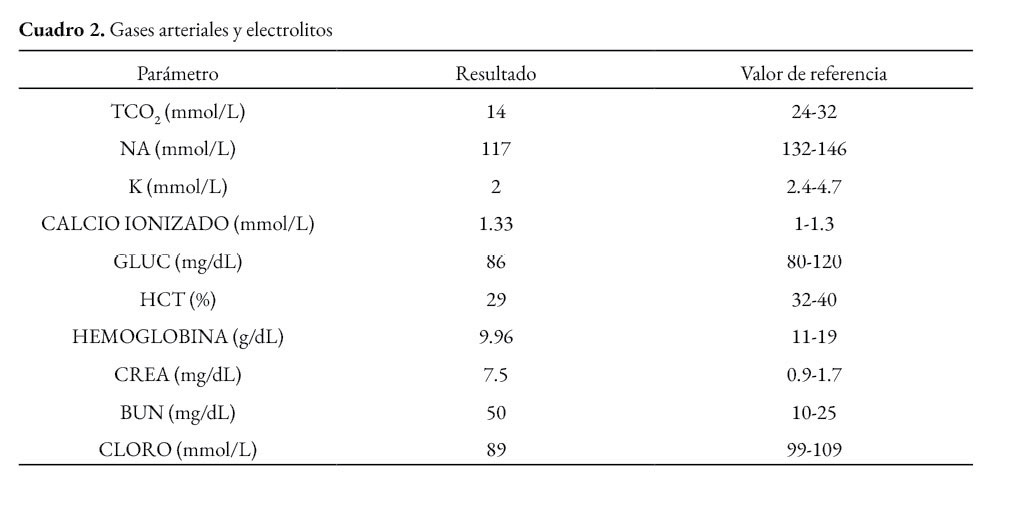
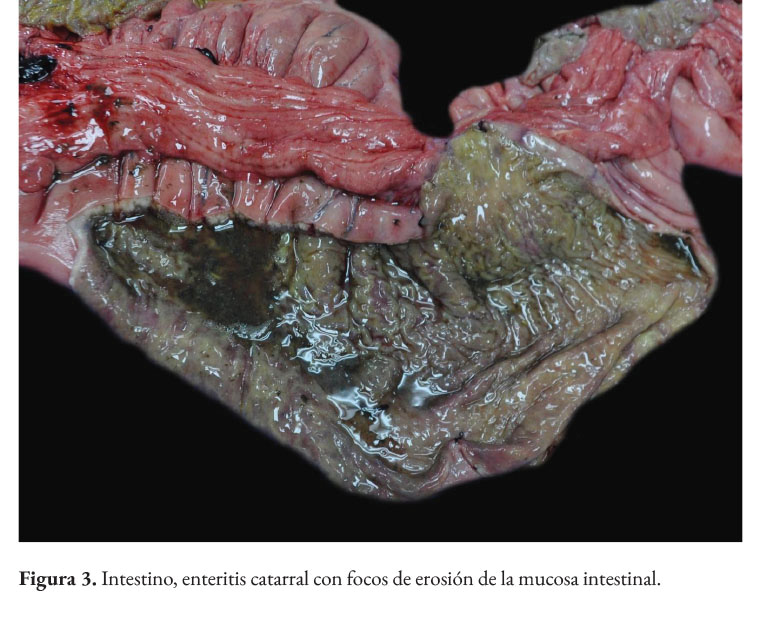
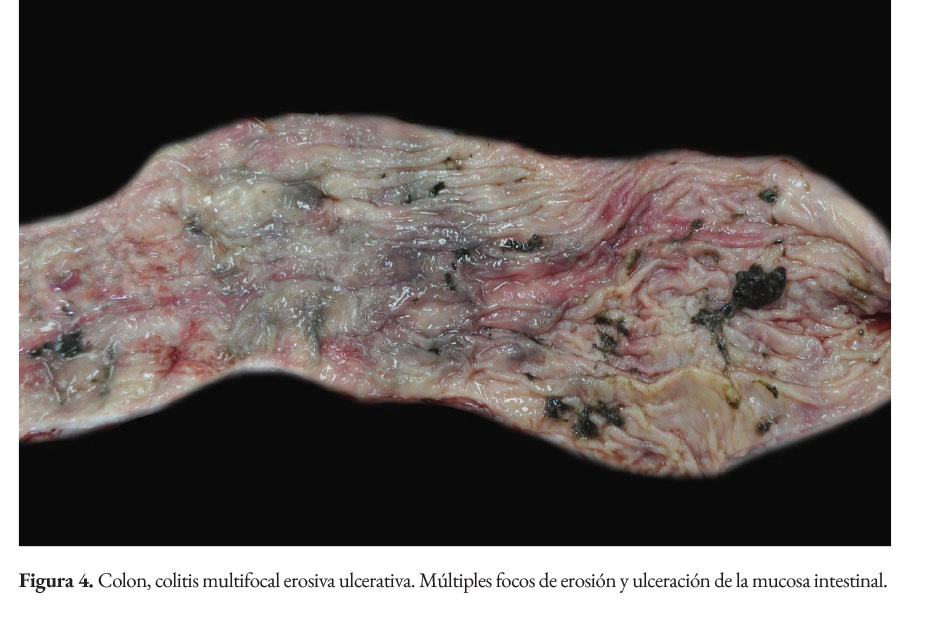
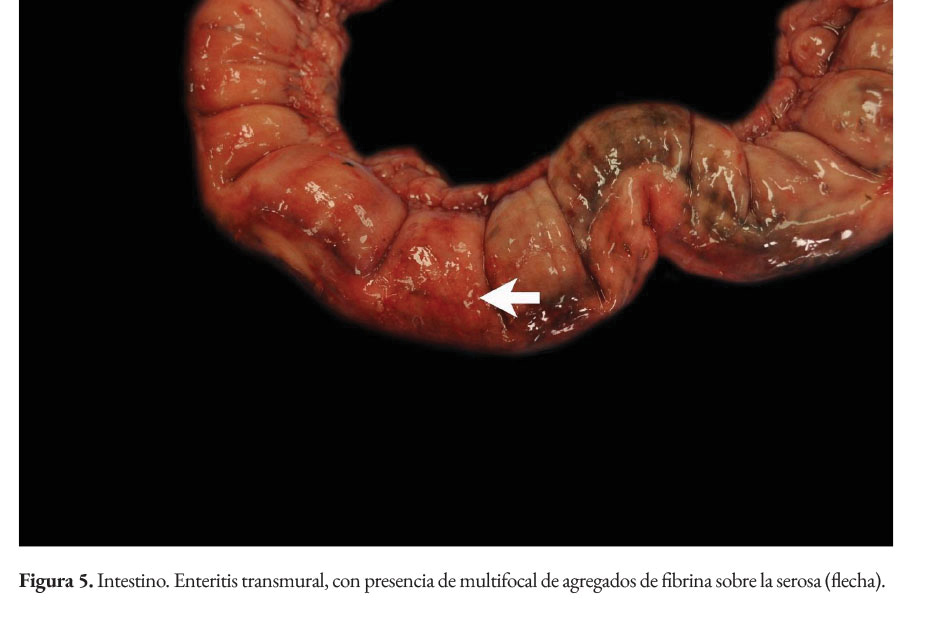
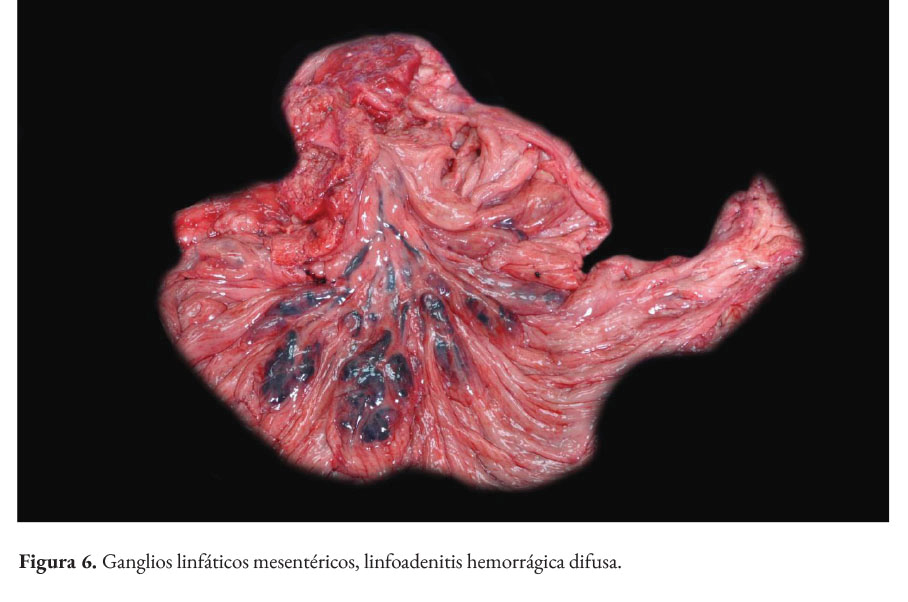
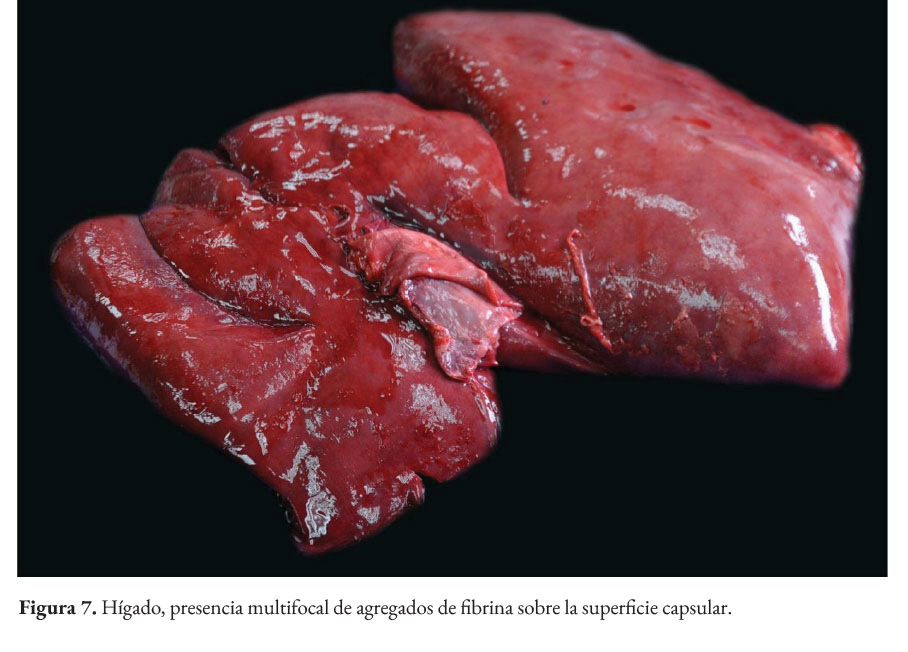
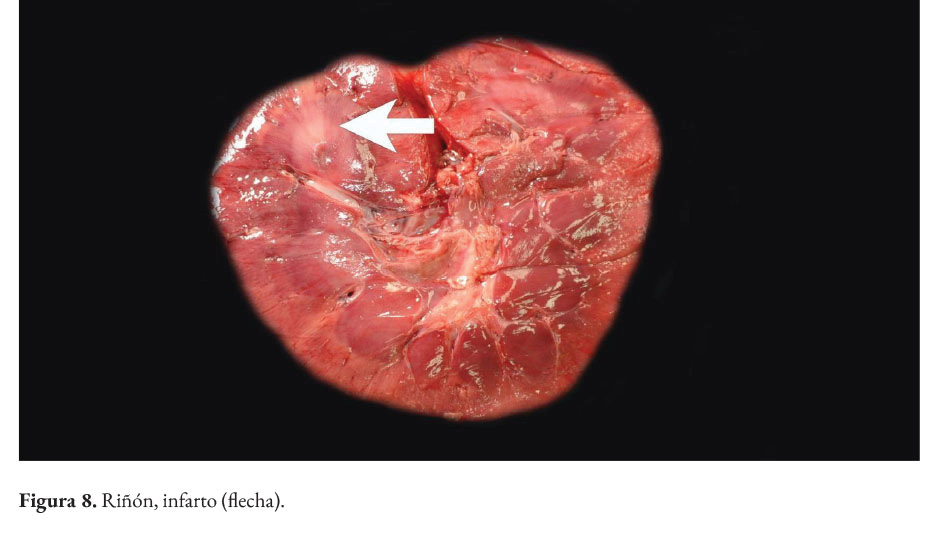
La paciente presentaba baja condición corporal e incremento de las articulaciones húmero radio cubital, con presencia intraarticular de material fibrinoso (artritis fibrinosa). En cavidad torácica había presencia de 290 ml de líquido serosanguinolento. Los pulmones presentaban edema extensivo y neumonía supurativa focal extensiva cráneo ventral (Figura 1). El corazón presentaba áreas blanquecinas irregulares, de aproximadamente 1x1 cm, en el miocardio ventricular izquierdo, derecho y septo interventricular (miocarditis necrotizante) (Figura 2). En la cavidad abdominal había 82 ml. de líquido serosanguinolento. El tracto intestinal presentaba engrosamiento de la submucosa con edema prominente y presencia de un contenido fecal acuoso (Figura 3), con presencia multifocal de erosiones y focos de necrosis de la mucosa (Figura 4), a nivel de ciego y colon. La serosa estaba engrosada con presencia de agregados de fibrina en la superficie y hemorragias petequiales (figura 5). El análisis histopatológico del tracto intestinal evidenció una enteritis transmural linfohistioplasmocitaria fibrino-necrotizante, con formación microabscesos, necrosis de criptas y amplia serositis fibrinosuputarativa. Los ganglios linfáticos mesentéricos estaban incrementados de tamaño con una coloración rojiza intensa difusa (linfoadenitis hemorrágica mesentérica) (Figura 6), con expansión de la médula y corteza con amplias hemorragias, e hiperplasia folicular linfoide reactiva. El bazo se estaba incrementado de tamaño con marcada hiperplasia folicular linfoide. El hígado poseía una coloración rojiza oscura, con presencia de fibrina sobre la superficie (Figura 7). El citoplasma de los hepatocitos presentaba una extensiva degeneración vacuolar lipídica; presencia multifocal de agregados inflamatorios linfohistioplasmocitarios con apoptosis individual de hepatocitos. Ambos riñones presentaban áreas delimitadas de color blanquecino a nivel cortical y medular de aproximadamente 0,5x1 cm (fibrosis) (Figura 8), con degeneración de túbulos renales y proliferación de tejido conectivo.
Análisis complementarios
Diagnóstico microbiológico
Aislamiento, identificación y prueba de susceptibilidad a los antibióticos.
Se realizó el cultivo bacteriológico de una muestra de heces fresca obtenida directamente del animal, de acuerdo con la metodología descrita por Markey et al. 2013. En 10 ml. de caldo de Tetrationato (TTB) y 10 mL de caldo Rappaport-Vassiliadis (R-V) (BD Co., MD, USA), (BD Co., Spark, MD, USA). Se inoculó un hisopo con heces, el cual se incubó durante 24h en baño maría, a ٤٢°C. Al día siguiente se inoculó en agar de Xilosa-Lisina-Tergitol-4 (XLT-4) (Remel, Lenexa, KS, USA) con una incubación por 24 horas, a ٣٧°C. A las colonias sospechosas de Salmonella (colonias negras en agar XLT4) se hizo una tinción de Gram, y se realizaron las pruebas bioquímicas de lisina-hierro (LIA) (Sigma-Aldrich, MO, USA), hierro-triple-azúcar (TSI) (BD™, Le Pont de Claix, Francia) y una prueba aglutinación en lámina con el antisuero omnivalente contra Salmonella (Denka Seiken Ltd., Tokyo, Japón), como pruebas de tamizaje. Las colonias, que tenían un perfil compatible con Salmonella, se identificaron de forma definitiva por medio del sistema automatizado VITEK®2 (BioMerieux, Francia) utilizando las tarjetas GN. La determinación del perfil de susceptibilidad a los antibióticos se realizó por medio del evaluó en el mismo sistema automatizado VITEK®2, utilizando la tarjeta AST-279 la cual incluye los siguientes antibióticos: ampicilina, amoxicilina/ácido clavulánico, cefalexina, cefalotina, cefovecina, ceftiofur, imipenem, amikacina, gentamicina, neomicina, enrofloxacina, marbofloxacina, pradofloxacina, nitrofurantoína, cloranfenicol y sulfatrimetoprima. Las pruebas de identificación y antibiograma se realizaron de acuerdo con las recomendaciones del fabricante. Los perfiles de susceptibilidad fueron interpretados de acuerdo con la norma Clinical and Laboratory Standards Institute (CLSI, 2019). De los 12 antibióticos probados solamente 1 resultó resistente y 1 parcialmente resistente (Cuadro 3).

Adicionalmente, en el Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud, se realizó la serotipificación del aislamiento, de acuerdo con la metodología descrita por Kim et al. 2006, el serovar 1,4,5,12:i. se obtuvo como resultado a este estudio.
Discusión
Las bacterias del género Salmonella tienen el potencial de causar enfermedad gastrointestinal y sistémica en equinos. Esta infección, frecuentemente, se asocia con la contaminación en el recinto donde los equinos residen (Burgess and Morley, 2014).
Asimismo, tiene potencial de transmisión a otros animales y personas, causando morbilidad y mortalidad. Múltiples factores, entre ellos la edad, el estado inmune, la carga bacteriana, la virulencia de la cepa, factores estresantes y otras enfermedades concomitantes en los individuos, pueden favorecer la aparición de la enfermedad (Burguess, 2014).
En este caso, la paciente era una potra de pocos meses de edad, con un cuadro progresivo de 4 semanas de diarrea acuosa, no sanguinolenta, con amplio deterioro de su estado general de salud. La corta edad de la paciente es sugestiva de un posible proceso de inmunosupresión, el cual pudo servir como factor predisponente para desarrollo del cuadro infeccioso en el recinto donde permanecía.
No fue posible corroborar el estado de salubridad de las instalaciones de maternidad o recinto en donde inició el cuadro. Tampoco se pudo conocer el manejo postparto de la potra, el consumo de calostro, el estado de salud de la madre u otros factores que pudiesen haber contribuido a la instauración del cuadro infeccioso.
La presentación clínica del caso y un manejo complementario de múltiples análisis laboratoriales, permitieron establecer el diagnóstico correcto y definitivo del cuadro.
En Latinoamérica, hay pocos reportes debidamente estructurados de salmonelosis en equinos. En el sur de Brasil, se confirmaron 10 casos de salmonelosis, de los cuales seis animales tenían condiciones de salud predisponentes, los otros cuatro eran juveniles, siendo los principales síntomas clínicos la diarrea y anorexia (Duarte et al., 2017).
En Costa Rica, a pesar de que clínicamente la enfermedad se conoce, no existe aún un reporte de caso detallado en equinos debidamente confirmado y publicado. Con frecuencia, el diagnóstico de salmonelosis no se realiza eficazmente debido a la falta de análisis microbiológicos confirmatorios paralelos al abordaje del caso clínico. Además, su similitud con otros cuadros de diversas etiologías comunes, ya mencionadas, suele dar como resultado un manejo terapéutico sin confirmación apropiada de la etiología (León et al., 2018; Manship et al., 2018), lo cual conlleva a terapias inadecuadas. Este caso evidencia la disponibilidad de las herramientas diagnósticas laboratoriales confirmatorias de esta etiología en Costa Rica, las cuales deberían ser de uso rutinario en todos los servicios hospitalarios de veterinaria.
El manejo terapéutico de la salmonelosis se basa en: tratar la pérdida de líquidos, los desbalances de electrolitos y pH, reducir el proceso inflamatorio intestinal para recuperar la integridad y su función. Esto, en etapas tempranas de la enfermedad, marca drásticamente las posibilidades de éxito o de sobrevida en el cuadro (Shaw, 2018). De existir, también, leucopenia, se debe realizar una terapia antimicrobiana adecuada y oportuna, de forma individualizada, basada en los resultados del cultivo y antibiograma.
Cuando la bacteria es resistente a uno o varios antibacterianos, las opciones para tratamiento disponible se reducen o son nulas, lo cual empeora el pronóstico de vida. La cronicidad, severidad y rápido deterioro del paciente abordado, en este caso, fue un factor desfavorable en establecimiento de un correcto y oportuno tratamiento.
Se debe de considerar que, la identificación del agente patógeno y la prueba de antibiograma es un proceso laboratorial, el cual puede tomar entre 5-7 días, por lo cual, los abordajes clínicos deben ser oportunos en cuanto a tiempo. Un factor, que va en detrimento de estas buenas prácticas, es la reluctancia de algunos propietarios a una correcta asesoría veterinaria en las etapas preagudas de la enfermedad, factor que limita el buen accionar de este y va en deterioro directo de la salud del paciente. Estos factores fueron evidentes en este caso.
El manejo de los casos sospechosos y confirmados de salmonelosis representa una responsabilidad ética y profesional para los médicos veterinarios, para evitar la diseminación y transmisión de la enfermedad en instalaciones de salud animal, establos, fincas y entre el personal humano involucrado en estas áreas, atenuando o minimizando las complicaciones que puede conllevar este agente de importancia para la salud pública y distribución mundial (Burgess and Morley, 2014).
Conclusión
Salmonella entérica es un agente infeccioso de alta relevancia en la salud pública. Es causante de abdomen agudo en caballos, posiblemente subdiagnosticado, y representa una amenaza para la salud animal y el ser humano. La enfermedad asociada a este agente requiere de un abordaje médico integral y oportuno que conlleve a la caracterización del agente causal, permitiendo así la instauración de medidas terapéuticas que preserven la integridad del paciente y disminuyan la diseminación del agente a individuos susceptibles, ya que esta bacteria representa una de las principales infecciones nosocomiales en centros hospitalarios y potencialmente zoonóticas (León et al. 2018).
En Costa Rica, existen instituciones y laboratorios especializados que disponen de las técnicas diagnósticas confirmatorias adecuadas para identificar esta patología. Estos recursos deberían ser más utilizadas por los médicos veterinarios que abordan este tipo de enfermedades. En este caso, se integraron las diferentes áreas y metodologías laboratoriales que permitieron establecer un diagnóstico definitivo, que lastimosamente, por el deteriorado estado de salud del paciente, no pudieron traducirse en una recuperación oportuna de este; sin embargo, deja en evidencia la accesibilidad de las mismas y su utilidad para la correcta resolución de esta importante enfermedad.
Conflicto de intereses
Los autores declaran que no existe ningún conflicto de interés potencial en esta publicación.
Referencias
Arroyo, L., Gómez, D. & Martins, C. (2018). Equine Duodenitis-proximal jejunitis: A review. Can Vet J. 59(5): 510–517. https://doi.org/10.1155/2020/7062408
Bousquet-Melou, A., Bernard, S., Schneider, M., & Toutain, P. L. (2002). Pharmacokinetics of marbofloxacin in horses. Equine veterinary journal, 34(4), 366–372. https://doi.org/10.2746/042516402776249191
Burgess, B. & Morley, P. (2014). Managing Salmonella in Equine Populations. Vet Clin Equine. 30(3): 623-640. https://doi.org/10.1016/j.cveq.2014.08.005
Grandolfo, E., Parisi, A., Ricci, A., Lourusso, E., De Siena, R., Trotta, A., Buonavoglia, D., Martella, V. & Corrente, M. 2018. High Mortality in foals associated with Salmonella enterica subsp enterica abortusequi infection in Italy. Journal of Veterinary Diagnostic Investigation. 30(3): 483-485. https://doi.org/10.1177/1040638717753965
Kirk MD, Pires SM, Black RE, Caipo M, Crump JA, Devleesschauwer B, Döpfer D, Fazil A, Fischer-Walker CL, Hald T, et al. (2015). World Health Organization Estimates of the Global and Regional Disease Burden of 22 Foodborne Bacterial, Protozoal, and Viral Diseases, 2010: A Data Synthesis. PLOS Medicine. 12(12):e1001921. https://doi.org/10.1371/journal.pmed.1001921
Kim S, Frye JG, Hu J, Fedorka-Cray PJ, Gautom R, Boyle DS. 2006. Multiplex PCR-Based Method for Identification of Common Clinical Serotypes of Salmonella enterica subsp. enterica. J Clin Microbiol. 44(10):3608–3615. https://doi.org/10.1128/JCM.00701-06
Knych, H. K., Arthur, R. M., McKemie, D. S., Baden, R. W., Seminoff, K., & Kass, P. H. (2021). Pharmacokinetics and anti-inflammatory effects of flunixin meglumine as a sole agent and in combination with phenylbutazone in exercised Thoroughbred horses. Equine veterinary journal, 53(1), 102–116. https://doi.org/10.1111/evj.13260
Lahiri Amit, Lahiri Ayan, Iyer N, Das P, Chakravortty D. (2010). Visiting the cell biology of Salmonella infection. Microbes and Infection. 12(11):809–818. https://doi.org/10.1016/j.micinf.2010.05.010
Leon, I., Lawhon, S., Norman, K., Treadhill, D., Ohta, N., Vinasco, J. & Scott, H. 2018. Serotype diversity and antimicrobial resistence among Salmonella enterica isolates from patients at an equine referral hospital. Appl Environ Microbiol. 84(13): 8-11. https://doi.org/10.1128/AEM.02829-17
Magdesian K. G. (2005). Neonatal foal diarrhea. The Veterinary clinics of North America. Equine practice, 21(2), 295–vi. https://doi.org/10.1016/j.cveq.2005.04.009
Manship, A., Blikslager, A., & Elfenbein, J. (2018). Disease features of equine coronavirus and enteric salmonellosis are similar in horses. J Vet Inter Med. 33 (2): 912-917. https://doi.org/10.1111/jvim.15386
Markey, B., Leonard, F., Archambault, M., Cullinane, A. & Maguire, D. (2013). Clinical Veterinary Microbiology. (2ed) Elsevier sounders. https://books.google.com/book/.about/.Clinical_Veterinary_Microbiology_E_Book.html?hl=es&id=FUJYAQAAQBAJ
Martelli F, Kidd S, Lawes J. (2018). Salmonella and salmonellosis in horses: an overview. Veterinary Record. 182(23):659–660. https://doi.org10.1136/vr.k2525
Shaw, S, & Stamfli, H. (2017). Diagnosis and treatment of undifferentiated and infectious acute diarrhea in the adult horse. Vet Clin Equine. 34(1): 39-53. https://doi.org/10.1016/j.cveq.2017.11.002
Stokol T. (2020). Hematology Red Flags: The Value of Blood Smear Examination in Horses. The Veterinary clinics of North America. Equine practice, 36(1), 15–33. https://doi.org/10.1016/j.cveq.2019.11.00
Waxman, S. J., KuKanich, B., Milligan, M., Beard, W. L., & Davis, E. G. (2012). Pharmacokinetics of concurrently administered intravenous lidocaine and flunixin in healthy horses. Journal of veterinary pharmacology and therapeutics, 35(4), 413–416. https://doi.org/10.1111/j.1365-2885.2011.01356.x

Licencia Creative Commons Atribución-No-Comercial