
Rev. Ciencias Veterinarias, Vol. 41, N° 2, [1-13], E-ISSN: 2215-4507, julio-diciembre, 2023
DOI: https://doi.org/10.15359/rcv.41-2.1
URL: http://www.revistas.una.ac.cr/index.php/veterinaria/index
Trampa de fondo como una alternativa en el control integrado del ácaro Varroa destructor en colmenas de abejas africanizadas
Bottom board trap as an alternative in the integrated control of the mite Varroa destructor in Africanized honey bee colonies
Armadilha de fundo como uma alternativa no controle integrado do ácaro Varroa destructor em colmeias de abelhas africanizadas
Rafael A. Calderón-Fallas1 , Fernando Ramírez-Arias 2, Luis Sánchez-Chaves3
, Fernando Ramírez-Arias 2, Luis Sánchez-Chaves3
 Autor de correspondencia: rafael.calderon.fallas@una.cr
Autor de correspondencia: rafael.calderon.fallas@una.cr
1 Universidad Nacional, Centro de Investigaciones Apícolas Tropicales, Programa Integrado de Patología Apícola, Lagunilla de Ulloa, Heredia, Costa Rica, Correo electrónico: rafael.calderon.fallas@una.cr  0000-0002-6991-6899
0000-0002-6991-6899
2 Universidad Nacional, Centro de Investigaciones Apícolas Tropicales, Programa de Producción Apícola Sostenible: Manejo Integrado de Apiarios y Reinas Seleccionadas, Lagunilla de Ulloa, Heredia, Costa Rica. Correo electrónico: jose.ramirez.arias@una.cr  0000-0001-5902-3512
0000-0001-5902-3512
3- Universidad Nacional, Centro de Investigaciones Apícolas Tropicales, Programa Integrado de Ecología y Polinización, Lagunilla de Ulloa, Heredia, Costa Rica. Correo electrónico: luis.sanchez.chaves@una.cr  0000-0003-4903-8176
0000-0003-4903-8176
Recibido: 10 de agosto de 2022. Corregido: 2 de junio de 2023. Aceptado: 7 de junio de 2023.
Resumen
Se midió la efectividad de la trampa de fondo en el control del ácaro Varroa destructor en colmenas de abejas africanizadas, de junio a setiembre 2017, en Atenas, Alajuela. Se registró la caída natural de ácaros durante un período de 30 días en la trampa, la cual consistió en un fondo de madera (50 x 42 cm), cubierto con cedazo metálico en la parte superior, con un tamaño de tamiz de seis agujeros por cm2. En el interior de la trampa, se colocó una lámina de cartulina blanca, impregnada con vaselina, previamente cuadriculada, para facilitar el conteo de los ácaros, la cual se reemplazó cada siete días. Luego del día 30, los ácaros remantes se eliminaron. Se determinó la efectividad del método, para lo cual se aplicó cuatro tiras de flumetrina a cada colmena, durante seis semanas. Adicionalmente, se evaluó la mortalidad de los diferentes estadios de varroa en la cría sellada (operculada) de obrera. La caída natural de ácaros, en 30 días, fue de 715 ± 531 (n= 5). La mayor cantidad de varroa se observó al día 22, colectándose 335 ± 285 ácaros, mientras que el menor número se obtuvo el primer día de muestreo con 30 ± 13. Al aplicar flumetrina, se eliminaron 2072 ± 1874 ácaros. Este procedimiento permitió establecer la cantidad de ácaros caídos naturalmente y eliminados de la colmena mediante la trampa de fondo, correspondió a un 25.7%. Por otra parte, se determinó que la mortalidad de los diferentes estadios de varroa, en la cría sellada de obrera, fue menor a un 10.0%. En conclusión, la trampa de fondo eliminó más de la cuarta parte de los ácaros presentes en las colmenas, por lo cual, este método puede ser considerado como una opción en el manejo integrado de varroa en colmenas de abejas africanizadas.
Palabras clave: trampa de fondo, ácaro Varroa destructor, abejas africanizadas, control integrado
Abstract
The effectiveness of the bottom board trap to control the mite Varroa destructor in Africanized honey bee colonies was evaluated from June to September 2017 in Atenas, Alajuela. Naturally fallen mites were collected during a 30-day period with a bottom board trap, which consisted of a wooden bottom (50 x 42 cm) modified with a metal lattice and a screen of six holes per cm2. A white piece of cardboard previously gridded and coated with a thin layer of Vaseline to help count the number of fallen mites was placed inside the trap. The cardboard was replaced every seven days. After 30 days, the remaining mites were eliminated, and the effectiveness of the method was determined by applying four strips of flumethrin to each hive for six weeks. Furthermore, the mortality of the different Varroa stages in a sealed (operculated) worker brood was evaluated. Naturally fallen Varroa mites were 715 ± ٥٣١ (n= 5) during a 30-day period. Mite mortality occurred mainly during day 22 with 335 ± 285, whereas the lowest number was collected on day one with 30 ± 13 mites. After applying flumethrin, mite mortality was 2072 ± 1874. The above allows us to establish that the number of mites that fell naturally and those eliminated from the hive by means of the bottom trap corresponded to 25.7%. In addition, it was determined that Varroa mortality in capped worker brood cells was less than 10.0%. In conclusion, the bottom board trap eliminated more than a quarter of the mites in the beehives; consequently, this method may be considered as an alternative in the integrated Varroa management in Africanized honey bees.
Keywords: bottom board trap, mite Varroa destructor, Africanized honey bees, integrated control
Resumo
A eficácia da armadilha de fundo no controle do ácaro Varroa destructor em colmeias africanizadas foi medida entre junho e setembro de 2017 em Atenas, Alajuela. A queda natural dos ácaros foi registrada durante um período de 30 dias na armadilha, que consistiu em um fundo de madeira (50 x 42 cm), coberto com uma tela metálica na parte superior com um tamanho da peneira com seis furos por cm2. No interior da armadilha foi colocada uma folha branca impregnada com vaselina e, previamente quadriculada, para facilitar a contagem dos ácaros e que foi substituída a cada sete dias. Após o dia 30, os ácaros remanescentes foram eliminados e a eficácia do método foi determinada aplicando quatro tiras de flumetrina em cada colmeia durante seis semanas. Além disso, avaliou-se a mortalidade dos diferentes estágios do Varroa na criação operculada das operárias. A queda natural dos ácaros em 30 dias foi de 715 ± 531 (n = 5). A maior quantidade do Varroa foi observada no dia 22 coletando-se 335 ± 285 ácaros enquanto o menor número foi obtido no primeiro dia da amostragem com 30 ±13. Ao aplicar flumetrina foram eliminados 2072 ±1874 ácaros. Isso permite estabelecer que a quantidade dos ácaros caídos naturalmente e eliminados da colmeia através da armadilha de fundo correspondeu a um total de 25,7%. Por outro lado, determinou-se que a mortalidade dos diferentes estágios de varroa na criação operculada das operárias foi inferior a 10,0%. Em conclusão, a armadilha de fundo eliminou mais de um quarto dos ácaros presentes nas colmeias, pelo que este método pode ser considerado uma alternativa no manejo integrado de varroa em colmeias de abelhas africanizadas.
Palavras-chave: armadilha de fundo, ácaro Varroa destructor, abelhas africanizadas, controle integrado
Introducción
La Varroosis es una de las enfermedades de mayor importancia económica que afecta a las abejas melíferas (Apis mellifera) a nivel mundial (Bailey & Ball, 1991; Calderón, 2019; Espina & Ordetx, 1984). Es causada por el ácaro Varroa destructor (Ritter, 2001), el cual fue detectado, en Costa Rica, el 26 de setiembre de 1997 (Calderón et al., 1998).
El ácaro varroa parasita tanto a la cría (período reproductivo), como a las abejas adultas (período forético); sin embargo, se reproduce exclusivamente en la cría sellada (operculada) de obrera y zángano (Ritter, 2001; Vandame, 2000). Ingresa a la celda con cría poco antes de ser operculada (Vandame, 2000), se traslada hasta el fondo de esta, donde permanece en el alimento larval. Una vez que las obreras operculan la celda, varroa se desplaza hacia la larva e inicia su alimentación (Calderón et al., 2017; Ritter, 2001). Aproximadamente 60 horas después de operculada la celda, la hembra pone el primer huevo, el cual da origen al macho, mientras que los siguientes huevos son colocados a intervalos de 30 horas y de ellos se originan hembras (Bailey & Ball, 1991). Mientras que el ácaro V. destructor permanece en la celda sellada, está protegido de la mayoría de acaricidas, ya que estos actúan principalmente sobre los ácaros presentes en las abejas adultas. No obstante, se menciona que, en la cría operculada, ocurre mortalidad natural, tanto del ácaro madre como de los estadios inmaduros (Martin, 1994).
Para el control de la Varroosis, existen diferentes productos. Dentro de ellos los acaricidas químicos son los más utilizados, principalmente los piretroides, como el fluvalinato (Apistan®). Sin embargo, el uso inadecuado e indiscriminado, como la subdosificación y el uso de preparaciones caseras, han provocado que el ácaro desarrolle resistencia (Kanga et al., 2010; Milani, 1995; Trouiller, 1998). Además, los acaricidas químicos, pueden contaminar los productos de la colmena con residuos que afectan la salud del consumidor (Al-Rifai & Akeel, 1997; Tsigouri et al., 2003; Wallner, 1999).
Como una posibilidad a los químicos, se ha investigado el uso de productos alternativos de bajo impacto ambiental, como el timol (Thymus spp.) (aceite esencial), sustancia natural derivada de la planta del tomillo y el ácido fórmico, presente en algunos insectos, como en las hormigas. El uso del timol tiene la ventaja de presentar baja toxicidad y un reducido impacto en el ambiente (Adamczyk et al., 2005; Bogdanov, 2006). Mientras que una de las principales ventajas del ácido fórmico, es que se encuentra naturalmente en pequeñas cantidades en la miel, por lo que no se considera un contaminante (Bogdanov, 2006; Eguaras et al., 2003). En Costa Rica, se ha realizado diferentes ensayos aplicando estos productos de manera tradicional (ácido fórmico en forma líquida y el timol en cristales), obteniendo resultados favorables (efectividades superiores al 50%) (Calderón et al., 1999; Calderón et al., 2000b). Sin embargo, al actuar por evaporación, la efectividad de ambos productos se ve afectada por condiciones de temperatura y humedad ambiental (Emsen et al., 2007; Ritter, 1993).
Las desventajas de los acaricidas químicos y los inconvenientes de los productos alternativos, ha conllevado al estudio de métodos que permitan eliminar, de la colmena, los ácaros que caen de manera natural (sin aplicar algún producto a la colmena), debido a la conducta higiénica y, principalmente, al comportamiento de limpieza (acicalamiento) de las abejas; en menor medida, a la mortalidad de ácaros adultos (edad). Se ha reportado que, mediante el comportamiento de limpieza, las abejas remueven, de su cuerpo, una cantidad considerable de ácaros (Moretto & Leonidas, 1999). Además, en ciertos casos causan lesiones (con la mandíbula) en las extremidades e idiosoma de varroa (Rosenkranz, 1999) e incluso ocasionan la muerte (Szabo et al., 1996).
El comportamiento de limpieza se refiere a movimientos de las patas mesotorácicas de las abejas, mediante los cuales se limpian vigorosamente cuando están infestadas con el ácaro varroa (Moretto & Leonidas, 1999; Peng et al., 1987). Mediante este comportamiento, los ácaros removidos del cuerpo de la abeja caen al fondo de la colmena, sin embargo, la mayoría sobrevive en buenas condiciones (viables y sin lesiones aparentes) (Webster et al., 2000), por lo que reinfestan a su hospedero (Büchler, 1994). Lo anterior, ha motivado el desarrollo de métodos que eliminen los ácaros que caen constantemente de manera natural (por acicalamiento y el comportamiento higiénico de las abejas) y de esta manera, evitar la reinfestación de las abejas (Calderón, 2011), para lo cual se ha propuesto modificar el fondo de la colmena (Pettis & Shimanuki, 1999). No obstante, se debe tomar en cuenta que el método no altere drásticamente la temperatura del nido, para evitar el enfriamiento de la cría (especialmente en la época lluviosa) y que el período no sea tan extenso, que afecte el desarrollo de la colmena (población adecuada de abejas adultas y cría).
Debido a la poca información relacionada con métodos alternativos para el manejo de V. destructor en abejas africanizadas, el objetivo de este estudio consiste en evaluar la efectividad de la trampa de fondo (diseñada y adaptada en el Programa Integrado de Patología Apícola, CINAT-UNA), en la captura y eliminación de ácaros caídos en forma natural, como una alternativa en el control integrado de varroa. Además, debido a que los ácaros que mueren en la cría sellada son eliminados de la celda al emerger las abejas (mediante el comportamiento higiénico) y caen al fondo de la colmena, en la investigación se cuantificó la mortalidad natural del ácaro madre y su descendencia, en cría operculada de obrera.
Lo anterior, con la finalidad de reducir la población de ácaros en las abejas y disminuir la aplicación de acaricidas químicos a las colmenas y así evitar la presencia de residuos en la miel. Específicamente, este estudio beneficiará a los productores de miel orgánica, pues los métodos para el control de varroa, aceptados en este tipo de apicultura, son muy escasos. Además, beneficiará la salud pública, dado que se disminuye el riesgo de contaminar la miel, garantizando al consumidor acceso a productos libres de residuos.
Materiales y métodos
La investigación se realizó en un apiario experimental del CINAT, constituido por 16 colmenas de abejas africanizadas (Apis mellifera) (Spivak, 1991), ubicado en el Cantón de Atenas, provincia de Alajuela (9º58’N, 84º24’ O, 700 msnm), clasificado como bosque húmedo premontano, con una temperatura promedio de 23.7°C. Se llevó a cabo de junio a setiembre 2017 (época lluviosa), meses en los cuales hay una mayor prevalencia y niveles elevados de infestación del ácaro varroa (Calderón et al., 2007). Las colmenas estaban conformadas, aproximadamente, por ocho panales (cuatro panales con cría y cuatro con reservas de miel-polen) y una abeja reina joven (menos de seis meses de edad) (las reinas se desarrollaron para este estudio). La alimentación de las colmenas fue similar a la que se realiza en un apiario comercial. Se les proporcionó un galón de jarabe de azúcar (una parte de azúcar y una parte de agua), una vez por semana durante el período de estudio.
Método evaluado
Se selecciona cinco colmenas infestadas con varroa (promedio de infestación= 8.1 ± 2.1) para evaluar la caída natural de ácaros durante un período de 30 días (durante este tiempo no se aplicó producto acaricida), para lo cual se colocó una trampa de fondo (se reemplazó temporalmente el piso de cada colmena). La trampa consistió en un fondo de madera (50 x 42 cm), cubierto con un cedazo metálico en la parte superior. El tamaño del tamiz fue de seis agujeros por cm2, el cual permitió el paso de los ácaros y, a la vez, impidió el contacto con las abejas (Anexo 1). En el interior de cada trampa, se colocó una lámina de cartulina blanca, impregnada con vaselina; previamente cuadriculada para facilitar el conteo de varroa. Para no abrir las colmenas y disturbar a las abejas, la cartulina se introdujo por la parte posterior de la trampa (en una bandeja móvil metálica). Inicialmente, las láminas de cartulina permanecieron por 24 y 72 h, posteriormente se reemplazaron cada siete días y se llevaron al laboratorio de Patología Apícola-CINAT, para realizar el registro de los ácaros.
Producto de choque
Luego del día 30, se aplicaron cuatro tiras de Bayvarol® (3.6 mg de flumetrina por tira) a cada colmena, durante seis semanas, con el fin de eliminar los ácaros remantes. Se utilizó el Bayvarol® como producto de choque, dado que su efectividad, en el control del ácaro varroa, es superior al 98.0% (Calderón et al., 2000a).
Efectividad del método
Para determinar la efectividad de la trampa de fondo, se cuantificó la caída natural de varroa durante los primeros 30 días; posteriormente la mortalidad de ácaros con el Bayvarol® durante seis semanas, considerando que ambos conteos representan el total de ácaros presentes en la colmena.
El porcentaje de efectividad se obtuvo con la siguiente fórmula:

Mortalidad en la cría sellada
Se analizó la mortalidad natural del ácaro madre y su descendencia (protoninfa, deutoninfa, macho y hembra), en la cría operculada de obrera (n= 315 celdas). Se tomó una muestra de panal (10 x 10 cm) con cría sellada de obrera, proveniente de las colmenas experimentales. Los panales se colectaron a los siete días de iniciado el ensayo y se trasladaron al laboratorio para su análisis inmediato (los panales no se refrigeraron, ni se congelaron). Se removió el opérculo de la celda con una pinza de punta fina. Se retiró la pupa y se colocó en una placa de petri. Además, con una lupa con fuente de luz, se revisó cuidadosamente el fondo de la celda para determinar la presencia de ácaros (maduros e inmaduros). Con la finalidad de determinar la condición (mortalidad) de los diferentes estadios de varroa. Los ácaros se examinaron con un estereoscopio (10x).
Para cada celda analizada:se registró la etapa de desarrollo de la pupa de la abeja, el total de ácaros adultos, así como la cantidad y el estadio de desarrollo de la cría. Para clasificar la etapa de desarrollo (estadios maduros e inmaduros de varroa), se tomó como referencia el desarrollo ontogénico señalado por Martin (1994, 1995). Los diferentes estadios, se clasificaron como: huevo-larva, protoninfa, deutoninfa, macho e hija adulta (Ifantidis, 1997).
La mortalidad de los estadios de varroa, se comprobó según los siguientes parámetros, indicados por Ifantidis (1997):
a. Un ácaro no es viable si presenta deformaciones o alteraciones en el cuerpo. Por ejemplo, se observan deshidratados y con apariencia plegada.
b. Los estadios móviles (protoninfa móvil, deutoninfa móvil, macho, hija adulta y ácaro madre adulto) que no presenten movimiento en las extremidades, son considerados muertos.
c. La mortalidad de los estadios inmóviles, especialmente la deutoninfa, se establece por la pérdida de movimientos peristálticos en los túbulos de Malpighi (se revisaron en el estereoscopio a un aumento de 10x). En condiciones normales, los túbulos se encuentran bien formados y son visibles a través del integumento.
d. La mortalidad de la deutoninfa, durante el proceso de muda, es reconocida por la ausencia de movimiento de las extremidades, las cuales se observan contraídas contra el opistoma.
Análisis de los datos
Para la cantidad de ácaros (registro de la caída natural y mortalidad) se calcularon estadísticas descriptivas: el promedio y medidas de variación (desviación estándar) por semana (promedio ± DE). El análisis de los datos, mediante pruebas de proporción (igualdad entre dos o más razones), permitió concluir sobre la efectividad del método analizado. Además, al considerar el tiempo como un factor incidental, se utilizó el análisis interacción-tiempo para establecer diferencias observadas en la caída natural de ácaros durante el período de evaluación.
Resultados
Se registró una caída considerable de ácaros en abejas africanizadas durante el período de estudio, los cuales se capturaron y eliminaron de la colmena mediante la trampa de fondo.
La caída natural de varroa fue de 715 ± ٥٣١ (n= 5) ácaros, durante un período de 30 días. La mayor cantidad de ácaros se observó al día 22, colectándose 335 ± 285, mientras que la menor cantidad se obtuvo el primer día de muestreo con 30 ± 13 ácaros. Al administrar la flumetrina (Bayvarol®), se eliminaron 2072 ± 1874 ácaros remanentes. Lo anterior permite establecer que la efectividad de la trampa de fondo, en la captura y eliminación de ácaros caídos en forma natural, correspondió a un 25.7% (Cuadro 1).
Cuadro 1. Caída natural del ácaro varroa en colmenas de abejas africanizadas (n= 5), (Promedio ± DS) durante un período de 30 días.
|
Período de muestreo (días) |
1 |
3 |
8 |
15 |
22 |
30 |
Total |
Flum |
Caída natural (%) |
|
Ácaros caídos |
30 ± 13 |
55 ± 45 |
79 ± 46 |
67 ± 57 |
335 ± 285 |
149 ± 131 |
715 ± 531 |
2072 ± 1874 |
25.7 |
Flum= Flumetrina, aplicada a las colmenas durante 42 días como producto de choque.
Distribución de la caída natural de varroa
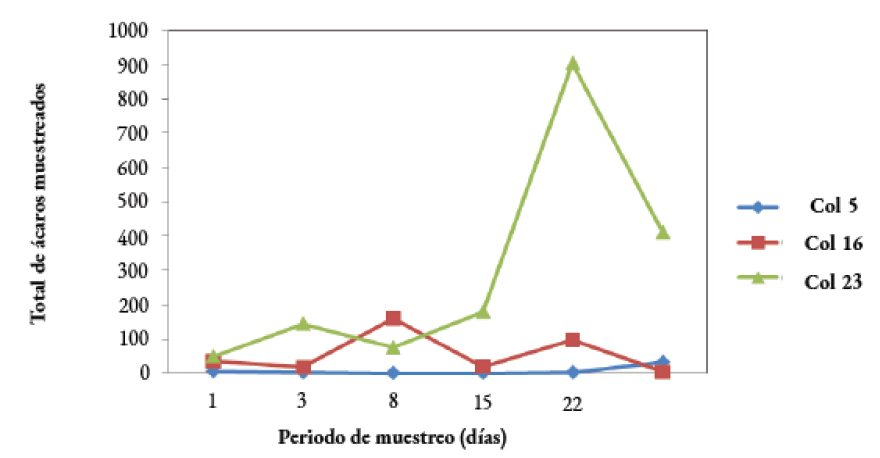
Durante las primeras 24 horas de evaluación, el promedio de ácaros en las colmenas fue de 30 ± 13. La colmena número 5 presentó una colecta más homogénea de varroa respecto a las otras colmenas, con un promedio de 12 ácaros por semana. Por otra parte, la colmena número 16 mostró caídas evidentes en los días 8 y 22, con 160 y 98 ácaros, respectivamente. Mientras que la colmena 23 presentó los niveles más elevados de caída natural de varroa, siendo superiores a los 75 ácaros por semana, hasta alcanzar 903 individuos el día 22 del estudio (Figura 1).
Figura 1. Caída natural del ácaro varroa durante un período de 30 días de evaluación.
Mortalidad de varroa en cría sellada de obrera
Se debe indicar que, en un número considerable de celdas, con pupas de abeja en fase temprana de desarrollo, se encontró únicamente el ácaro madre (aún no había iniciado el ciclo reproductivo).
Se determinó una baja mortalidad del ácaro madre y su descendencia en la cría sellada de obrera, observándose la mayoría en buenas condiciones. La mortalidad del ácaro madre correspondió a un 7%, mientras que en los estadios inmaduros y las hembras (hijas), fue menor al 6%. Se debe mencionar que la mayoría de protoninfas y deutoninfas, se encontraban en condiciones viables, con apariencia uniforme (turgentes) y movimiento de las extremidades. Por otra parte, el estadio de varroa con mayor mortalidad fue el macho (Cuadro 2).
Cuadro 2. Mortalidad natural de los diferentes estadios del ácaro varroa en celdas con cría sellada de obrera (n= 315*).
|
Estadio ácaro |
Total |
Muertos |
Mortalidad (%) |
|
Madres |
391 |
29 |
7 |
|
Protoninfas |
207 |
11 |
5 |
|
Deutoninfas |
78 |
4 |
5 |
|
Hembras (hijas) |
16 |
1 |
6 |
|
Machos |
31 |
5 |
16 |
* n= 315, corresponde a las celdas infestadas con el ácaro varroa que se analizaron para determinar mortalidad.
Discusión
A la fecha, se han realizado pocos estudios para evaluar la trampa de fondo como un método alternativo, en el manejo integrado del ácaro varroa en colmenas de abejas africanizadas en Costa Rica (Calderón, 2011). Como se mencionó, mediante el comportamiento de limpieza, la varroa es removida del cuerpo de la abeja y cae al fondo de la colmena; no obstante, al no sufrir ninguna afectación severa (viable), la mayoría de los ácaros reinfestan a su hospedero (Webster et al., 2000).
En este estudio, un 25.7% de los ácaros cayeron naturalmente, en un período de 30 días, siendo capturados, cuantificados y eliminados de la colmena mediante la trampa de fondo. Esta caída de varroa es similar a la obtenida por Espinosa & Guzmán (2007) en México, quienes indicaron un 21.9% de mortalidad de ácaros en un grupo de colmenas de abejas africanizadas. Asimismo, Calderón (2011) registró más de un 30.0% de ácaros eliminados en abejas africanizadas, en un período de cuatro semanas, utilizando en las colmenas un fondo modificado con cedazo metálico (fondo sanitario).
La caída de ácaros fue notoria en una de las colmenas, la cual tenía una alta población de abejas adultas (fuerte) y mostraba un evidente comportamiento de limpieza, en comparación con las otras colmenas analizadas. Estudios realizados en Brasil, mencionan que la abeja africanizada presenta una mayor resistencia o tolerancia al ácaro V. destructor en comparación con abejas de origen europeo (Junkes et al., 2007; Moretto & Leonidas, 2003). Esta tolerancia se ha relacionado con ciertos factores, como el comportamiento higiénico de las abejas (Harbo & Harris, 2005; Spivak & Reuter, 2001) y especialmente con el comportamiento de limpieza (Moretto & Leonidas, 1999). De acuerdo con Moretto (1997) las abejas africanizadas son ocho veces más eficientes en la remoción de ácaros de su cuerpo, mediante el comportamiento de limpieza, comparado con abejas de origen europeo, eliminando hasta un 31.0% de varroa (auto-limpieza y alo-limpieza) (Moretto et al., 1991). El comportamiento de limpieza de las abejas africanizadas es similar al registrado en la abeja asiática A. cerana, hospedero natural de V. destructor (Peng et al., 1987).
Los resultados de Arechavaleta-Velasco & Guzmán-Novoa (2001) y Guzmán-Novoa et al. (1999) en abejas africanizadas en México, son similares a los mencionados en Brasil. Sugieren que el comportamiento de limpieza es uno de los principales mecanismos que confiere tolerancia hacia el ácaro varroa. No obstante, Vandame et al. (2002) encontraron que la capacidad de limpieza fue ligeramente mayor en abejas africanizadas (11.0% de los ácaros se removieron), comparado con abejas europeas (8.0% de los ácaros se eliminaron).
El comportamiento de limpieza, mediante el cual las abejas se limpian cuando están infestadas con varroa (Büchler, 1994; Moretto & Leonidas, 1999; Peng et al., 1987) y logran remover ácaros de su cuerpo, los que caen al piso de la colmena, puede ser aprovechado (potenciado) de manera conjunta con la trampa de fondo (Liu et al., 2020), para capturar y eliminar, de manera efectiva, una cantidad considerable de ácaros de la colmena. De acuerdo con Liu et al. (2020) la población de varroa, en colmenas con trampa de fondo, es significativamente menor comparada con colmenas que utilizan el fondo tradicional de madera. Por lo cual recomiendan su uso, como una alternativa (herramienta) para el control integrado de este ácaro.
Mortalidad de varroa en celdas con cría sellada de obrera
Para llevar a cabo su reproducción, V. destructor ingresa a una celda con cría (Calderón, 2019; Ritter, 2001). Como se indicó, dentro de la celda sellada varroa está resguardado de los acaricidas, dado que estos actúan sobre los ácaros foréticos. Lo anterior, es una limitante para el tratamiento, pues aumenta el período de aplicación de los productos (los ácaros deben emerger de la celda junto con las abejas) (Koeniger & Fuchs, 1988).
Mortalidad natural
Se ha reportado que, en condiciones naturales, se presenta mortalidad de varroa en la cría sellada, tanto del ácaro madre como de su descendencia. En el estudio, se determinó una mortalidad reducida del ácaro madre y su descendencia en la cría operculada, observándose la mayoría de individuos en óptimas condiciones, con apariencia uniforme (turgentes) y movimiento de las extremidades. La mortalidad observada, puede estar relacionada con la competencia que se da entre los diferentes individuos por alcanzar el sitio de alimentación en la pupa, afectando, principalmente, a los estadios inmaduros (Martin, 1994). Asimismo, se menciona que el tamaño de la celda de obrera afecta la viabilidad de la cría inmadura, debido a que el espacio disponible es limitado (Donzé & Guerin, 1994).
El estadio de varroa con mayor mortalidad natural fue el macho, lo cual concuerda con lo obtenido por Calderón et al. (2012), quienes registraron una mortalidad del 23,9% en el ácaro macho adulto. La mortalidad del macho podría deberse a la falta de alimentación, pues se indica que su aparato bucal está modificado para la transferencia de espermatozoides (Ritter, 2001). De acuerdo con Martin et al. (1997), los estadios del ácaro que no logran ubicar el sitio de alimentación o que no lo utilizan, eventualmente mueren. Los ácaros que mueren en la cría sellada son eliminados de la celda mediante el comportamiento higiénico de las abejas (al emerger la abeja de la celda) y eventualmente caen al fondo de la colmena (Donzé & Guerin, 1994).
En conclusión, la trampa de fondo permitió eliminar, de manera efectiva, una cantidad considerable de ácaros de la colmena, por lo que este método puede ser recomendado como una opción en el control integrado de varroa (junto a otros métodos) en colmenas de abejas africanizadas en condiciones tropicales. Además, se determinó una baja mortalidad de los diferentes estadios de varroa en la cría sellada de obrera.
Conflicto de intereses
Los autores declaran no tener conflicto de interés en este estudio.
Agradecimientos
Deseamos agradecer al compañero del CINAT, Guillermo Ramírez Arias, por la colaboración en el manejo de las colmenas experimentales durante el desarrollo del estudio.
Referencias
Adamczyk, S., Lázaro, R., Pérez-Arquillué, C., Conchello, P. & Herrera, A. (2005). Evaluation of residues of essential oil components in honey after different anti-Varroa treatments. Journal of Agricultural and Food Chemistry, 53, 10085-10090. https://doi.org/10.1021/jf051813f
Al-Rifai, J. & Akeel, N. (1997). Determination of pesticide residues in imported and locally produced honey in Jordan. Journal of Apicultural Research, 36, 155-161. https://doi.org/10.1080/00218839.1997.11100943
Arechavaleta-Velasco, M. & Guzman-Novoa, E. (2001). Relative effect of four characteristics that restrain the population growth of the mite Varroa destructor in honey bee (Apis mellifera) colonies. Apidologie, 32, 157-174. https://doi.org/10.1051/apido:2001121
Bailey, L. & Ball, B. (1991). Honey Bee Pathology. Academic Press, London.
Bogdanov, S. (2006). Contaminants of bee products. Apidologie, 37, 1-18. https://doi.org/10.1051/apido:2005043
Büchler, R. (1994). Varroa tolerance in honey bees-occurrence, characters and breeding. Bee World, 75, 54-70. https://doi.org/10.1080/0005772X.1994.11099201
Calderón, R.A., Arce, H. & Van Veen, J. (1998). Detección, distribución y control de Varroa jacobsoni Oudemans en Costa Rica. Revista Ciencias Veterinarias, 21, 31-40.
Calderón, R.A., Van Veen, J., Arce, H. & Ramírez, M. (1999). Use of formic acid for varroa mites control in the tropical conditions of Costa Rica. Revista Ciencias Veterinarias, 22, 21-27.
Calderón, R.A., Ortiz, R., Sánchez, L. & Lalama K. (2000a). Control del ácaro Varroa jacobsoni en abejas melíferas (Apis mellifera) bajo condiciones tropicales. Revista Ciencias Veterinarias, 23, 45-55.
Calderón, R.A., Ortiz, R., Arce, H., Van Veen, J. & Quan, J. (2000b). Effectiveness of formic acid on varroa mortality in capped brood cells of Africanized honey bees. Journal of Apicultural Research, 39, 177-179. https://doi.org/10.1080/00218839.2000.11101039
Calderón, R.A., Fallas, N. & Sánchez, L. (2007). Detección de enfermedades en abejas Africanizadas en Costa Rica. Revista Ciencias Veterinarias, 25, 335-348.
Calderón, R.A. (2011). Reducción de la población de ácaros de varroa en colmenas de abejas Africanizadas utilizando una trampa de fondo. Boletín de Parasitología, 12, 2-4.
Calderón, R.A., Ureña, S. & Van Veen, J.W. (2012). Reproduction of Varroa destructor and offspring mortality in worker and drone brood cells of Africanized honey bees. Experimental and Applied Acarology, 56, 297-307. https://doi.org/10.1007/s10493-012-9518-0
Calderón, R.A., Fallas, N. & Ramírez, M. (2017). Comportamiento del ácaro Varroa destructor en celdas, con cría de obrera, de abejas africanizadas (Apis mellifera). Revista Ciencias Veterinarias, 35(2), 113-129. DOI: http://dx.doi.org/10.15359/rcv.35-2.5
Calderón, R.A. (2019). Comportamiento reproductivo del ácaro Varroa destructor (Mesostigmata: Varroidae) en celdas con cría de obrera y zángano en abejas africanizadas (Apis mellifera) en condiciones tropicales. Revista Ciencias Veterinarias, 37(2), 44-61. https://doi.org/10.15359/rcv.37-2.5
Donzé, G. & Guerin, P. (1994). Behavioral attributes and parental care of varroa mites parasiting honey bee brood. Behavioral Ecology and Sociobiology, 34, 305-319. https://doi.org/10.1007/BF00197001
Eguaras, M., Palacio, M., Faverin, C., Basualdo, M., Del Hoyo, M., Velis, G. & Bedascarrasbure, E. (2003). Efficacy of formic acid in gel for varroa control in Apis mellifera L.: importance of the dispenser position inside the hive. Veterinary Parasitology, 111, 241-245. https://doi.org/10.1016/S0304-4017(02)00377-1
Emsen, B., Guzmán-Novoa, E. & Kelly, P. (2007). The effect of three methods of application on the efficacy of thymol and oxalic acid for the fall control of the honey bee parasitic mite Varroa destructor in a northern climate. Journal of Apicultural Research, 147, 535-539.
Espina, D. & Ordetx, G. (1984). Apicultura Tropical. Tecnológica de Costa Rica, Cartago, CR. 506 p.
Espinosa, L. & Guzmán, E. 2007. Eficacia de dos acaricidas naturales, ácido fórmico y timol, para el control del ácaro Varroa destructor de las abejas (Apis mellifera L.) en Villa Guerrero, Estado de México, MX. Veterinaria México, 38, 9-19.
Guzman-Novoa, E., Vandame, R. & Arechavaleta, M. (1999). Susceptibility of European and Africanized honey bees (Apis mellifera L.) to Varroa jacobsoni Oud. in Mexico. Apidologie, 30, 173-182. https://doi.org/10.1051/apido:19990207
Harbo, J. & Harris, J. (2005). Suppressed mite reproduction explained by the behavior of adult bees. Journal of Apicultural Research, 44, 21-23. https://doi.org/10.1080/00218839.2005.11101141
Ifantidis, M.D. (1997). Ontogenesis of Varroa jacobsoni Oud. In Cahiers Options Méditerranéennes. Varroosis in the Mediterranean region. CIHEAM, Zaragosa. p 13-21.
Junkes, L., Vieira, J., Guerra, J. & Moretto, G. (2007). Varroa destructor mite mortality rate according to the amount of worker brood in Africanized honey bee (Apis mellifera L.) colonies. Acta Scientiarum Biological Sciences, 29, 305-308.
Kanga, L., Adamczyk, J., MarshalL, K. & Cox, R. (2010). Monitoring for resistance to organophosphorus and pyrethroid insecticides in varroa mite populations. Journal of Economic Entomology, 5, 1797-1802. https://doi.org/10.1603/ec10064
Koeniger, N. & Fuchs, S. (1988). Control of Varroa jacobsoni Oud. in honeybee colonies containing sealed brood cells. Apidologie, 19, 117-130. https://doi.org/10.1051/apido:19880202
Liu, F., Xu, X., Zhang, Y., Zhao, H. & Huang, Z.Y.A (2020). Meta-analysis shows that screen bottom boards can significantly reduce Varroa destructor population. Insects, 11(9), 624. https://doi.org/10.3390/insects11090624
Martin, S. (1994). Ontogenesis of the mite Varroa jacobsoni Oud. in worker brood of the honeybee Apis mellifera L. under natural conditions. Experimental and Applied Acarology, 18, 87-100. https://doi.org/10.1.1.212.5262
Martin, S. (1995). Ontogenesis of the mite Varroa jacobsoni Oud. in drone brood of the honeybee Apis mellifera L. under natural conditions. Experimental and Applied Acarology, 19, 199-210. https://doi.org/10.1007/BF00130823
Martin, S., Holland, K. & Murray, M. (1997). Non-reproduction in the honey bee mite Varroa jacobsoni in honey bee (Apis mellifera) colonies. Journal of Apicultural Research, 36, 113-123.
Milani, N. (1995). The resistance of Varroa jacobsoni Oud to pyrethroids: a laboratory assay. Apidologie, 23, 257-272.
Moretto, G., Goncalves, L. & De Jong, D. (1991). Africanized bees are more efficient at removing Varroa jacobsoni, preliminary data. American Bee Journal, 131, 434.
Moretto, G. (1997). Defense of Africanized bee workers against the mite Varroa jacobsoni in Southern Brazil. American Bee Journal, 137, 746-747.
Moretto, G. & Leonidas, J. (1999). Varroa jacobsoni infestation of adult Africanized and Italian honey bees (Apis mellifera) in mixed colonies in Brazil. Genetics and Molecular Biology, 22, 321-323. https://doi.org/10.1590/S1415-47571999000300006
Moretto, G. & Leonidas, J. (2003). Infestation and distribution of the mite Varroa destructor in colonies of Africanized bees. Brazilian Journal of Biology, 63, 83-86. https://doi.org/10.1590/S1519-69842003000100011
Peng, Y.S., Fang, Y., Xu, S. & Ge, L. (1987). The resistance mechanism of the Asian honey bee Apis cerana Fabr. to an ectoparasitic mite, Varroa jacobsoni Oudemans. Journal of Invertebrate Pathology, 49, 54-60. https://doi.org/10.1016/0022-2011(87)90125-X
Pettis, J. & Shimanuki, H. (1999). A hive modification to reduce varroa populations. American Bee Journal, 139, 471-473.
Ritter, W. (1993). Chemical control: options and problems. In Matheson, A (ed) Living with varroa. The International Bee Research Association (IBRA), Cardiff. p 17-24.
Ritter, W. (2001). Enfermedades de las abejas. Acribia, Zaragoza.
Rosenkranz, P. (1999). Honey bee (Apis mellifera L.) tolerance to Varroa jacobsoni Oud. in South America. Apidologie, 30, 159-172. https://doi.org/10.1051/apido:19990206
Spivak, M. (1991). The Africanization process in Costa Rica. Westview Press Inc.
Spivak, M. & Reuter, G. (2001). Varroa destructor infestation in untreated honey bee (Hymenoptera: Apidae) colonies selected for hygienic behavior. Journal of Economic Entomology, 94, 326-331. https://doi.org/10.1603/0022-0493-94.2.326
Szabo, T., Walker, T. & Mueller, A. (1996). Grooming behavior as a varroa resistance characteristic in honey bee colonies. American Bee Journal, 136, 515-517.
Trouiller, J. (1998). Monitoring Varroa jacobsoni resistance to pyrethroids in western Europe. Apidologie, 29, 537-546.
Tsigouri, A., Menkissoglu-Spiroudi, U., Thrasyvoulou, A. & Diamantidis G. (2003). Fluvalinate residues in greek honey and beeswax. Apiacta, 38, 50-53.
Vandame, R. (2000). Control alternativo de varroa en apicultura. El Colegio de la Frontera Sur (ECOSUR). Chiapas. 30 p.
Vandame, R., Morand, S., Colin, M.E. & Belzunces, L.P. (2002). Parasitism in the social bee Apis mellifera: quantifying costs and benefits of behavioural resistance to varroa mites. Apidologie, 33, 433-455. https://doi.org/10.1051/apido:2002025
Wallner, K. (1999). Varroacides and their residues in bee products. Apidologie, 30, 235-248. https://doi.org/10.1051/apido:19990212
Webster, T.C., Thacker, E.M. & Vorisek, F.E. (2000). Live Varroa jacobsoni (Mesostigmata: Varroidae) fallen from honey bee (Hymenoptera: Apidae) colonies. Journal of Economic Entomology, 93(6), 1596-1601. https://doi.org/10.1603/0022-0493-93.6.1596
Anexo 1.
Figura 1. Trampa de fondo utilizada como una alternativa en el control integrado del ácaro V. destructor en colmenas de abejas africanizadas en condiciones tropicales.


Licencia Creative Commons Atribución-No-Comercial