
Rev. Ciencias Veterinarias, Vol. 34, N° 2, [115-127], ISSN: 2215-4507, julio-diciembre, 2016
DOI: http://dx.doi.org/10.15359/rcv.34-2.5
URL: http://www.revistas.una.ac.cr/index.php/veterinaria/index
Rinitis piogranulomatosa asociada a Conidiobolus coronatus en un caballo: reporte de caso.
Pyogranulomatous rhinitis associated to Conidiobolus coronatus in a horse: a case report
Daniel Barrantes-Murillo1, Javier Coen-Alfaro2, Alejandra Calderón3, Andrés Rodríguez-González4, Alejandro Alfaro-Alarcón1.
1 Departamento de Patología, Escuela de Medicina Veterinaria, Universidad Nacional, Costa Rica. danielfelipebarrantesmurillo@gmail.com; alejandro.alfaro.alarcon@una.cr
2 Diagnóstico Albéitar Laboratorio Clínico Veterinario, San José, Costa Rica. javiercoen@diagnosticoalbeitar.com
3 Laboratorio de Micología, Escuela de Medicina Veterinaria, Universidad Nacional, Costa Rica.
4 Hospital Veterinario Intensivet, San José, Costa Rica. arogo18@gmail.com
Autor para correspondencia:
danielfelipebarrantesmurillo@gmail.com; alejandro.alfaro.alarcon@una.cr
Recibido: 3 de Mayo de 2016. Corregido: 20 de Mayo de 2016. Aceptado: 15 de Junio de 2016.
Resumen: Un equino, sin raza definida, hembra, de 6 años de edad, de San Rafael de Alajuela, presentaba disnea y descarga nasal bilateral de aspecto seroso y turbio, asociado a una masa irregular en el septo nasal que obstruía parcialmente las vías respiratorias superiores. Los hallazgos del cultivo, citología e histopatología determinaron que el agente causal de las lesiones era Conidiobolus coronatus. La conidiobolomicosis es una enfermedad subcutánea, piogranulomatosa, sin diseminación sistémica, que afecta la cavidad nasal en equinos. Posterior al debridamiento quirúrgico de la masa, el animal fue tratado con yoduro de sodio intravenoso, por varias semanas. Tres meses después de este procedimiento, no hubo recidiva de la lesión.
Palabras clave: Conidiobolus coronatus, conidiobolomicosis, equino, rinitis piogranulomatosa.
Abstract: A 6-year-old mixed breed female horse from San Rafael, Alajuela, Costa Rica was treated from bilateral turbid and serous nasal discharge related to an irregular mass in the nasal septum that was partially obstructing the upper respiratory tract. Findings related to the mycological culture, cytology and histopathology determined that Conidiobolus coronatus was the underlying infectious agent. Conidiobolomycosis is a pyogranulomatous subcutaneous disease, without systemic spread, that affects the nasal cavity in horses. After surgical debridement of the mass, the animal was treated with intravenous sodium iodide for several weeks. Three months after the procedure no recurrence of the lesion was detected.
Keywords: Conidiobolus coronatus, conidiobolomycosis, equine, pyogranulomatous rhinitis.
Introducción
La Mucormicosis y Entomoftoromicosis son términos referidos a un grupo de infecciones fúngicas poco comunes causadas por especies de hongos Mucorales, los cuales producen micosis sistémicas (Mucor, Rhizopus y Absidia spp.), y los Entomophtorales que están involucrados principalmente en micosis subcutáneas (Conidiobolus y Basidiobolus spp.) (Kwong-Chung 2012; Mendoza et al. 2015).
La Conidiobolomicosis es una enfermedad piogranulomatosa crónica de las vías aéreas superiores, principalmente nasofaringe. Ha sido reportada en: caballos, personas, mulas, venados, llamas, perros, delfines, mandriles, ovejas y chimpancés (Bauer et al. 1997; Stephens & Gibson 1997; Robinson et al. 2007; Silva et al. 2007; Vilela et al. 2010, do Carmo et al. 2013; Ubiali et al. 2013). Es causada por la infección del hongo del género Conidiobolus a nivel de la mucosa y submucosa respiratoria (Schumacher & Schumacher 2007; Mackey et al. 2015), siendo Conidiobolus coronatus, Conidiobolus incongruus y Conidiobolus lamprauges las principales especies involucradas (Robinson et al. 2007). En los caballos, llamas y humanos, la conidiobolomicosis no tiene diseminación sistémica (Bauer et al. 1997; Stephens & Gibson 1997; Robinson et al. 2007; Silva et al. 2007; Vilela et al. 2010, do Carmo et al. 2013; Ubiali et al. 2013).
Conidiobolus coronatus es un hongo saprofítico que se encuentra en el material vegetal en descomposición, el suelo, e insectos (Stephens & Gibson 1997; Steiger & Williams. 2000; Robinson et al. 2007; Schumacher & Schumacher 2007; Cafarchia et al. 2013).
En caballos, las infecciones causadas por Conidiobolus coronatus se localizan en la nasofaringe, con o sin diseminación local hacia los tejidos de la cara, la región retrofaríngea, los senos maxilares, bolsas guturales, tráquea, paladar blando, espacio retrobulbar, o sistema nervioso central (Miller & Campbell 1984; Steiger & Williams 2000; Robinson et al. 2007; Schwarz et al. 2009; Cafarchia et al. 2013; Mackey et al. 2015).
La infección causada por Conidiobolus coronatus ocurre en climas tropicales y subtropicales; se ha reportado en el sur de los Estados Unidos (Texas y Florida), Colombia, Costa Rica, Brasil, Australia, India e Indonesia (Mendoza 1984; Miller & Campbell 1984; Mendoza & Alfaro 1985; French & Ashworth 1994; Steiger & Williams 2000; Robinson et al. 2007; Silva et al. 2007; Cafarchia et al. 2013; Mackey et al. 2015).
Los signos clínicos más comunes de la enfermedad son las descargas nasales mucopurulentas, sanguinolentas, y la presencia de granulomas en la cavidad nasal (Schumacher & Schumacher 2007).
Aun no se conoce el mecanismo de la transmisión de Conidiobolus; sin embargo, se ha relacionado con la exposición directa de la mucosa nasal con las esporas infectantes, con o sin daño del epitelio nasal, la deposición mecánica por medio de insectos y trauma (Bauer et al. 1997; Robinson et al. 2007; Cafarchia et al. 2013). La estabulación prolongada en una cama húmeda, pastoreo, infecciones bacterianas y virales respiratorias pueden predisponer a los animales a desarrollar la enfermedad (Robinson et al. 2007).
Los diagnósticos diferenciales de conidiobolomicosis incluyen: tejido de granulación exuberante, granulomas bacterianos, habronemiasis, sarcoide, hematoma etmoidal, fibrosarcoma, carcinoma de las células escamosas, otras neoplasias nasales y granulomas causados por otros hongos que afectan la mucosa nasal como: Rhinosporidium seeberi, Cryptococcus neoformans y Coccidioides immitis (Dowling et al. 1999; Berrocal & López 2007; Schumacher & Schumacher 2007).
El diagnóstico definitivo de conidiobolomicosis requiere la identificación histopatológica del agente, citologías y el cultivo del material colectado de las lesiones, en Agar Sabouraud, Agar Papa Dextrosado y Agar de Harina de Maíz (Dowling et al. 1999; Steiger & Williams. 2000; Robinson et al. 2007; Vilela et al. 2010; Hart & Sullins 2011). También, se puede utilizar técnicas de Inmuniohistoquímica, PCR, e Inmunodifusión (Cafarchia et al. 2013; Ubiali et al. 2013).
El tratamiento elegido es la remoción quirúrgica. Muchos antifúngicos han sido utilizados en conjunto con la cirugía con tasas de éxito variables, entre ellos: la anfotericina B tópica, ketoconazol, itraconazol, yoduro de sodio intravenoso, yoduro de potasio oral y yoduros orgánicos (Dowling et al. 1999; Steiger & Williams 2000; Schumacher & Schumacher 2007; Schwarz et al. 2009; Cafarchia et al. 2013; Mackey et al. 2015). Sin embargo, la recurrencia de la lesión es frecuente y puede requerir un tratamiento médico prolongado (Robinson et al. 2007).
Reporte de caso
Un equino, hembra, sin raza definida, de 10 años, procedente de San Rafael de Alajuela, con secreción nasal, fue atendido en un centro privado (Hospital Veterinario Intensivet). Durante el examen físico, se determinó una baja condición corporal (1/5), con un peso estimado de 200 Kg, severa dificultad respiratoria, secreción nasal bilateral de aspecto seroso sanguinolento y una masa irregular de tejido granulomatoso en el septo nasal (Figura 1). No se identificó lesiones granulomatosas en ninguna otra localización durante la evaluación física completa. Los demás parámetros fisiológicos se encontraban en un rango normal.
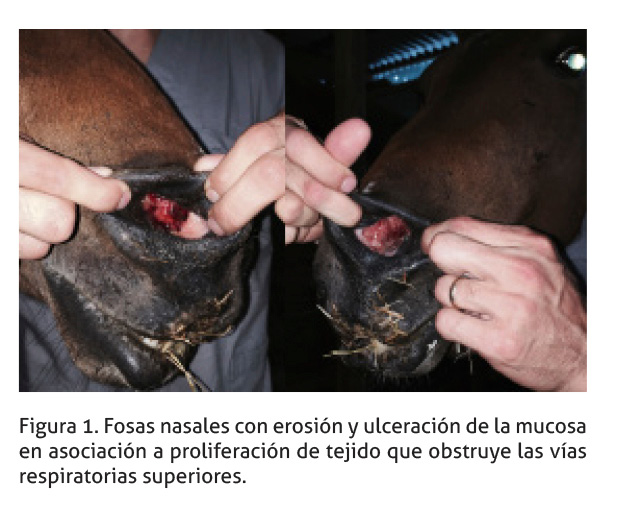
Se realizó una remoción parcial del septo nasal. Previamente se practicó una traqueostomía temporal. El procedimiento se realizó con sedación profunda; se utilizó de xilacina (1.1mg/kg IV) y morfina (0.15mg/kg IV) en infusión continua y bloqueo del nervio maxilar bilateral con lidocaína clorhidrato al 2%.
Análisis citológico
El análisis inicial de la lesión, se realizó a partir de una citología de la cavidad nasal, evaluada en un centro diagnóstico clínico privado (Diagnóstico Albéitar). Se realizó aspirados por aguja fina de las masas en ambas fosas nasales. El análisis de los extendidos reveló la presencia de hifas no septadas, tortuosas, con bifurcaciones e inflamación compuesta de neutrófilos degenerados y eosinófilos (Figuras 2 y 3), así como bacterias extracelulares tipo cocos. Los hallazgos son compatibles con una inflamación fúngica supurativa con presencia de eosinófilos (Rodríguez 1998).
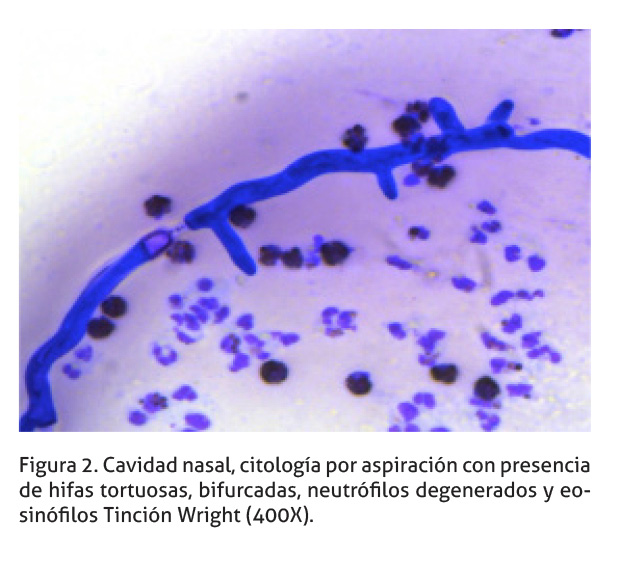
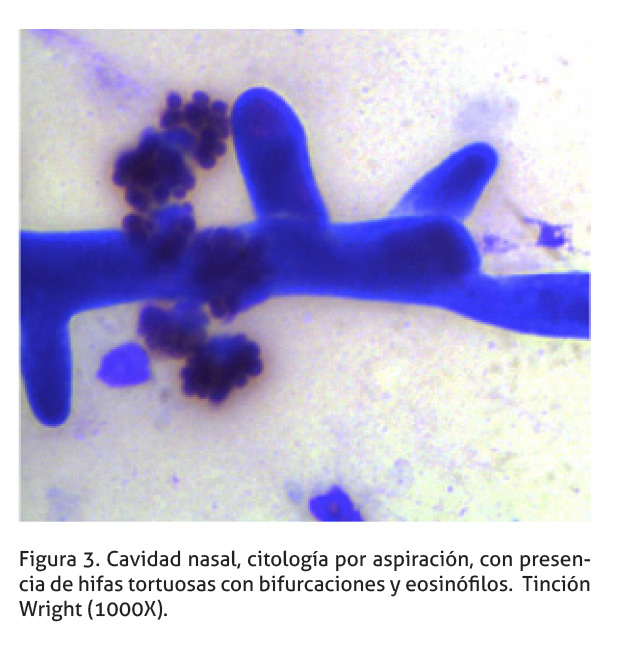
Cultivo micológico
Para el cultivo micológico, se procesó un segmento del septo nasal removido, en el laboratorio de micología de la Universidad Nacional. Se realizó tres cultivos: el primero en Agar Sabouraud Dextrosa (SDA) a 35 °C; el segundo en Agar Sabouraud Dextrosa (SDA) a 28 °C; el tercero en Agar Mycosel a 28 °C con tres porciones de tejido en cada medio de cultivo. Se realizó un examen microscópico directo con hidróxido de potasio (KOH) al 40 %, con el fin de observar estructuras fúngicas; sin embargo, el resultado fue negativo.
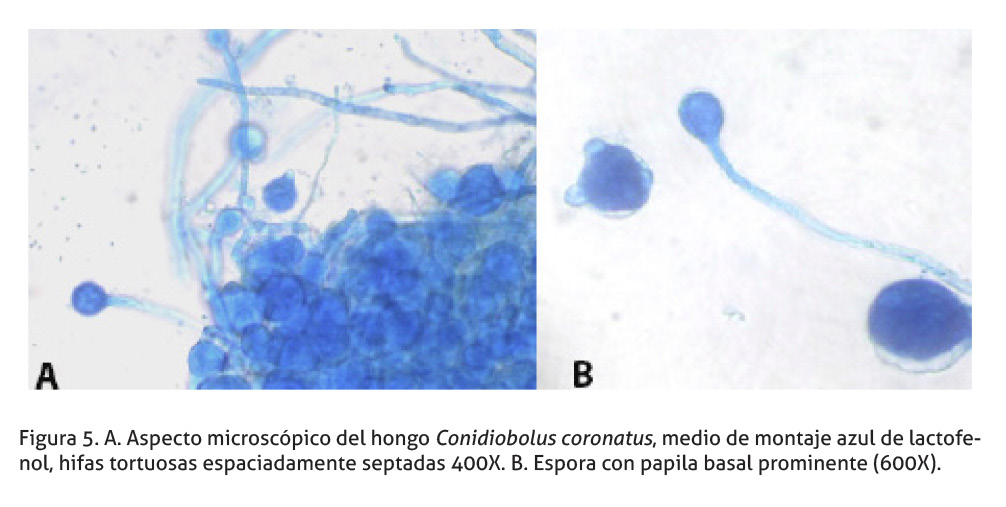
A las 72 horas hubo crecimiento en cada una de las porciones de tejido cultivadas en los tres agares de colonias de un hongo hialino pulverulento en el anverso (Figura 4) e hialino con pigmento amarillo en el reverso. También, se notó la presencia de esporas fúngicas adheridas a la tapa de la placa de Petri. Se tomó una porción del hongo con un asa micológica esterilizada y se colocó en un portaobjetos con una gota de azul de lactofenol, para realizar la identificación microscópica de la colonia, en la cual se observó hifas, espaciadamente septadas, tortuosas (Figura 5A) y presencia de esporas con una papila basal piriforme prominente (Figura 5B). Una de ellas tenía vellosidades. Estas características permitieron la identificación del agente como Conidiobolus coronatus (De Hoog et al. 2002; Larone 2011).

Estudio Histopatológico
Un segmento del septo nasal fue fijado en formalina buferada al 10 % y procesado de forma rutinaria para su análisis histopatológico en el Laboratorio de Patología de la Universidad nacional (Miller 2016). La biopsia tenía dimensiones de 6 cm de largo por 4 cm de ancho y 3 cm de profundidad, el epitelio nasal estaba erosionado y ulcerado, con engrosamiento irregular de la submucosa. Al corte, tenía una consistencia elástica, de color café claro y aspecto irregular, en su parte central el cartílago no presentaba alteraciones (Figura 6).

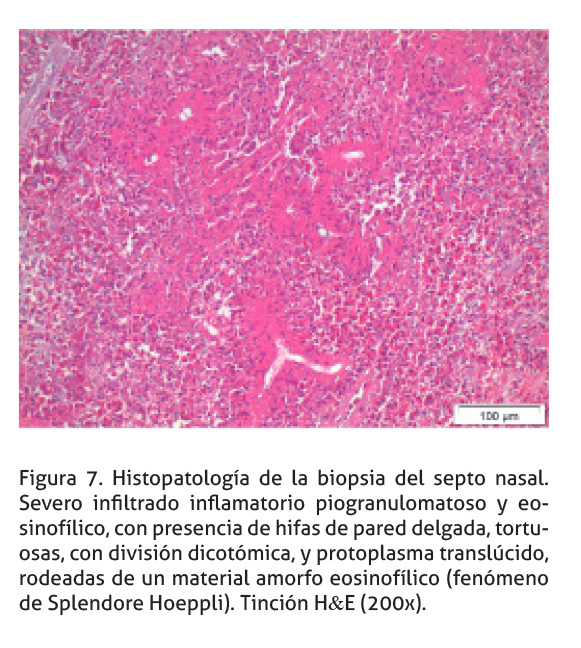
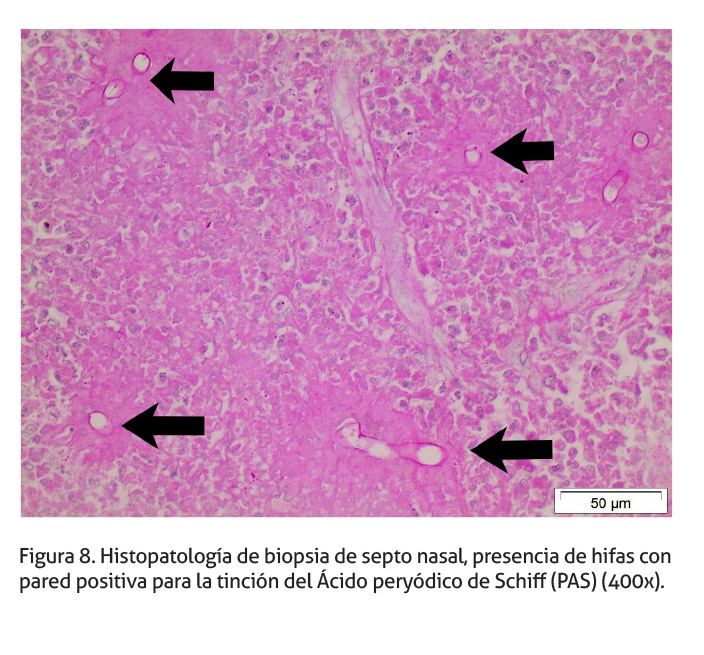
Histopatológicamente, la mucosa nasal se encuentra multifocalmente ulcerada con necrosis de coagulación e inflamación supurativa secundaria. En la submucosa, hay un infiltrado predominantemente piogranulomatoso, compuesto por macrófagos de tipo epitelioide, células gigantes de hasta 4 núcleos tipo Langhans, neutrófilos degenerados y abundantes eosinófilos, en menor grado hay linfocitos y células plasmáticas. El infiltrado inflamatorio se encuentra entremezclado con la proliferación de tejido de granulación. Multifocalmente, en el tejido de granulación hay áreas de agregados de eosinófilos degranulados alrededor de un material necrótico, eosinofílico y amorfo (Splendore-Hoeppli); centralmente hay múltiples estructuras fúngicas, que consisten en hifas de protoplasma tanslúcido, espaciadamente septadas, tortuosas, con división dicotómica, de pared delgada y de 15 cm de grosor, aproximadamente (Figura 7). La pared celular de las estructuras fúngicas se tiñen de forma positiva con la Tinción del Ácido Peryódico de Schiff (PAS) (Figura 8) y la Tinción Plata metanamina de Grocott (Figura 9).

Durante el período postquirúrgico se administró 50 mL de yoduro de sodio al 20% intravenoso, SID, por tres días; luego una aplicación cada 15 días, dos dosis.
Después de la cirugía, se notó una mejoría en la respiración del paciente, comenzó a ganar peso, y cesó la secreción nasal y los ronquidos respiratorios. La última revisión se realizó ٣ meses después de la cirugía; no se notó recidiva de la lesión. Después, el animal fue vendido a otra finca y no se continuó el seguimiento.
Discusión
La conidiobolomicosis es una enfermedad fúngica piogranulomatosa reportada en muchas especies. La transmisión es desconocida. Sin embargo, se asocia al trauma (Bauer et al.1997; Robinson et al. 2007; Schumacher & Schumacher 2007; Silva et al. 2007; Cafarchia et al. 2013), el paciente es un animal de finca y se desconoce si hubo historia previa de trauma nasal. No hay estudios en los cuales se reporte la predisposición de género o edad de los animales infectados (Bauer et al.1997; Robinson et al. 2007; Schumacher & Schumacher 2007; Silva et al. 2007; Cafarchia et al. 2013). En Costa Rica, el primer reporte de la infección localizada en el tejido subcutáneo nasal de un equino fue hecho por Martín Garita, en 1980, aisló Conidiobolus coronatus de un equino (Mendoza 1984).
Los signos clínicos reportados incluyen descargas nasales bilaterales sanguinolentas, o mucopurulentas, múltiples masas granulomatosas, hinchazón de la cara y oclusión de la cavidad nasal provocando disnea (Robinson et al. 2007; Schumacher & Schumacher 2007). Además, la conidiobolomicosis comienza como una infección de la submucosa, que se expande hacia el tejido subcutáneo de la piel de la cara, incluyendo la nariz, las bolsas guturales, la faringe, el paladar blando, la tráquea , el espacio retrobulbar, el labio superior, los senos nasales, linfonodos regionales y cerebro (French & Ashworth 1994; Konerek et al. 1994; Bauer et al. 1997; Robinson et al. 2007; Cafarchia et al. 2013; Ubiali et al. 2013; Mackey et al. 2015). En el caso reportado, sólo se observó la descarga nasal bilateral, la lesión granulomatosa sobre el septo nasal sin involucramiento de otra estructura anatómica.
El hongo aislado en el cultivo posee características de Conidiobolus spp., un micelio espaciadamente septado, con la producción de esporangiosporas (conidias) con una papila basal o conidia secundaria en forma de barril, por la reproducción asexual. Las conidias con vellosidades son una característica exclusiva de Conidiobolus coronatus que permite diferenciarlo de otros organismos causantes de infecciones en caballos como: Conidiobolus lamprauges, Conidiobolus incongruus, Basidiobolus ranarum y Basidiobolus haptosporum (French & Ashworth 1994; Bauer et al. 1997; Steiger & Willimas 2000; Robinson et al. 2007; Silva et al. 2007; Vilela et al. 2010). Las vellosidades de las conidias fueron evidenciadas en la evaluación microscópica del cultivo micológico.
Las lesiones histopatológicas (rinitis piogranulomatosa con presencia de eosinófilos, e hifas embebidas en un material eosinofìlico), son compatibles con una infección micótica entomophtoral, (Miller & Campbell 1984; French & Ashworth 1994; Bauer et al. 1997; Stephens & Gibson 1997; Steiger & Williams 2000; Robinson et al. 2007; Schumacher & Schumacher 2007; Silva et al. 2007; Vilela et al. 2010; Ubiali et al. 2013). El fenómeno de Splendore Hoeppli ha sido descrito en una gran variedad de infecciones fúngicas, parasíticas, bacterianas, y en granulomas ocasionados por un cuerpo extraño. Los depósitos eosinofílicos se componen de una mezcla de mitocondrias, lisosomas, fibrina, colágeno, complejos antígeno-anticuerpo, al igual que organelas degeneradas y gránulos eosinofílicos de los eosinófilos degranulados (Steiger & Williams 2000). La falta de angioinvasión, diseminación vascular y cerebral son una característica de Conidiobolus spp. (Bauer et al. 1997). Si bien el fenómeno de Splendore Hoeppli no es exclusivo de una conidiobolomicosis, su presencia es una característica de la infección. Las hifas de Conidiobolus spp. son reconocidas mediante el uso de tinciones especiales como (PAS y Grocott), (Miller & Campbell 1984; French & Ashworth 1994; Stephens & Gibson 1997; Steiger & Williams 2000; Robinson et al. 2007; Silva et al. 2007; Ubiali et al. 2013). En el caso reportado, las estructuras fúngicas son apreciables tanto en la tinción H&E como en las tinciones de PAS y Grocott.
El tratamiento de elección, en caballos, incluye la remoción quirúrgica de la lesión, administración parenteral y oral de yoduros inorgánicos y orgánicos, itraconazol, y terapia tópica con Anfotericina B, penincilina, y dimetilsulfóxido (DMSO) (Mendoza & Alfaro 1985; Konerek et al. 1994; Steiger & Williams 2000; Schumacher & Schumacher 2007; Mackey et al. 2015). Sin embargo, las especies de Conidiobolus spp. son menos responsivas al tratamiento médico (Konerek et al. 1994).
El tratamiento con yodo es el más utilizado debido a su bajo costo y fácil administración; sin embargo, su mecanismo de acción se desconoce (Steiger & Williams 2000; Robinson et al. 2007; Schumacher & Schumacher 2007; Schwartz et al. 2009). El yoduro de sodio se administra de forma oral (20-35mg/kg) o intravenosa. También, se puede utilizar de forma parenteral, 20-40mg/kg, intravenoso cada 24 horas durante 7 a 14 días (Grooters 2014). En este caso, debido a la mejoría de los signos clínicos y por disposición del propietario, el tratamiento con yoduro de sodio intravenoso se limitó a 1 dosis diaria durante 3 días; luego dos dosis en intervalos de 15 días. Sin embargo, el tratamiento con yodo debe continuarse aún un mes después de la regresión de los signos clínicos (Bourdeau 2009; Costa 2011). En un reporte de caso, la administración oral de yoduro inorgánico se mantuvo durante 1 año (Steiger & Williams 2000).
En un estudio realizado en Costa Rica, el tratamiento de elección fue la remoción quirúrgica de las lesiones tempranas, con la administración de yoduro de sodio. Los resultados fueran variables. La anfotericina B no se utilizó en ninguno de los casos, debido a que el fármaco y la atención diaria de los caballos implicaba un costo muy elevado (Mendoza & Alfaro 1985). Una vez iniciada la utilización de yodo y yoduro de potasio, se tiende a desmejorar el efecto de la anfotericina B (Schumacher & Schumacher 2007).El tratamiento sistémico, con Anfotericina B, es costoso, nefrotóxico, puede ocasionar efectos secundarios como urticaria, fiebre, anorexia, anemia, y anafilaxis; por lo cual, se ha utilizado de forma tópica en conjunto con el DMSO (Dowling et al 1999; Steiger & Williams 2000). Debido a esto, la anfotericina B no fue considerada como una opción terapéutica en este caso.
La recurrencia local en el sitio de resección quirúrgica es común, por lo cual se recomienda la continuación de la terapia médica antifúngica después de la cirugía (Robinson et al. 2007; Mackey et al. 2015); después de la remoción parcial del septo nasal. En los 3 meses siguientes, el paciente no tuvo regresión de la lesión; sin embargo, la recurrencia de la infección se ha reportado hasta 17 meses después de la cirugía (Robinson et al. 2007). No obstante, el animal fue vendido a otra finca, por lo que se descontinuó su seguimiento.
La conidiobolomicosis ha sido reportada en humanos inmunocomprometidos (Robinson et al. 2007). En caballos, a diferencia de los humanos, la enfermedad no está relacionada con inmunodeficiencia (Schumacher & Schumacher 2007; Costa 2011).
Conclusiones
La conidiobolomicosis es una infección fúngica no diseminada, que afecta a muchas especies animales. Caballos inmunológicamente competentes son capaces de desarrollar la infección y el diagnóstico debe hacerse en el laboratorio (cultivo micológico, histopatología). Los hallazgos histopatológicos no son diagnósticos, pero sí muy característicos de la lesión. El pronóstico de esta enfermedad es reservado debido a la gran variación en la respuesta al tratamiento y su duración. El desbridamiento quirúrgico agresivo mejora el pronóstico del paciente, pero debe instaurarse una terapia médica a largo plazo, con revisiones periódicas del animal.
Referencias
Bauer, R.W., Lemarié, S.L. & Roy, A.F. 1997. Case Report Oral conidiobolomicosis in a Dog. Veterinary Dermatology. 8: 115-120.
Berrocal, A. & López, A. 2007. Nasal rhinosporidiosis in a mule. Can Vet J. 48: 305–306.
Bourdeau, P. 2009. Dermatomycoses, Subcutaneous In: Lavoie, J.P. & Hinchcliff, K. (2nd Ed). Blackwell`s Five Minute Veterinary Consult: Equine. Blackwell Publishing, USA, p. 1659-1674.
Hartshorn, G.S. 1983. Plants. In: Janzen, D.H. (Ed.). Costa Rican Natural History. University of Chicago Press, Chicago, p. 118–157.
Cafarchia, C., Figueredo, L.A. & Domenico, O. 2013. Fungal Diseases in Horses. Vet. Microb. 167: 215-234. doi: 10.1016/j.vetmic.2013.01.015.
Costa, L.R.R. 2011. Zygomycosis in: Wilson, D.A. Clinical Veterinary Advisor: The Horse. Elsevier Saunders, USA, p. 657-659.
De Hoog G.S, Guarro J., Gené J. & Figueras M.J. 2000. Conidiobolus coronatus (Cost.) Batko. In: Atlas of Clinical fungi. (2nd Ed). Utrecht: Centraalbureau voor Schimmelcultures. pp. 119-120.
do Carmo, P.M.S., Portela, R.A., de Oliveira-Filho, J.C., Dantas, A.F.M., Simoes, S.V.D., Garino, F. Jr. & Riet-Correa, F. 2013. Nasal and Cutaneous Aspergillosis in a Goat. J. Comp. Path.150 (1): 1-4. doi: 10.1016/j.jcpa.2013.06.007.
Dowling, B.A., Dart, A.J., Kessell, A.E., Pascoe, R.R. & Hodgson, D.R. 1999.Cutaneous phycomycosis in two horses. Aust. Vet. J. 77 (12): 780-783.
French, R.A. & Ashworth, C.D. 1994. Zygomicosis Caused by Conidiobolus coronatus in a Llama (Lama glama). Vet. Path. 31: 120-122.
Grooters, A.M. 2014. Pythiosis and Zygomycosis In: Equine Infectious Diseases. (2nd ed). Saunders Elsevier, USA. p.415-421.
Hart, S.K. & Sullins, K.E.2010. Evaluation of a novel postoperative treatment of sinonasal disease in the horse (1996-2007). Equin. Vet. J. 43 (1): 24-29. doi: 10.1111/j.2042-3306.2010.00133.x.
Konerek, N.L., Legendre, A.M., Andrews, F.M., Blackford, J.T., Wan, P.Y., Breider, M.A. & Rinaldi, M.G. 1994. Treatment of Mycotic Rhinitis with Itraconazole in Three Horses. J. Vet. Intern. Med. 8 (3): 224-227.
Kwon-Chung, K.J. 2012. Taxonomy of Fungi Causing Mucormycosis and Entomophtoramycosis (Zygomycosis) and Nomenclature of the Disease: Molecular Mycologic Perspectives. Clin. Infec. Dis. 54(1): 8-15. DOI: 10.1093/cid/cir864.
Larone D.H. 2011. Conidiobolus coronatus In: Medically Important Fungi. A guide to identification. 5th Ed. ASM Press: Washington DC, USA. p.188.
Mackey, P.E., Cappe, K.G., Mani, R., Rothenburg, L., Sutton, D.A., Wiederhold, N.P., Lindner, J., Ramachandran, A., Wall, C.R. & Snider, T. 2015. Disseminated Condiobolus incongruous in a dog: A case report and literature review. Med. Myc. Cas. Rep. 8: 24-28. doi: 10.1016/j.mmcr.2015.02.005.
Mendoza, L. 1984. Ficomicosis in: Figueroa, M. Enfermedades infecciosas de los animales domésticos en Centroamérica. EUNED, Costa Rica, p. 542-545.
Mendoza L, & Alfaro, A. 1985. Equine Subcutaneous Zygomycosis in Costa Rica: Subkutane Zygomykose bei Pferden in Costa Rica. Mycoses. 28 (11): 545–549. DOI: 10.1111/j.1439-0507.1985.tb02084.x
Mendoza, L., Vilela, R., Voelz, K., Ibrahim, A.S., Voigt, K. & Chan-Lee, S. 2015. Human Fungal Pathogens of Mucorales and Entomophthorales in: Casadevall, A., Mitchell, A.P., Berman, J., Kwon-Chung, K.J., Perfect, J.R. & Heitman, J. Human Fungal Pathogens. Cold Spring Harbor, New York; Perspective in Medicine, p.483-515.
Miller, R.I. & Campbell, R.S.F. 1984. The Comparative Pathology of Equine Cutaneous Phycomycosis. Vet. Path. 21: 325-332.
Miller, M. 2016. Introduction to the Diagnostic Process in: Maxie, G. (6th Ed.). Jubb, Kennedy & Palmer’s Pathology of Domestic Animals, Volume 1. Saunders Elsevier. China. p. 1-15.
Robinson, C.S., Robertson, J.T., Reed, S.M. & Pinchbeck, L.R.2007. Case Report: Treatment of a mare for Conidiobolus coronatus infection. Equine Vet. Educ. 19 (8): 396-403. doi: 10.2746/095777307X220452.
Rodríguez, J. 1998. Micología Médica. Editorial Universidad de Costa Rica, San José. p. 280-283.
Schumacher, J. & Schumacher, J. 2007. Clinical Comentary: Conidioblomycosis. Equine. Vet. Educ. 19 (8): 405-406. doi: 10.2746/095777307X233566.
Schwarz, B., Burford, J. & Knottenbelt, D. 2009. Cutaneous fungal granuloma in a horse. Journal Compilation ESVD and ACVD. 20: 131-134. DOI: 10.1111/j.1365-3164.2008.00719.x.
Silva, S.M.M.S., Castro, R.S., Costa, F.A.L., Vasconcelos, A.C., Batista, M.C.S., Riet-Correa, F. & Carvalho, E.M.S. 2007. Conidiobolomycosis in Sheep in Brazil. Vet. Path. 44: 314-319.
Steiger, R.R. & Williams, M.A. 2000. Granulomatous Tracheitis Caused by Conidiobolus coronatus in a Horse. J. Vet. Intern. Med. 14: 311-314.
Stephens, C.P. & Gibson, J.A. 1997. Disseminated zygomycosis caused by Conidiobolus incongruus in a deer. Aust. Vet. J. 75 (5): 358-359.
Ubiali, D.G., Cruz, R.A.S., De Paula, D.A.J., Silva, M.C., Mendonça, F.S., Dutra, V., Nakazato, L., Colodel, E.M. & Pescador, C.A. 2013. Pathology of Nasal Infection Caused by Conidiobolus lamprauges and Pythium insidiosum in Sheep. J. Comp. Path. 149: 137-145. doi: 10.1016/j.jcpa.2012.12.002.
Vilela, R., Silva, S.M.S., Riet-Correa, F., Dominguez, E. & Mendoza, L. 2010. Morphologic and Phylogenetic Characterization of Conidiobolus lamprauges Recovered from Infected Sheep. J. of Clinic. Microb. 48 (2): 427-432. doi: 10.1128/JCM.01589-09.

Artículo por Revista Ciencias Veterinarias se distribuye bajo una Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 Costa Rica License.
Basada en una obra en http://www.revistas.una.ac.cr/index.php/veterinaria/index.
Permisos que vayan más allá de lo cubierto por esta licencia pueden encontrarse en ciencias.veterinarias.cr@una.cr.