
Rev. Ciencias Veterinarias, Vol. 35, N° 1, [43-57], ISSN: 2215-4507, enero-junio, 2017
DOI: http://dx.doi.org/10.15359/rcv.35-1.3
URL: http://www.revistas.una.ac.cr/index.php/veterinaria/index
Determinación, in vitro, de la eficacia de los hongos entomopatógenos, Beauveria bassiana y Metarhizium anisopliae, en el control de la garrapata común del ganado Rhipicephalus (Boophilus) microplus (Acari: Ixodidae)
In vitro determination of the effectiveness of entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae to control cattle tick Rhipicephalus (Boophilus) microplus (Acari: Ixodidae)
Victor Álvarez1, Teresita Matamoros-Carvajal2, Ana Laura Mena-Marín2
1 SENASA. Dirección de Medicamentos Veterinarios. Pruebas de Eficacia Biológica de los Acaricidas. E-mail: viacal@racsa.co.cr
2 Laboratorio Biomaca. E-mail: biomacacr@gmail.com|
E-mail: viacal@racsa.co.cr
Recibido: 21 de octubre de 2015. Corregido: 31 de mayo de 2017. Aceptado: 7 de junio de 2017.
Resumen: A partir de infestaciones artificiales, en establo, de terneros Bos taurus x Bos taurus, para obtener teleoginas suficientes de Rhipicephalus microplus, se llevó a cabo aspersiones, in vitro, de éstas con cepas de los hongos entomopatógenos Metarhizium anisopliae y Beauveria bassiana para determinar su patogenicidad y el eventual uso en programas de control. Se cultivó, en laboratorio, dos cepas de M. anisopliae y una de B. bassiana. Para las aspersiones se utilizó diferentes concentraciones en conidias por mililitro. Como indicadores, se midió el porcentaje de mortalidad y el de inhibición de la oviposición. Se encontró que las cepas, BM-BL04 y BM-MSG06, lograron controlar la población de adultas en más de un 96%. La mezcla, entre las cepas BM-MSG06 y BM-BL04, en ambas dosis redujo la oviposición de las hembras casi en un 100% en ambos casos, seguidas de la cepa BM-MSG06 y la BM-BL04 aplicadas de forma individual. Al realizar el análisis estadístico, (p< 0.05), de los datos, todas las cepas obtuvieron diferencias significativas al compararlas con el control. En cuanto al porcentaje de eclosión, analizado en el ensayo adicional, es la cepa BM-MSG06, la cual logró inhibir más la eclosión de los huevos de las teleóginas, seguida de la mezcla de estas cepas y la cepa BM-BL04.
Palabras clave: Rhipicephalus microplus, Metarhizium anisopliae, Beauveria bassiana, control integrado de garrapatas, hongos entomopatógenos.
Abstract: Using in stable artificial infestations of Bos taurus x Bos taurus calves to obtain sufficient engorged female ticks from Rhipicephalus microplus, in vitro assays were performed with strains of entomopathogenic fungi Metarhizium anisopliae and Beauveria bassiana to determine their pathogenicity and eventual use in control programs. Two strains of M. anisopliae and one of B. bassiana were cultured in the laboratory. Different conidial concentrations per milliliter were used for the assay. As indicators, the percentages of mortality and inhibition of oviposition were measured. BM-BL04 and BM-MSG06 strains were able to control the female adult population by over 96%. The combination of the BM-MSG06 and BM-BL04 strains decreased female oviposition by almost 100% in both cases, followed by the same strains, but applied individually. When performing the statistical analysis of the data (p <0.05), all strains obtained significant differences when compared to the control group. Regarding the hatching percentage analyzed in the additional assay, the BM-MSG06 strain successfully inhibited egg hatching of the engorged female, followed by the combination of these strains and then by the BM-BL04 strain.
Keywords: Rhipicephalus microplus, Metarhizium anisopliae, Beauveria bassiana, integrated tick control, entomopathogenic fungi.
Introducción
Rhipicephalus microplus (Boophilus) (Canestrini 1886), la garrapata común del ganado bovino es, por mucho, la garrapata más importante de la ganadería costarricense, tanto por su distribución como por el impacto y cantidad (MAG-BCIE-FAO 1980; Álvarez 1999).
Desde mediados del siglo veinte, alrededor del mundo tropical y subtropical, esta garrapata ha sido controlada, casi de forma exclusiva, por medios químicos, dadas las diferentes facilidades que el método presentaba (Nari 1990; Jonsson & Piper 2007). Para ello, se han empleado diferentes moléculas, iniciando con los organoclorinados, siguiendo con organofosforados, carbamatos, piretroides sintéticos, amitraz, lactonas macrocíclicas, fipronil e inhibidores de desarrollo (fluazuron). Como resultado de la aplicación de estas moléculas, en los estudios realizados, se ha observado el fenómeno conocido como resistencia; en el cual, muchas de las moléculas han perdido completamente su efecto, con la consecuente afectación negativa de los programas de control implementados por los productores pecuarios (Furlong 1999; Soberanes et al. 2002; Álvarez & Hernández 2010).
Al lado de la problemática de la resistencia y la ausencia de investigación para el desarrollo de nuevas sustancias, en el control químico exclusivo, se han identificado otras fallas importantes, vinculadas a la salud pública, como los residuos en los productos y subproductos de origen animal (carne, leche y derivados de ambos) y al ambiente, como la afectación de organismos no blanco y contaminación de fuentes de agua, entre otros (Prado et al. 1998; Jonsson & Piper 2007).
Diferentes investigadores han contemplado la necesidad del cambio de ese paradigma. Para ello, han indicado la posibilidad de contar, junto con el control químico, de otras herramientas o metodologías que permitan un combate eficaz de este parásito, sin los efectos negativos contraídos por el uso de un único método (Anónimo, 2004; Jonsson & Piper 2007).
Al seguir esa línea de control, al igual que en la agricultura, en la cual se ha desarrollado con mayor fortaleza; otra opción, que se viene discutiendo desde hace algunos años, es la del control integrado, la cual implica utilizar, de forma racional, todos los medios disponibles como: el manejo, tanto del hato como de los potreros y la incorporación de métodos de control químico, inmunológico y biológico, al tener en cuenta que no debe ser visto como una receta general para ser aplicado de igual forma en todos los casos, sino que deben ser evaluadas las condiciones ecológicas, de situación real y socio culturales presentes (Cardozo 2007).
Precisamente, una de las acciones, en la cual se han llevado a cabo investigaciones para el control de garrapatas, ha sido el uso de hongos entomopatógenos, los cuales han demostrado niveles importantes de efectividad sobre diversos estadios de desarrollo (Monteiro et al. 1998a; Monteiro et al. 1998b; Arguedas et al. 2008).
En este estudio, se presenta los resultados de un trabajo preliminar realizado, in vitro, con los hongos M. anisopliae y Beauveria bassiana, como primer paso para la liberación de pruebas, en campo, con esos hongos.
Materiales y Métodos
El estudio consistió en infecciones experimentales de garrapatas R. microplus con hongos entomopatógenos en las instalaciones de Laboratorio Biomaca, ubicado en Ciudad Colón.
Garrapatas: La cepa de garrapatas, utilizada en este ensayo fue proporcionada por el Laboratorio de Garrapatas del Servicio Nacional de Salud Animal (SENASA); originalmente proviene de México. Es una cepa susceptible a las diferentes moléculas químicas utilizadas en el control sistemático de garrapatas.
Cepas de hongos entomopatógenos: Las cepas de hongos utilizadas forman parte de la colección del Laboratorio Biomaca, seguidamente, se detalla su codificación.
1. Metarhizium anisopliae, cepa BM-MSG06. Este hongo fue purificado y activado, in vitro, en garrapatas, al conservarlo en medio de cultivo enriquecido con quitina, proveniente de garrapatas R. microplus.
2. Metarhizium anisopliae, cepa BM-MJ04. Hongo purificado y conservado en laboratorio en medio papa dextrosa acidificado.
3. Beauveria bassiana, cepa BM-BL04. Hongo aislado y purificado conservado en medio acidificado papa dextrosa.
Tratamientos utilizados:
Se realizó un conteo de conidias en cada una de las cepas en estudio. Se preparó dos dosis de inoculación para evaluar cada cepa individualmente y una mezcla de las cepas BM-MSG06 y BM-BL04. Las dosis utilizadas son:
Dosis 1:
BM-MSG06: 1.6 x 107 conidias/ml
BM-MJ04: 9.5 x 106 conidias/ml
BM-BL04: 2.5 x 107 conidias/ml
Mix BM-MSG06 y BM-BL04 en proporción 1:1
Dosis 2:
BM-MSG06: 3.2 x 107 conidias/ml
BM-MJ04: 1.9 x 107 conidias/ml
BM- BL04: 5 x 107 conidias/ml
Mix BM-MSG06 y BM-BL04, en proporción 1:1
Control: Agua destilada estéril
Infección experimental:
Las garrapatas fueron pesadas y colocadas en placas petri, con papel filtro estéril, en 20 grupos de 20 garrapatas para cada tratamiento. Cada grupo de garrapatas pesadas, se mantuvo en un rango de peso de ±20 mg., dentro de cada grupo experimental; fueron rociadas, en las dosis indicadas, con aspersores independientes para cada tratamiento. Transcurridos tres días, pos inoculación, se inició el conteo de garrapatas muertas. Se continuó el conteo de día por medio y se realizó en total seis revisiones.
Inhibición de la oviposición de las teleóginas:
Transcurridos 13 días, pos infección, se pesó los huevos totales, tanto del grupo control como de las hembras tratadas. Se determinó el porcentaje de inhibición de la oviposición a través de la siguiente fórmula (FAO-SENASICA-CENAPA):
% I.O = (PQLt/PQLT – PHLt/PHLT) x 100
Donde:
PQLt = Peso de hembras de lote tratado.
PQLT = Peso de hembras del lote testigo.
PHLt = Peso de huevos del lote tratado
PHLT = Peso de huevos del lote testigo.
Ensayo para evaluar el porcentaje de eclosión de huevos en R. microplus:
Como un ensayo adicional, en viales estériles, se pesó 0.5 g de huevos de R. microplus y se preparó las diluciones con las cepas de estudio que presentaron un mayor porcentaje de mortalidad:
1. BM-MSG06: 1.6 x 107 conidias/ml
2. BM-BL04: 2.5 x 107 conidias/ml
3. Mix BM-MSG06 y BM-BL04 en proporción 1:1
4. Control con agua destilada estéril.
En cada vial, se aplicó 1 ml de solución de esporas. Se realizó 12 repeticiones por tratamiento. Se incubó a 28 °C y, una vez ocurrida la eclosión de los huevos, los viales fueron sometidos, a una temperatura de 45 °C, en una incubadora, durante tres días, para matar por calor las larvas y determinar el porcentaje de huevos eclosionados.
Análisis estadístico:
Se aplicó un Z-test de dos colas para comparar dos proporciones (epitools.ausvet.com.au). H0: p1 – p2 = 0; en la cual, p1 es la proporción de la primera población y, p2 la proporción de la segunda. El nivel de significancia establecido fue menor a 0.05. Se usó la prueba T de Student, dos colas para comparar los promedios de huevos eclosionados de las hembras tratadas y las no tratadas, con un valor de significancia p< 0.05.
Resultados
En el Cuadro 1, se presenta los pesos promedio de las hembras utilizadas en esta investigación. Cada cepa fue comparada con un control de igual peso promedio y número de individuos, el cual se roció con agua.
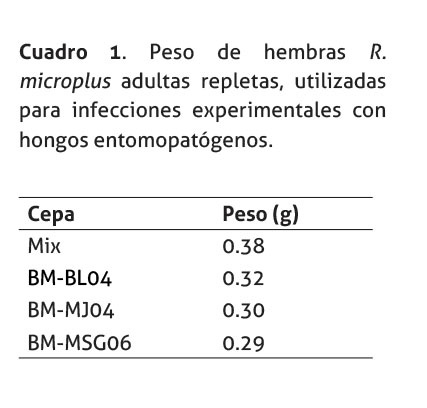
La supervivencia de las teleóginas a partir de tres días pos infección (DPI), una vez tratadas con los respectivos hongos entomopatógenos, se muestra en la figura1. Nótese que, independientemente de la dosis utilizada en los 5 DPI, las cepas BM-MSG06 y BM-BL04 y su respectiva mezcla, lograron reducir la población de adultos en un 80% y a más de un 95% durante los 13 días de observación. Por su parte, el control y la cepa BM-MJ04 (Dosis 1 y 2) tuvo una supervivencia mayor.
En el Cuadro 2, se resume los porcentajes de mortalidad de las cepas evaluadas. Las cepas BM-BL04 y BM-MSG06, lograron controlar la población de adultas en más de un 96%, independientemente de las dosis; mientras que la mezcla de cepas y la cepa BM-MJ04, provocaron una menor mortalidad. Sin embargo, la mortalidad observada, en los grupos tratados, fue significativamente mayor a la mostrada en el grupo control p<0.01.
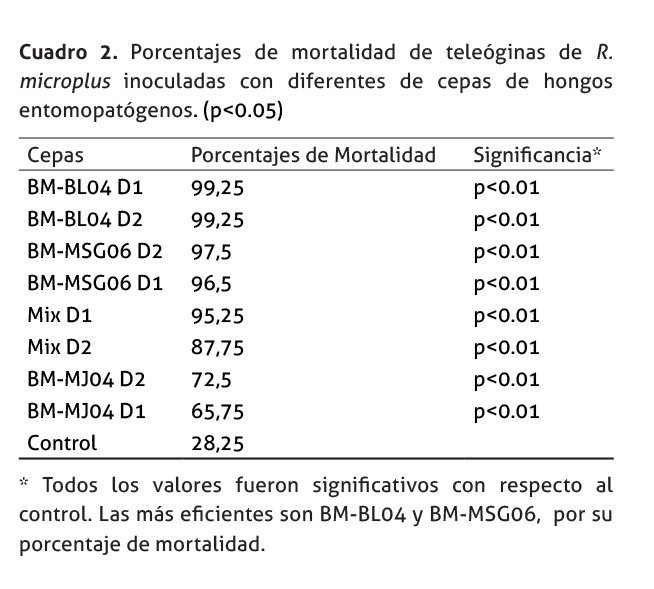
No hubo diferencias significativas cuando se comparó el nivel de mortalidad producido por las cepas BM-BL04 (en cualquiera de las dosis) y BM-MSG06 D2, p = 0.05. Tampoco hubo diferencias en el nivel de mortalidad causado entre las dos dosis de BM-MSG06, p= 0.40654. En los demás tratamientos sí se observó diferencias significativas al compararse entre sí.
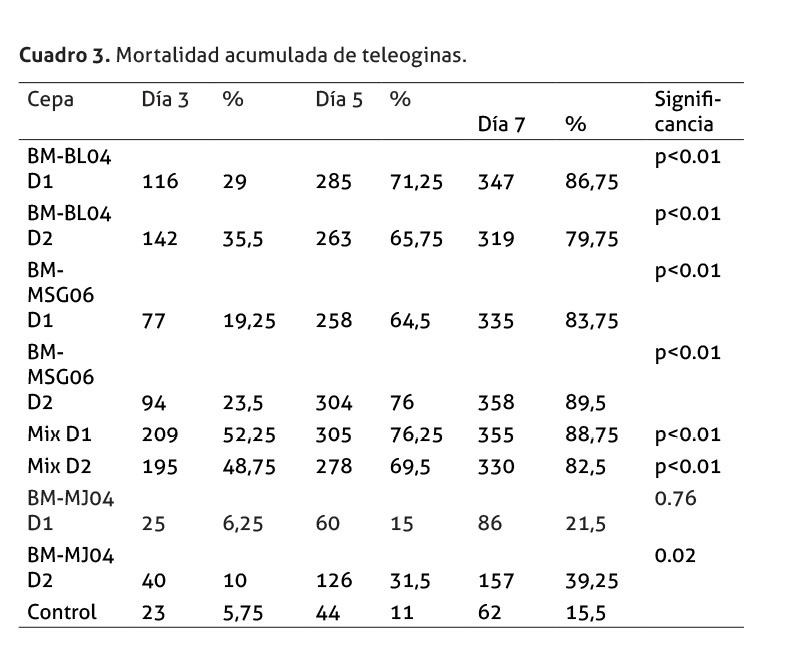
En el cuadro 3, se resume la mortalidad acumulada de las cepas y dosis evaluadas para los tres, cinco y siete días pos infección. Para determinar si existió diferencia significativa en la mortalidad provocada por las diferentes cepas de los hongos a los tres días pos infección, se realizó un análisis estadístico, el cual indicó que, con respecto al control, todas las cepas y dosis tuvieron diferencias significativas, a excepción de la cepa BM-MJ04 D1. Tampoco hubo diferencias significativas en el nivel de mortalidad entre los tratamientos Mix D1-D2, p= 0.32218; por lo cual, los hongos B. bassiana y M. anisopliae, independientemente de la dosis utilizada, son las que provocan la mayor mortalidad; mientras que la cepa BM-MJ04, en dosis 1, es el tratamiento menos efectivo. Para los días cinco y siete, la dosis 1 de la cepa BM-BL04 es la que provoca mayor mortalidad de garrapatas. Por otra parte, la BM-MJ04 dosis 1, se mantiene como el tratamiento menos efectivo; a pesar de ello, al DPI 7, la diferencia en la cantidad de garrapatas muertas de este tratamiento es significativamente mayor al presentado en el grupo testigo, p= 0.02852.
En la figura 2, se presenta la colonización de los hongos, tanto en las garrapatas adultas como los huevos que se observa a través del estudio.
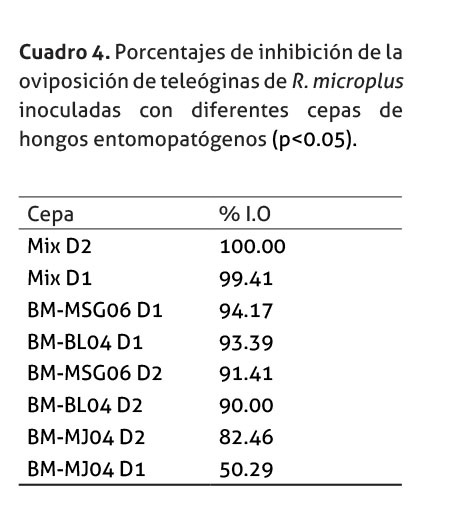
Al evaluar el efecto de las diferentes cepas de los hongos entomapatógenos sobre la inhibición de la oviposición, se encontró que la mezcla entre las cepas BM-MSG06 y BM-BL04 (ambas dosis) redujeron la oviposición de las hembras casi en un 100%, seguidas de la cepa BM-MSG06 y la BM-BL04 aplicadas individualmente. La cepa BM-MJ04 inhibió más del 50% de la oviposición, únicamente al aplicar la segunda dosis, aunque no logró inhibir tanto como en los tratamientos aplicados, cuadro 4).
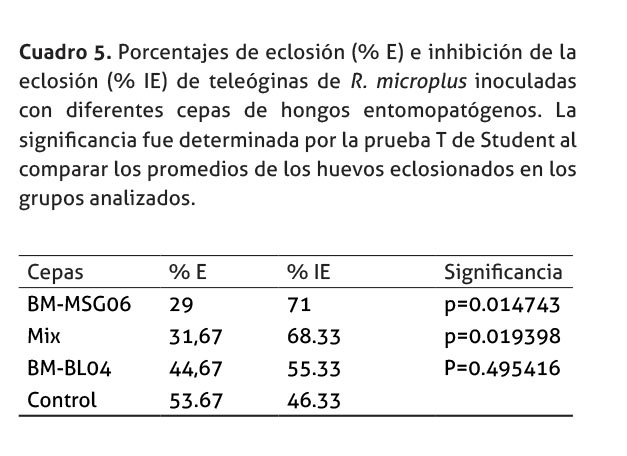
En cuanto al porcentaje de eclosión analizado, se determinó que la cepa BM-MSG06 del hongo M. anisopliae, logró inhibir, significativamente, más la eclosión de los huevos de las teleóginas al compararlas con los niveles de eclosión de las garrapatas no tratadas. En el cuadro 5, se representan los porcentajes de eclosión así como los de inhibición. Las garrapatas tratadas con la mezcla del hongo B. bassiana, y del M. anisopliae, también redujeron, significativamente, los niveles de eclosión al compararlas con las teleóginas no tratadas. Interesantemente, las garrapatas tratadas con la cepa BM-BL04 no disminuyeron, significativamente, los valores de eclosión en relación con el grupo control.
Discusión y Conclusiones
Las diferencias observadas, en la patogenicidad provocada por las cepas de los hongos, son notorias al comparar la cepa BM-MJ04 con las restantes de las cepas analizadas en el estudio, pues su virulencia fue significativamente menor, esto coincide con lo reportado por Fernández-Ruvalcaba et al. (2005a, 2010b), Guedes-Frazzon et al. (2000), y Gindini et al. (2002) pues destacan que, a pesar de que las garrapatas son susceptibles a los hongos entomopatógenos, el grado de virulencia varía considerablemente entre cepas.
Los niveles de mortalidad alcanzados, por ambas dosis de las cepas BM-BL04 y BM-MSG06, superan el 96%, tal y como lo reportan Bittencourt et al. (1997), quienes utilizaron cepas del hongo B. bassiana, al observar una eficacia del 87% para el control de hembras adultas repletas de la especie R. microplus. Este efecto, incluso, se ha encontrado en otras especies de garrapata como A. nitens (Gonzalez Monteiro et al. 1998a, 1998b, 2003; Bittencourt 2000) y otras especies (Fernández-Ruvalcaba et al. 2010).
Por su parte, al igual que en este estudio, otras investigaciones realizadas con M. anisopliae, por múltiples autores, encontraron una alta mortalidad al infestar teleóginas (Gindini et al. 2002). Fernández-Ruvalcaba et al. (2010) infectaron cepas de la garrapata R. microplus, susceptibles y resistentes a organofosforados, con suspensiones del hongo M. anisopliae desde 102 hasta 108 conidias/ml, cuantificando la mortalidad a los 10, 15 y 20 días, encontraron que M. anisopliae mostraba ser altamente infectivo para ambas cepas de garrapatas, al ser las dosis 107 y 108 las más agresivas. Este estudio fue extendido por Fernández-Ruvalcaba et al. (2010) con la infección experimental de una cepa de garrapata resistente a piretroides sintéticos y organofosforados, al obtener conclusiones similares.
Asimismo, Arguedas et al. (2008), realizaron infecciones experimentales, en laboratorio, en hembras adultas repletas, con el hongo M. anisopliae. Se estudió tanto su efecto en la mortalidad como en los factores reproductivos, al utilizar dosis de 108 a 1010 obteniéndose una mortalidad de un 98.64% en la dosis más alta del hongo.
En este estudio, en el caso de las mezclas de las cepas de B. bassiana y M. anisopliae, se obtuvo una mayor mortalidad en la menor dosis usada con respecto al control (a pesar de que en ambos casos hubo diferencia significativa al compararlos). Las mezclas, entre hongos entomopatógenos, han sido reportadas en la literatura, tanto sinérgicas como antagónicas, existen hipótesis de que en ensayos in vivo, dependiendo de la cepa y el huésped por infectar, la producción de metabolitos, intrínseca a cada hongo durante el proceso infectivo, puede afectar el desempeño de un hongo o de otro reflejándose esta competencia en una menor muerte de la plaga (Elósegui-Claro & Elizondo-Silva 2010).
Guedes-Frazzon et al., (2000), infectaron grupos de garrapatas con el hongo M. anisopliae. A los 14 días pos infección, M. anisopliae presentó 100% de mortalidad en una de las cepas utilizadas; otras no presentaron esta mortalidad. Sin embargo, al ser reaisladas y reinfectadas, nuevamente se logró provocar estos niveles de mortalidad. Este proceso de activación, realizado por estos autores, coincide con lo observado en este experimento, pues las cepas que fueron activadas desde su crecimiento, en medios de cultivo y en hembras repletas, tuvieron los mejores resultados, no así la cepa BM-MJ04, la cual se mantiene en medio convencional. Este factor ha sido observado también por Raymond et al. (2004).
La acción de los hongos B. bassiana y M. anisopliae se encuentra justificada, pues los hongos entomopatógenos son patógenos de garrapata, por sus mecanismos de acción como por su alta virulencia, su capacidad de adhesión, germinación y penetración de la cutícula y del tracto digestivo del huésped a través de mecanismos físicos y enzimáticos (Pucheta-Díaz et al. 2006; Téllez-Jurado et al. 2009), de su habilidad de infectar de una garrapata a otra (Milner 2000; Guindini et al. 2002), y de su capacidad de desarrollarse en la hemolinfa (Bittencourt 2003; Alvares Campos et al. 2005; Pucheta-Díaz et al. 2006).
La inhibición de la oviposición es otro de los parámetros estudiados. Las mezclas de los hongos, B. bassiana y M. anisopliae, utilizadas en esta investigación, controlaron hasta un 100% la oviposición; mientras que las cepas aplicadas individualmente lograron, en la mayoría de los casos, más de un ٩٠٪ al comparar con los controles. Estos resultados son relevantes al considerar que, en su ciclo de vida, la garrapata pone miles de huevos en el pasto, que eclosionan eventualmente a larvas; por lo cual, al inhibirse la oviposición, se realiza un control directo sobre la población de garrapatas futuras (Linares-Villalba 2008). Debido a la forma en la cual fueron colectados los huevos de las garrapatas expuestas a cada tratamiento, no fue posible realizar un análisis estadístico, sin embargo, porcentajes de inhibición menores a los obtenidos en este estudio han sido encontrados significativos por otros autores, como Arguedas et al. (2008).
Se ha comprobado que M. anisopliae reduce la fecundidad de las hembras (Gindini et al. 2002; Fernández-Ruvalcaba et al. 2010), al ser, en conjunto con Beauveria sp., un controlador biológico para garrapatas de varias especies, pues la producción de huevos es cinco veces más alta en los grupos control con respecto a las hembras tratadas (Fernández-Ruvalcaba et al. 2005). Los valores de eficiencia reproductiva de las hembras decrecen conforme aumentan las dosis. Las de 108 conidas/ml tiene los menores índices de postura para algunos autores (Bittencourt et al., 1994; 1996; 1997), mientras que con dosis mayores la inhibición de este parámetro puede variar de un 56 a un 77% (Arguedas et al. 2008). El grado de infección e inhibición de los hongos también se ve influenciado por factores abióticos como: rayos ultravioleta, temperatura y humedad relativa (Pucheta-Díaz et al. 2006).
Los índices de inhibición de eclosión de los huevos, por su parte, alcanzaron niveles significativos, sobre todo en el caso de la cepa BM-MSG06 al ser comparada con el control. Varios estudios han reportado resultados similares a lo largo de los años (Gonzalez Monteiro et al. 1998a, 1998b, 2003; Gindini et al. 2002; Arguedas et al. 2008, Fernández-Ruvalcaba, 2010). Incluso, se ha encontrado que otras especies de garrapata, como R. sanguineus, también pierden capacidad de eclosionar al ser infectadas con M. anisopliae y B. bassiana (Gonzalez Monteiro et al. 1998).
M. anisopliae y B. bassiana mostraron poseer la habilidad de controlar, in vitro, diferentes estadios del ciclo de vida de R. microplus, lo cual ha sido corroborado por otros estudios previos. Arguedas et al. (2008) reportaron una elevada mortalidad en larvas tratadas con M. anisopliae a las concentraciones de 109 y 1010 conidias/ml. De igual forma, Bittencourt et al. (1999) obtuvieron una alta mortalidad con una cepa de M. anisopliae en larvas de la garrapata A. nitens, mientras que Monteiro et al. (1998) observaron el mismo efecto con B. bassiana.
Lo expuesto insta a la realización de estudios de campo para corroborar su eficacia en condiciones reales y valorar su posible incorporación en el control biológico de garrapatas dentro de un manejo integrado de plagas. Esto permitiría, de alguna manera, contrarrestar el fenómeno de resistencia a moléculas químicas que se ha acentuado en los últimos años y que demanda la utilización paralela de varios métodos de control (Bittencourt et al. 1994; Rijo-Camacho 1995; Gonzales-Monteiro et al. 1998; Raymond et al. 2004; Fernández-Ruvalcaba et al, 2005, Linares -Villalba 2008; Fernández-Ruvalcaba et al. 2010).
Recomendaciones
Con el fin de aumentar la información sobre las capacidades de las cepas utilizadas en este estudio; sería importante realizar infecciones con una mayor cantidad de dosis; probar la susceptibilidad de estadios intermedios, por ejemplo larvas; cuantificar infecciones experimentales con otros hongos de uso poco común como Paecilomyces sp. y Lecanicillium lecanii; realizar estudios tanto en pastos como sobre animal de establo; evaluar los efectos de los hongos sobre otras especies de garrapatas como R. sanguineus y analizar otros parámetros como períodos de incubación o de eclosión; tiempo de postura o de prepostura y porcentaje de muda.
Agradecimientos
Al Ing. Orlando Abarca Retana por su apoyo en el desarrollo de este estudio. A Edwin Cruz Miranda por la reproducción y mantenimiento de las garrapatas. A los doctores: Roberto Bonilla Montoya y Bernal León, por su colaboración en la evaluación estadística de los datos. Al Lic. Jorge Osorio por sus apreciaciones críticas del artículo y a Tatiana Hernández por su revisión.
Referencias
Alvares Campos, R., Arruda, W., Boldo, J.T., Da Silva, M.V., Monteiro de Barros, N., De Azevedo, J.L., Schrank, A. & Henning Vainstein, M. 2005. Boophilus microplus Infection by Beauveria amorpha andBeauveria bassiana: SEM Analysis and Regulation of Subtilisin-like Proteases and Chitinases. Curr. Microbiol. 50:257–261. doi:10.1007/s00284-004-4460-y.
Álvarez, V. ١٩٩٩. Situación actual de la garrapata Boophilus microplus (Acari: Ixodidae) en Costa Rica. Situación de otras garrapatas. Pages ١١–٢٣ in Cuarto Seminario Internacional de Parasitología Animal, Jalisco, México.
Alvarez, V., & Hernández, V. 2010. Diagnóstico de resistencia a organofosforados, piretroides sintéticos, amidinas e ivermectinas en la garrapata rhipicephalus microplus en fincas de productores de leche de Costa Rica. Rev. FAVE - Ciencias Vet. 9 9:48–56.
Arguedas, M., Álvarez, V. & Bonilla, R. 2008. Eficacia del hongo Metarhizium anisopliae en el control de Boophilus microplus (Acari : Ixodidae). Agron. Costarric. 32:137–147.
Bittencourt, V.R.E.P., Bahiense, T.C., Fernandes, É.K.K. & De Souza, E.J. 2003. Avaliação da ação in vivo de Metarhizium anisopliae (Metschnikoff, 1879) Sorokin, 1883 aplicado sobre Brachiaria decumbens infesta, 1887) infestada com larvas de Boophilus microplus (Canestrini, 1887) (Acari: Ixodidae). Rev. Bras. Parasitol. Veterinária 12:38–42. doi:10.1016/j.mycres.2009.08.003.
Bittencourt, V.R.E.P., Castro Rodrigues, G., Mascarenhras, A.G. & Monteiro Gonzalez, S. 1999. Ação dos fungos Beauveria bassiana (Balsamo) Vuillemin, 1912 e Metarhizium anisopliae (Metschnikoff, 1879) Sorokin, 1883 sobre larvas do carrapato Anocentor nitens (Acari: Ixodidae). Parasitol. al día 23:3–4. doi:10.4067/S0716-07201999000300003.
Bittencourt, V.R.E.P., Mascarenhras, A.G., Castro Rodrigues, G. & Monteiro Gonzalez, S. 2000. Ação in vitro Metarhizium anisopliae (Metschnikoff, 1879) SOROKIN, 1883 e Beauveria bassiana (Balsamo) Vuillemin 1912 sobre ovos do carrapato Anocentor nitens (Neumann, 1897) (Acari: Ixodidae). Rev. Bras. Parasitol. Veterinária 22:248–251.
Bittencourt, V.R.E.P., Peralva, S.L.E. & Viegas, E.D.C. 1996. Avaliação dos efeitos do contrato de Beauveria bassiana (Bals.) Vuill com ovos e larvas de Boophilus microplus (Canestrini, 1887) (Acari: Ixodidae). Rev. Bras. Parasitol. Veterinária 5:81–84.
Bittencourt, V.R.E.P., Souza, E., Peralva, S.L.E., Mascarenhras, A.G. & Alves, S. 1997. Avaliação da eficácia in vitro de dois isolados do fungo entomopaogênico Beauveria bassiana (BALS) Vuill em fêmeas ingurgitadas de Boophilus microplua (Canestri, 1887( (Acari: Ixodidae). Rev. Bras. Parasitol. Veterinária 6:49–52.
Cardozo, H. 2007. Control Integrado de Parásitos (CIP) a la Garrapata Boophilus microplus. Aplicación del control integrado de parásitos (CIP) a la garrapata Boophilus microplus en Uruguay. Pages 3–7 in Seminario Regional. Departamento de Parasitología DILAVE “Miguel C. Rubino”, MGAP, Uruguay, TCP FAO URU 3003 A, Uruguay.
Elósegui Claro, O., & Elizondo Silva, A.I. 2010. Evaluación microbiológica in vitro de mezclas de especies de hongos entomopatógenos ingredientes activos de bioplaguicidas cubanos. Fitosanidad 14:102–109.
FAO. 2004. Guidelines for resistance management and integrated parasite control in rumiants. Animal Production and Health Division, FAO. Rome.
FAO-SENASICA-CANAPA. 2001. Curso–Taller sobre diagnóstico de resistencia a Ixodicidas en garrapatas Boophilus microplus. Page 33, Morelos, México.
Fernández-Ruvalcaba, M., Berlanga Padilla, A.M., Cruz Vázquez, C. & Hernández Velázquez, V.M. 2010. Evaluación de cepas de Beauveria bassiana y Metarhizium anisopliae sobre la inhibición de oviposición, eclosión y potencial reproductivo en una cepa triple resistente de garrapata Rhipicephalus (Boophilus) microplus (Canestrini) (Acari: Ixodidae). Entomotropica 25:109–115.
Fernández-Ruvalcaba, M., Zhioua, E. & García-Vázquez, Z. 2005. Infectividad de Metarhizium Anisopliae en contra de cepas de garrapata Boophilus microplus sensible y resistente a los organofosforados. Técnica Pecuaria en México 43:433–440.
Furlong, J. 1999. Diagnóstico de la susceptibilidad de la garrapata del ganado Boophilus microplus a los acaricidas en el Estado de Minas Gerais, Brasil. Pages 41–46 in Cuarto Seminario Internacional de Parasitología Animal, Jalisco, México.
Gindini, G., Samish, M., Zangi, G., Mishoutchenko, A. & Glazer, I. 2002. The susceptibility of different species and stages of ticks to entomopathogenic fungi.. Exp. Appl. Acarol. 28:283–8.
Guedes Frazzon, A.P., Vaz Junior, , I. da S., Masuda, A., Schrank, A. & Vainstein Henning, M. 2000. In vitro assessment of Metarhizium anisopliae isolates to control the cattle tick Boophilus microplus. Vet. Parasitol. 94:117–125. doi:10.1016/S0304-4017(00)00368-X.
Jonsson, N. & Piper, E. 2007. Integrated control programs for ticks on cattle. School of Veterinary Science. Queensland, Australia.
Linares Villaba, S.E. 2008. Manejo integral de garrapatas una propuesta eficiente y sostenible con el medio ambiente. Agronomía 16:13–21.
MAG-BCIE-FAO. 1980. Informe Final Proyecto estudio de Factibilidad para el control de la garrapata. Pages 1–118, San José, Costa Rica.
Milner, R.J. 2000. Current status of Metarhizium as a mycoinsecticide in Australia. Biocontrol 21:47–50.
Monteiro Gonzalez, S., Bahiense, T.C. & Bittencourt, V.R.E.P. 2003. Ação do fungo Beauveria bassiana (Balsamo) Vuillemin, 1912 sobre a fase parasitária do carrapato Anocentor nitens (Neumann, 1897) Schulze, 1937 (Acari: ixodidae). Ciência Rural 33:559–563. doi:10.1590/S0103-84782003000300026.
Monteiro Gonzalez, S., Bittencourt, V.R.E.P., Daemon, E. & Faccini, J.L.H. 1998a. Pathogenicity under laboratory conditions of the fungi Beauveria bassiana and Metarhizium anisopliae on larvae of the tick Rhipicephalus sanguineus (Acari: Ixodidae). Rev. Bras. Parasitol. Veterinária 7:113–116.
Monteiro Gonzalez, S., Carneiro, M.E., Bittencourt, V.R.E.P. & Daemon,E. 1998b. Efeito do isolato 986 do fungo Beauveria bassiana (Bals) Vuill sobre fêmeas ingurgitadas de Anocentor nitens Neumann, 1897 (Acari: Ixodidae). Arq. Bras. Med. Veterinária e Zootec. 50:673–676.
Nari, A. 1990. Methods currently used for the control of one-host ticks: their validity and proposals for future control strategies.. Parassitologia 32:133–43.
Prado, G., Diaz, G., Vega y Leon, S., Gonzalez, M., Perez, N., Urban, G., gutierrez, R., Ramirez, A. & Pinto, M. 1998. Residuos de plaguicidas organoclorados en leche pasteurizada comercializada en Ciudad de México. Arch. Med. Vet. 30:55–66. doi:10.4067/S0301-732X1998000100006.
Pucheta Díaz, M., Macías Flores, J.A., Navarro Rodríguez, S. & De la Torre, M. 2006. Los Hongos Entomopatógenos. Interciencia 31:856–860.
Raymomd, K., Rojas, F., Benavides, E., Cotes, A.M., Villamizar, L., Ronderos, V. & García, P. 2004. Efecto de hongos entomopatógenos sobre la garrapata del ganado Boophilus microplus (Acari: Ixodida): uso de activadores de patogenicidad. Rev. Colomb. Entomol. 30:1–10.
Rijo Camacho, E. 1995. Control biológico de Boophilus microplus (Canestri, 1878). Page in Curso internacional de lucha biológica. Instituto de Investigaciones de Sanidad Vegetal. MINAGRI.
Soberanes Céspedes, N., Santamaría Vargas, M., Fragoso Sánchez, H. & Gacía Vazquez, Z. 2002. First case reported of Amitraz resistance in the cattle tick Boophilus microplus in Mexico. Técnica Pecu. en México 40:81–92. doi:10.22319/RMCPV%1312.
Téllez-Jurado, A., Cruz-Ramírez, M.G., Mercado-Flores, Y., Asaff-Torres, A. & Arana-Cuenca, A. 2009. Mecanismos de acción y respuesta en la relación de hongos entomopatógenos e insectos. Rev. Mex. Micol. 30:73–80.

Artículo por Revista Ciencias Veterinarias se distribuye bajo una Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 Costa Rica License.
Basada en una obra en http://www.revistas.una.ac.cr/index.php/veterinaria/index.
Permisos que vayan más allá de lo cubierto por esta licencia pueden encontrarse en ciencias.veterinarias.cr@una.cr.